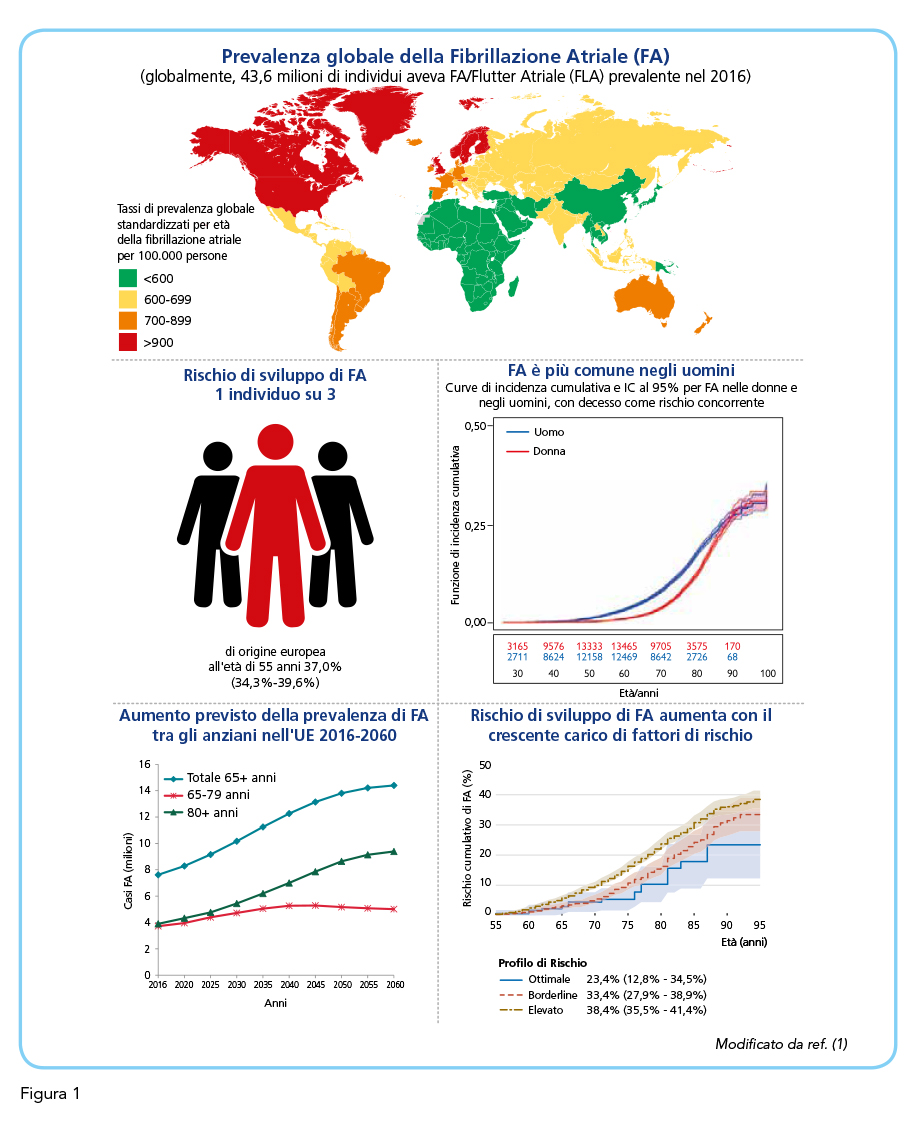
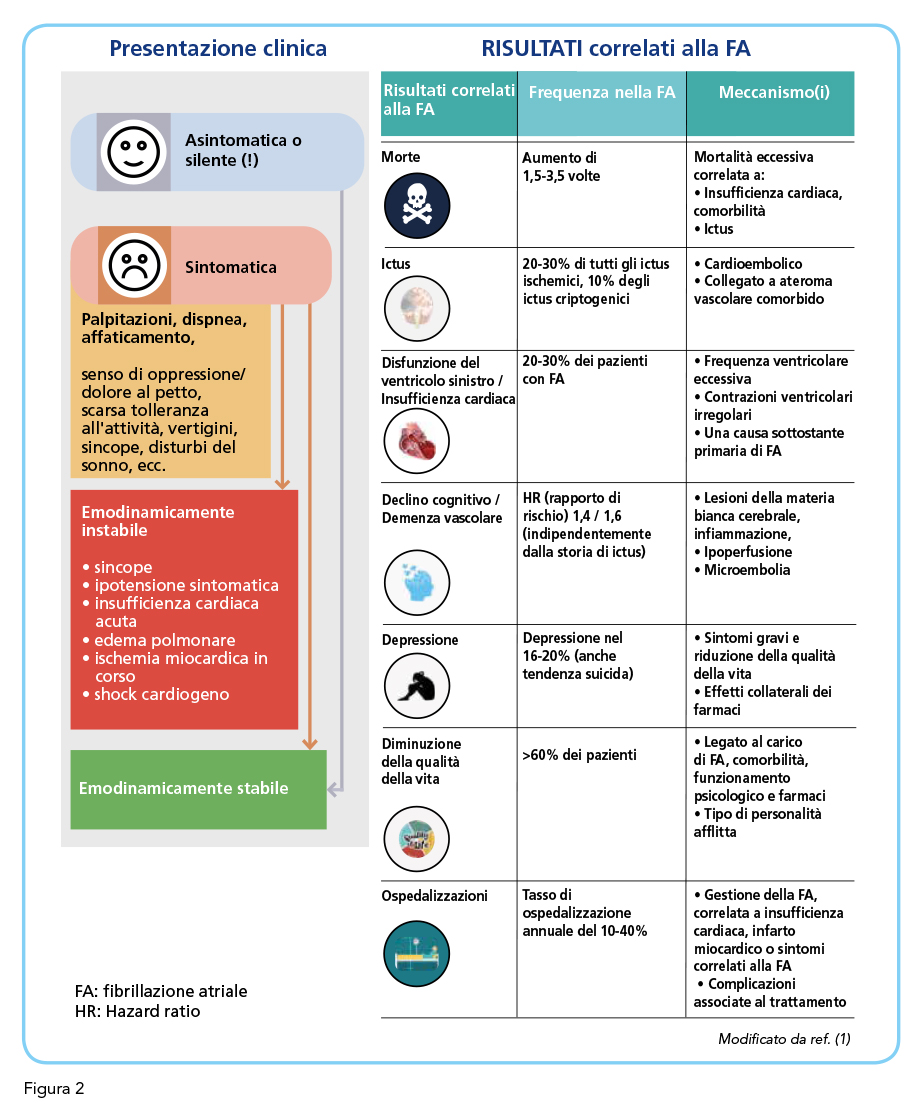
La fibrillazione atriale è l’aritmia sostenuta di più ampio riscontro nella pratica clinica. Nei prossimi decenni il numero di pazienti affetti da fibrillazione atriale è destinato a raddoppiare a causa del progressivo invecchiamento della popolazione generale, in particolare nei paesi occidentali, con conseguente espansione di quelle fasce di età tra le quali fibrillazione atriale è più frequente (Figura 1) (1). La frequenza di questa aritmia oscilla tra l’1% e il 2% nella popolazione generale ma la sua prevalenza cresce da meno dello 0.5% nei soggetti con meno di 50 anni al 3-4% nei soggetti tra 60 e 70 anni fino a raggiungere tra gli ultraottantenni una frequenza stimata nelle diverse casistiche tra il 5% ed il 15% (2-6). La notevole rilevanza epidemiologica della fibrillazione atriale si associa ad una altrettanto importante rilevanza clinica in ragione della elevata quota di mortalità e morbilità legata a questa artimia con le conseguenti ricadute sulla salute del singolo paziente e della collettività e sugli aspetti socio-economici (1). Peraltro, l’estrinsecazione clinica della fibrillazione atriale non di rado è piuttosto modesta o del tutto assente a fronte di un impatto prognostico quoad vitam e quoad valetudinem decisamente rilevante (Figura 2) (1). È importante sottolineare come la fibrillazione atriale clinicamente manifesta rappresenti solo la punta dell’iceberg di un sommerso di patologia che espone chi ne è affetto ad un rischio di eventi particolarmente elevato.
SCREENING DELLA FA
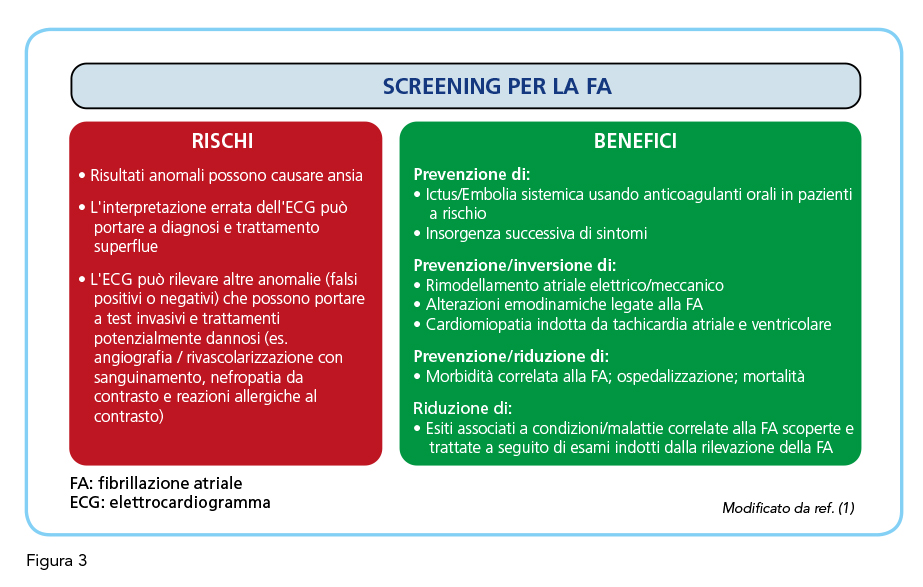
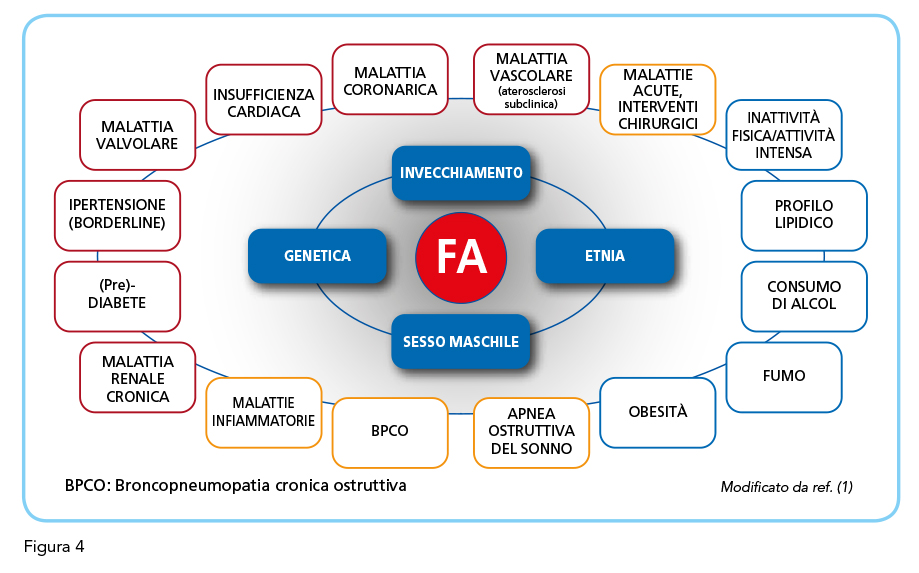
La paucisintomaticità della fibrillazione atriale ed il primo riscontro di questa aritmia in circa il 10% di tutti gli ictus ischemici, suggerisce fortemente l’opportunità di ricercarla nei soggetti a rischio, anche in assenza di sintomi, in modo da avere l’opportunità di impostare il più precocemente possibile le strategie terapeutiche/preventive più opportune. I vantaggi dello screening della fibrillazione atriale sono molteplici e comprendono: la prevenzione dell’ictus su base cardio-embolica e dell’evoluzione sintomatica dell’aritmia; la prevenzione o la regressione dei fenomeni di rimodellamento elettrico e fibroso dell’atrio; la prevenzione delle conseguenze emodinamiche legate alla irregolarità del ritmo cardiaco e dell’insorgenza di cardiomiopatia indotta dalle elevate frequenze atriale e ventricolare (1) (Figura 3). La gestione precoce delle comorbidità che frequentemente si associano alla fibrillazione atriale, la cui individuazione può essere agevolata dallo stesso riscontro precoce di questa aritmia, rappresenta un ulteriore vantaggio che può derivare dal suo screening. La possibilità di prevenire, o quantomeno ridurre, la considerevole quota di morbilità, mortalità ed ospedalizzazioni legate alla fibrillazione atriale rappresenta, ovviamente, la principale ragione per una ricerca attenta di questa aritmia, almeno nei pazienti a rischio più elevato di presentare fibrillazione atriale. La possibilità che dallo screening della fibrillazione atriale possa derivare un certo grado di ansia per il paziente rappresenta un possibile svantaggio mentre non sembra concreta la possibilità, suggerita da taluni, che da una non corretta diagnosi di fibrillazione atriale possano derivare trattamenti e/o procedure non scevri di pericoli per il paziente (1). Gli elevati costi assistenziali legati alla fibrillazione atriale misconosciuta certamente rappresentano un ulteriore elemento da considerare nella programmazione di strategie di screening (7). Lo screening opportunistico della fibrillazione atriale sembra associarsi a costi minori rispetto allo screening sistematico (8), ma la valutazione corretta del bilancio costo-benefici risente inevitabilmente del tipo di approccio seguito e del contesto clinico in cui viene condotto (9). Nei pazienti a rischio elevato, infatti, lo screening della fibrillazione sembra poter garantire innegabili vantaggi anche in ragione del profilo di rischio cardiovascolare globale elevato che nella generalità dei casi caratterizza questi pazienti. A tale riguardo, l’età rappresenta un fattore di rischio assai importante per l’insorgenza di fibrillazione ma non meno rilevante appare il contributo di fattori di rischio potenzialmente modificabili quali l’ipertensione arteriosa, il diabete mellito, lo scompenso cardiaco, la malattia renale cronica, l’obesità, la broncopneumpatia cronica ostruttiva e la sindrome delle apnee ostruttive (1) (Figura 4).
Il soggetto anziano
L’impatto clinico della fibrillazione atriale è particolarmente rilevante nell’anziano. Il rischio di ictus ischemico nella popolazione con fibrillazione atriale, infatti, è 5 volte maggiore rispetto alla popolazione generale con una diretta responsabilità di questa aritmia su circa il 20% di tutti gli eventi ischemici cerebrali sintomatici, percentuale che nei pazienti anziani ultraottantenni sale al 25-30% (10,11). La particolare suscettibilità dell’anziano a sviluppare fibrillazione atriale è in parte da ricondurre ai fenomeni di rimodellamento elettrico e anatomico a carico dell’atrio sinistro legati anche alle modificazioni fisiologiche o “parafisiologiche” del miocardio atriale dovute alla senescenza. Infatti, dal punto di vista anatomico, nel paziente anziano si osserva una progressiva e costante deposizione di tessuto amiloide nell’atrio, con conseguente perdita di elasticità e contrattilità del miocardio e dilatazione della cavità cardiaca (12). Dal punto di vista elettrico si verifica un diffuso rallentamento nella conduzione del potenziale elettrico e un aumento dei periodi refrattari dell’atrio associato ad una riduzione della frequenza di scarica del nodo del seno (13). Questi fenomeni involutivi, ovviamente, non sono sempre sufficienti ad innescare una fibrillazione atriale che, se così fosse, dovrebbe interessare tutti gli anziani. Invero, le succitate modificazioni del miocardio rappresentano per lo più condizioni predisponenti che vengono amplificate nelle loro potenzialità aritmogeniche dalla cronica esposizione nel corso della vita ai diversi fattori di rischio cardiovascolare quali l’ipertensione arteriosa o il diabete mellito. Quanto sopra esposto sottolinea l’importanza di uno screening accurato della fibrillazione atriale in questa popolazione, peraltro in progressiva espansione, in ragione della sua elevata prevalenza e dell’enorme impatto prognostico degli eventi embolici ad essa correlati sia sull’ aspettativa che sulla qualità di vita. A tale riguardo, non appare inutile sottolineare come la fibrillazione atriale rappresenti un importante determinante fisiopatologico dello sviluppo di demenza, problematica di cui sono ben note le enormi ripercussioni cliniche e socioeconomiche (1). Un intervento precoce che porti al ripristino ed al mantenimento di un ritmo sinusale o, laddove ciò non fosse possibile, che consenta di impostare precocemente una terapia anticoagulante è di rilevanza strategica per prevenire la comparsa e la progressione del declino cognitivo in questi pazienti. Opportunamente le Linee Guida della European Society of Cardiology (ESC) per la fibrillazione atriale raccomandano lo screening opportunistico della fibrillazione atriale negli ultrassessantacinquenni (classe della raccomandazione I, livello di evidenza B) e lo screening sistematico negli ultrasettantacinquenni (classe della raccomandazione IIa, livello di evidenza B) (1).
Il paziente iperteso
L’ipertensione arteriosa è il più comune fattore di rischio modificabile per l’insorgenza di fibrillazione atriale in ragione della sua elevata prevalenza nella popolazione e del suo importante ruolo fisiopatologico nella genesi delle alterazioni strutturali a livello cardiaco che tipicamente favoriscono l’insorgenza di fibrillazione atriale, quali l’ipertrofia ventricolare sinistra, la dilatazione ed il rimodellamento strutturale della parete atriale (14). Il rischio di sviluppare fibrillazione atriale nel paziente iperteso è aumentato di circa il 70% rispetto ai soggetti normotesi (15,16). È interessante notare come il rischio di sviluppare fibrillazione atriale sia aumentato anche nei pazienti con pressione normale-alta (17,18). L’ipertensione arteriosa, inoltre, incrementa il rischio di complicanze nei pazienti con fibrillazione atriale, soprattutto ictus, scompenso cardiaco ed eventi emorragici, ragione per cui i pazienti con fibrillazione atriale che presentino una storia di ipertensione, soprattutto se di lunga durata e non adeguatamente controllata, devono essere considerati a rischio elevato. Invero, la fibrillazione atriale rappresenta una sorta di mini-epidemia nell’ambito dell’ampia popolazione degli anziani ipertesi. Peraltro, l’ictus ischemico dovuto alla fibrillazione atriale è spesso devastante negli ipertesi, soprattutto se anziani, con un enorme impatto prognostico, sia quoad valetudinem che quoad vitam, e ricadute socio-economiche di vaste proporzioni (2-6).
La presenza di fibrillazione atriale, peraltro, può creare qualche criticità nella rilevazione della pressione arteriosa in ragione delle variazioni del tempo di riempimento ventricolare, della contrattilità ventricolare e dello stroke volume con conseguente incremento della variabilità battito-battito (19). Per tale motivo è fondamentale che vengano utilizzati dispositivi che hanno ricevuto le adeguate validazioni. A tale riguardo, le linee guida europee 2023 per l’ipertensione arteriosa considerano la possibilità di utilizzare dispositivi automatici oscillometrici per misurare la pressione arteriosa nei pazienti con fibrillazione atriale, anche in ragione della possibilità di utilizzare questi strumenti in ambito domiciliare (19). La notevole rilevanza dell’ipertensione arteriosa quale fattore precipitante per la fibrillazione atriale, aritmia che dovrebbe essere considerata una delle manifestazioni di danno d’organo da ipertensione, impone la necessità nel paziente iperteso con fibrillazione atriale di ottenere un controllo ottimale della pressione che miri a raggiungere un target <130/80 mmHg per ridurre il rischio di outcome sfavorevoli (19). Le Linee Guida ESC per la fibrillazione atriale raccomandano lo screening opportunistico di questa aritmia atriale nei pazienti ipertesi (classe della raccomandazione I, livello di evidenza B) (1). Questo screening, quantomai opportuno, è reso più agevole dalla disponibilità di moderni dispositivi per l’automisurazione domiciliare della pressione arteriosa, provvisti di algoritmi validati per individuare alterazioni del ritmo, suggestive della presenza di fibrillazione atriale; inoltre, sono disponibili anche dispositivi di piccole dimensioni che consentono una registrazione elettrocardiografica al proprio domicilio, della durata raccomandata dalle linee guida, per porre diagnosi di fibrillazione atriale (1).
Il paziente con broncopneumopatia cronica ostruttiva
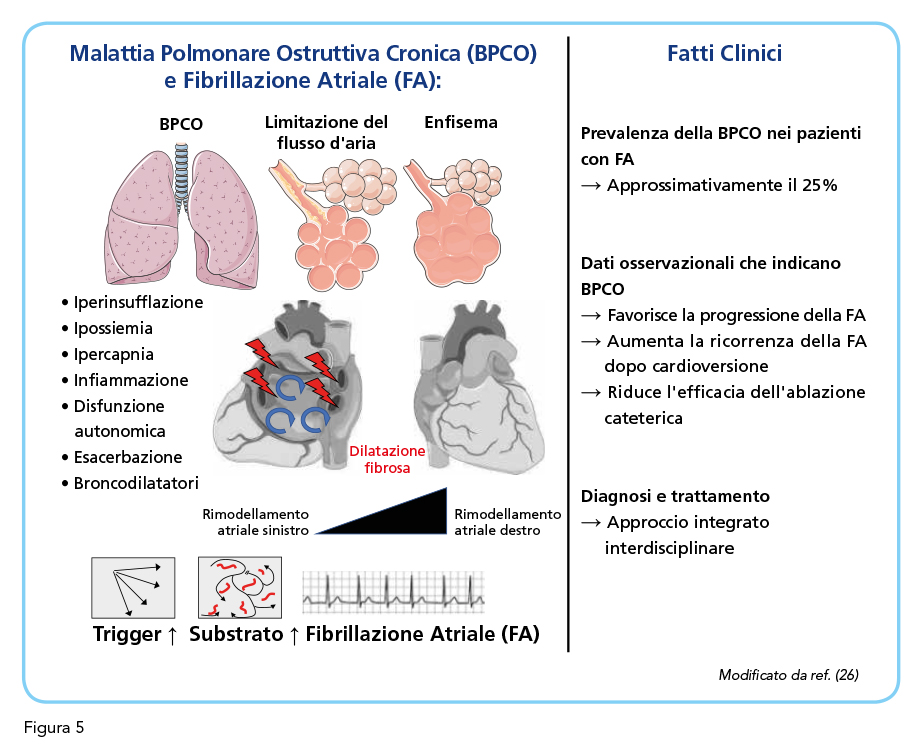
La prevalenza globale della broncopneumopatia cronica ostruttiva (BPCO) è di circa l’11% nella popolazione generale (20). Questa percentuale aumenta considerevolmente nei pazienti con fibrillazione atriale raggiungendo una prevalenza del 23% nei soggetti ultrasessantacinquenni (20-22). La prevalenza della fibrillazione atriale nei pazienti con BPCO stabile oscilla tra il 4.7% e il 15% nelle diverse casistiche con percentuali significativamente maggiori, pari a circa il 20-30%, nelle forme più severe di BPCO (23-26). Le ragioni di questa associazione tra BPCO e fibrillazione atriale vanno ricercate principalmente nella condivisione dei fattori di rischio. La BPCO, inoltre, può direttamente contribuire alla comparsa di fibrillazione atriale attraverso diversi meccanismi fisiopatologici (Figura 5) (26). Le alterazioni degli scambi gassosi, con conseguente ipossia e ipercapnia, determinano una vasocostrizione del circolo polmonare con conseguente comparsa di ipertensione polmonare che, a sua volta, favorisce la comparsa di ipertrofia ventricolare destra e disfunzione diastolica (27). L’ipossia cronica, inoltre, promuove un aumento della flogosi cronica sistemica e dello stress ossidativo che a loro volta facilitano il rimodellamento fibroso a livello atriale (28). Nel tempo la BPCO favorisce la comparsa e la progressione di insufficienza cardiaca destra (29). La presenza di condizioni cliniche concomitanti, quali l’obesità e l’ipertensione arteriosa, contribuisce in misura non trascurabile ai fenomeni di rimodellamento strutturale a livello atriale, di frequente riscontro nella BPCO. La malattia cardiovascolare rappresenta una della comorbidità più rilevanti nel paziente con BPCO. Circa il 30% dei pazienti con scompenso cardiaco presentano una storia di BPCO (30). La sindrome delle apnee ostruttive è anch’essa piuttosto frequente nei pazienti con BPCO e contribuisce in modo rilevante alla genesi di fibrillazione atriale (26). Lo sviluppo di fibrillazione atriale ed i suoi parossismi spesso si associano temporalmente alle riacutizzazioni di BPCO, favoriti nella loro insorgenza dalle alterazioni emogasanalitiche che, inducendo un aumento della pressione polmonare, possono indurre rigurgito tricuspidale che influenza la dinamica atriale. L’esacerbazione delle alterazioni emogasanalitiche legate alle riacutizzazioni di BPCO contribuisce, inoltre, all’instabilità elettrica dell’atrio destro (31). L’aumento della pressione intratoracica durante le riacutizzazioni a maggiore impronta ostruttiva rappresenta un ulteriore fattore che può favorire la comparsa di fibrillazione atriale. Da ultimo, i farmaci simpaticomimetici e parasimpaticolitici, di comune utilizzo nella gestione della BPCO, potrebbero, almeno in linea teorica, contribuire in varie misure all’insorgenza di fibrillazione atriale (32). Invero, il trattamento con agenti broncodilatatori a breve durata di azione non è associato ad alcun incremento significativo di aritmie in pazienti ospedalizzati per esacerbazioni di BPCO (33). La coesistenza di BPCO e fibrillazione atriale ha ricadute cliniche assai rilevanti. La presenza di BPCO, infatti, è associata ad una maggiore probabilità di progressione della fibrillazione atriale dalla forma parossistica alla forma persistente e ad una minore risposta al trattamento (34,35). Nei pazienti con BPCO, infatti, si osserva una riduzione dell’efficacia nel lungo termine delle procedure di cardioversione della fibrillazione atriale (34,36). Nei pazienti sottoposti ad ablazione della fibrillazione atriale, inoltre, la presenza di BPCO si associa ad una prognosi meno favorevole nel breve termine con un aumentato rischio di ospedalizzazioni, ictus e mortalità per tutte le cause (35,37-39). Nei pazienti con BPCO si osserva anche una maggiore difficoltà nel controllo della risposta ventricolare, in parte riconducibile all’uso non adeguatamente frequente di beta bloccanti in questi pazienti, per il timore, invero piuttosto inconsistente, per i beta bloccanti beta-1 selettivi, di un peggioramento della funzione respiratoria (40). La presenza di BPCO si associa ad un aumentato rischio di ospedalizzazione e di mortalità per tutte le cause nel paziente con fibrillazione atriale (44,41). Analogamente, la comparsa di riacutizzazioni di BPCO nei pazienti con fibrillazione atriale si associa ad un aumentato rischio di ospedalizzazione legata alla fibrillazione atriale nei primi 90 giorni successivi alla riacutizzazione (42,43). Circa il 30% dei pazienti ospedalizzati per BPCO presenta turbe del ritmo cardiaco che in oltre un quinto dei casi sono rappresentate dalla fibrillazione atriale (44). Da ultimo, nei pazienti con fibrillazione atriale la BPCO è tipicamente associata con una sintomatologia più eclatante, una peggiore qualità di vita e maggiore suscettibilità a sviluppare eventi cardiovascolari (45). Quanto sopra esposto suggerisce da un lato l’opportunità di una attenta valutazione della possibile presenza di fibrillazione atriale nel paziente con BPCO e dall’altro la necessità di una ottimizzazione della gestione della BPCO al fine di minimizzare il rischio di riacutizzazione il cui impatto fisiopatologico e clinico nel paziente con fibrillazione atriale è decisamente rilevante.
Il paziente con diabete mellito
Il diabete mellito è frequentemente associato a fibrillazione atriale. La prevalenza di questa aritmia è circa 2 volte maggiore nei pazienti diabetici rispetto ai soggetti non diabetici (46) e la sua incidenza aumenta progressivamente con la severità delle complicanze microvascolari del diabete (retinopatia e malattia renale) (47). Questa stretta associazione tra fibrillazione atriale e diabete mellito trova il suo substrato fisiopatologico nella frequente condivisione di alcuni determinanti di rischio, quali l’ipertensione e l’obesità (48,49) e nel ruolo predisponente del dismetabolismo glucidico sull’insorgenza di fibrillazione atriale, soprattutto nei soggetti giovani (50), favorita nella sua comparsa dalla presenza di disautonomia legata alla malattia diabetica (51). L’iperglicemia cronica, inoltre, rappresenta un importante modulatore dei fenomeni di rimodellamento atriale (52). Gli elevati livelli glicemici e le fluttuazioni della glicemia sono associate a fibrosi atriale, stress ossidativo e aumentata suscettibilità allo sviluppo di fibrillazione atriale (52). La stimolazione del sistema renina-angiotensina-aldosterone e l’induzione dell’espressione di fattori di crescita da parte dell’iperglicemia rappresentano ulteriori modulatori della sintesi di collagene con conseguente sviluppo di rimodellamento fibrotico a livello atriale (52). Da ultimo, l’iperglicemia induce la formazione di prodotti di glicazione avanzata (AGE) che, interagendo con gli specifici recettori (RAGE), favoriscono lo sviluppo di fibrosi atriale (52). La stretta associazione tra fibrillazione atriale e diabete mellito ha un impatto clinico assai rilevante. Il diabete mellito sia di tipo 1 che di tipo 2 aumenta considerevolmente il rischio di stroke, ulteriormente incrementato dalla presenza di fibrillazione atriale (53,54). La comparsa di fibrillazione atriale nel paziente diabetico non sembra venire significativamente influenzata dal controllo glicemico intensivo (55) che, tuttavia, parrebbe efficace nel prevenire le ricorrenze di fibrillazione atriale dopo terapia ablativa (56). Alcune evidenze suggeriscono la possibilità che il trattamento con metformina e pioglitazone si associ ad un ridotto rischio di insorgenza di fibrillazione atriale (57), evidenze non confermate per il rosiglitazone (47). Attualmente non sono ancora disponibili evidenze adeguatamente robuste che siano suggestive di un possibile effetto protettivo nei confronti della comparsa di fibrillazione atriale nel paziente diabetico da parte degli agonisti di glucagon-like peptide-1 (GLP-1), degli inibitori del sodium glucose cotransporter-2 (SGLT2-I) e degli inibitori di dipeptidyl peptidase-4 (DPP-4) (58). La rilevanza epidemiologica e prognostica della associazione tra fibrillazione atriale e diabete mellito suggerisce l’opportunità di uno screening attento della fibrillazione atriale anche nei pazienti con dismetabolismo glucidico.
Il paziente con eccedenza ponderale
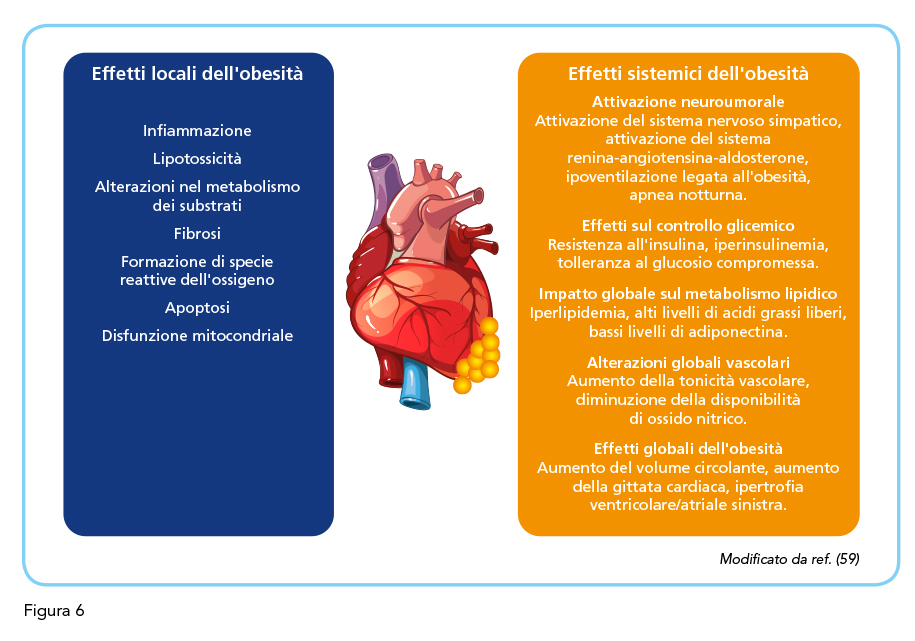
Nel corso degli ultimi anni un numero crescente di evidenze suggeriscono un ruolo indipendente dell’obesità per lo sviluppo di fibrillazione atriale (59). I dati delle coorti di Framingham e del Women’s Health Study, ad esempio, dimostrano una stretta relazione tra incremento del peso corporeo e rischio di sviluppare fibrillazione atriale (60,61,62). Nello studio Atherosclerosis Risk in Communities (ARIC) circa un quinto dei nuovi casi di fibrillazione atriale è risultato riconducibile alla presenza di un indice di massa corporea >25 kg/m2 (63,64), dati che portano ad identificare nell’eccedenza ponderale il più importante fattore di rischio modificabile per fibrillazione atriale dopo l’ipertensione arteriosa. A tale riguardo, è interessante notare come lo sviluppo in tempi brevi di eccedenza ponderale comporti un significativo incremento del rischio di fibrillazione atriale laddove la riduzione dell’eccedenza ponderale si associa ad una significativa riduzione del rischio di fibrillazione atriale (60). La relazione tra obesità e fibrillazione atriale è indipendente dalla presenza di fattori che tipicamente ad essa si associano, quali il diabete e l’ipertensione arteriosa, come pure dalla presenza di sindrome delle apnee ostruttive, condizione di frequente riscontro nel paziente obeso (65-68). Queste evidenze suggeriscono un ruolo fisiopatologico diretto dell’obesità nella genesi della fibrillazione atriale (Figura 6) (59). A tale riguardo, le alterazioni emodinamiche che accompagnano l’obesità possono contribuire in misura rilevante all’insorgenza di fibrillazione atriale. Il paziente obeso presenta spesso un aumento della volemia che si traduce in un sovraccarico funzionale a livello cardiaco con conseguenti fenomeni di rimodellamento ventricolare che nel lungo termine possono indurre ripercussioni sull’emodinamica atriale e sulla sua architettura strutturale con fibrosi e dilatazione atriale (59). L’obesità, inoltre, si accompagna ad alterazione neuro-ormonali ed endocrino-metaboliche che possono contribuire all’insorgenza della fibrillazione atriale, quali l’attivazione del sistema renina-angiotensina-aldosterone, l’insulino-resistenza e la disfunzione autonomica. L’accumulo di grasso a livello epicardico rappresenta un ulteriore determinante fisiopatologico della fibrillazione atriale nel paziente con eccedenza ponderale in ragione della sua capacità di indurre fibrosi atriale attraverso una azione paracrina delle adipocitochine, l’infiltrazione nel tessuto miocardico e il rimodellamento fibroso del tessuto adiposo nell’epicardio atriale conseguente all’infiammazione. Peraltro, alcune evidenze sperimentali suggeriscono che gli adipociti possano modulare l’elettrofisiologia dei miociti atriale (59). La presenza di apnee ostruttive, molto frequente nel paziente obeso, contribuisce ad aumentare il rischio di fibrillazione atriale attraverso molteplici meccanismi fisiopatologici che includono l’aumento dello stress ossidativo, dell’infiammazione e dell’attivazione neuro-ormonale, i fenomeni ricorrenti di ipossiemia/ipercapnia notturne, le alterazioni dell’equilibrio simpato-vagale e le variazioni della pressione intratoracica (59,69).
Il paziente con malattia renale
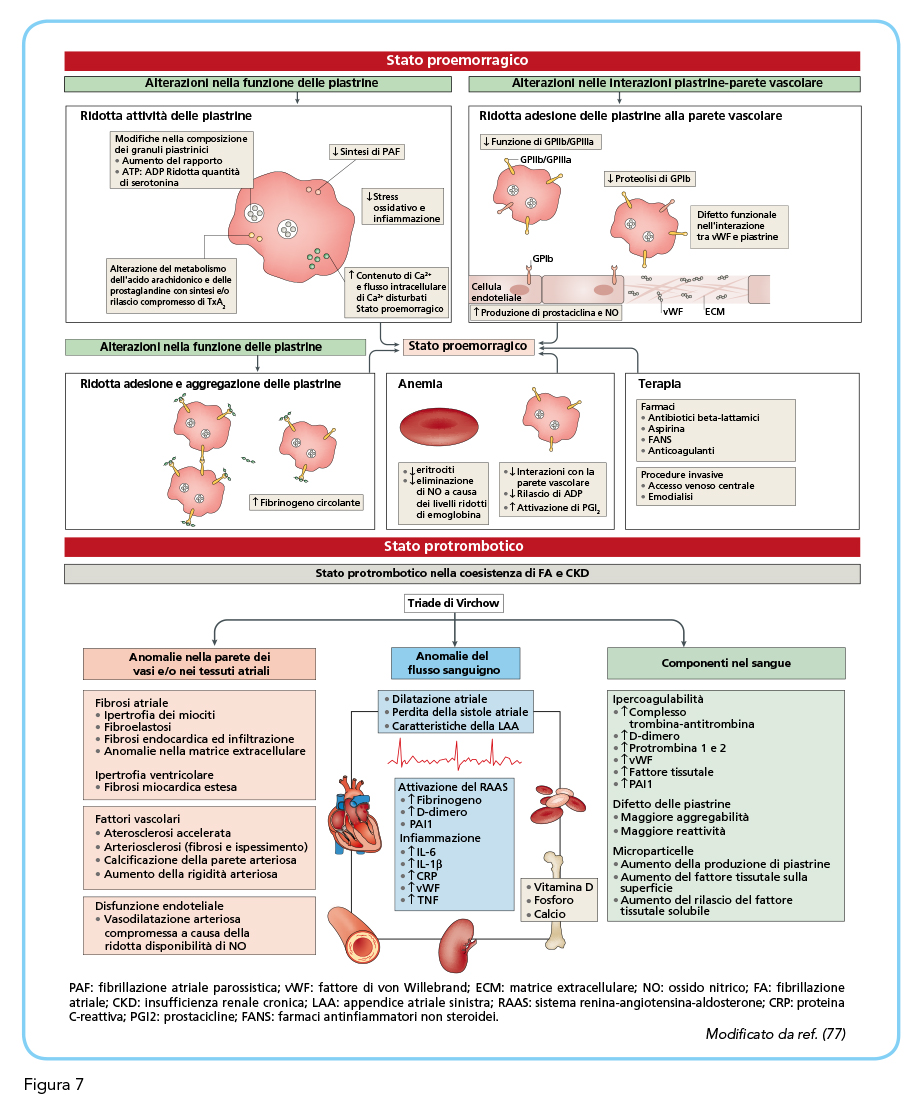
L’associazione tra malattia renale cronica e fibrillazione atriale è particolarmente rilevante sia dal punto di vista epidemiologico che per ciò che attiene le reciproche influenze fisiopatologiche, gestionali e prognostiche, di queste due condizioni cliniche (1,70). Il 15-20% dei pazienti con malattia renale hanno fibrillazione atriale la cui presenza si associa ad un aumento della mortalità (71). Un variabile grado di compromissione della funzione renale si osserva nel 40-50% dei pazienti con fibrillazione. Nei pazienti in dialisi la prevalenza della fibrillazione atriale oscilla nelle diverse casistiche tra il 7 ed il 27% ed incrementa con l’età, anche se il rischio relativo appare più alto nei giovani (72). Una prevalenza simile si osserva nell’insufficienza renale in fase pre-dialitica (73-76). Indipendentemente dalla presenza di fibrillazione atriale, la malattia renale cronica rappresenta una condizione protrombotica e proemorragica (Figura 7) (77-79), mentre la fibrillazione atriale può accelerare la progressione della malattia renale. Peraltro, la progressione del danno renale rappresenta un predittore di stroke ischemico, embolizzazione sistemica e complicanze emorragiche più importante della insufficienza renale per sè (80). L’attenzione del clinico nei riguardi della associazione tra malattia renale cronica e fibrillazione atriale è ulteriormente stimolata dalla necessità di considerare il parametro “funzione renale” nella modulazione della terapia anticoagulante (1). Ciononostante, appare opportuno che venga rivolta una attenzione sempre maggiore alla precoce identificazione della fibrillazione atriale nel paziente nefropatico per le importanti ricadute cliniche che la sua comparsa può determinare.
Il paziente con malattia cardiovascolare
L’attenzione del clinico nei riguardi della fibrillazione atriale nel paziente con malattia cardiovascolare è sempre elevata in ragione della sua elevata prevalenza in questa tipologia di pazienti e della reciproca influenza prognostica di queste condizioni cliniche. Scompenso cardiaco e fibrillazione atriale spesso coesistono e si influenzano reciprocamente dal punto di vista prognostico (1). Lo scompenso cardiaco, inoltre, è un importante determinante del rischio cardioembolico nel paziente con fibrillazione atriale. Nel paziente con sindrome coronarica acuta l’incidenza di fibrillazione atriale oscilla tra il 2 e il 23% (81) con un rischio di fibrillazione atriale di nuova insorgenza aumentato del 60-77% nei pazienti con infarto miocardico (82). Viceversa, la presenza di fibrillazione atriale si associa ad un aumentato rischio di infarto miocardico con sopraelevazione del tratto ST (STEMI) e di sindrome coronarica acuta non-STEMI (83-85). Nonostante la sensibilità del clinico nel controllare il ritmo cardiaco del paziente con malattia cardiovascolare, una particolare attenzione alla identificazione precoce di questa aritmia è comunque sempre raccomandata in ragione della sua elevata prevalenza e del suo elevato impatto prognostico in questi pazienti.
TECNICHE DI SCREENING DELLA FIBRILLAZIONE ATRIALE
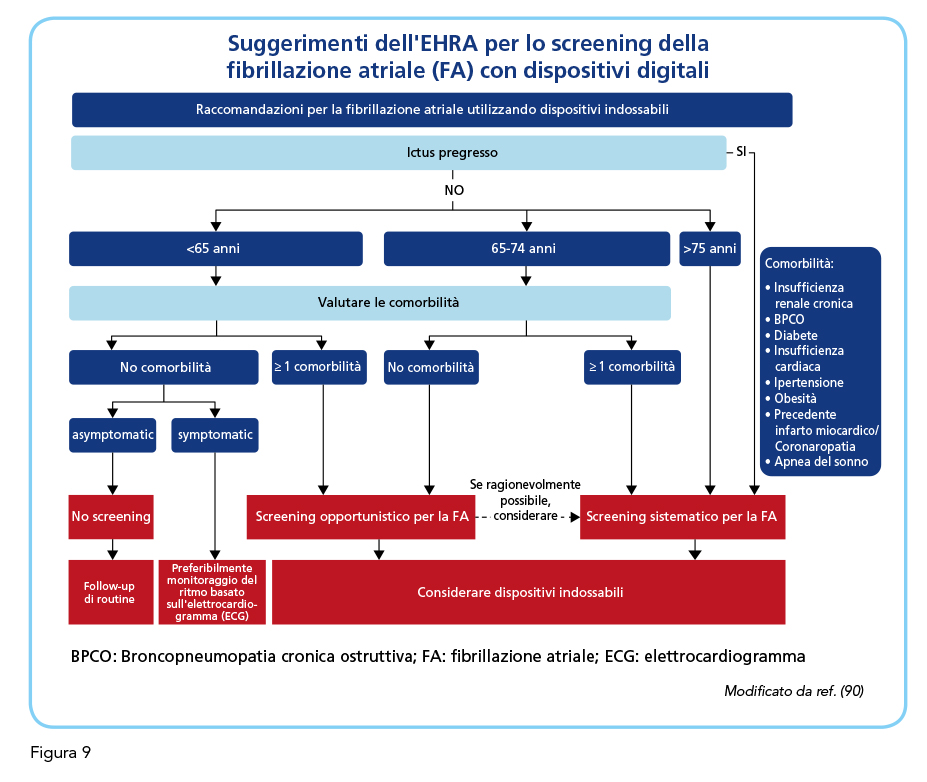
Le linee guida raccomandano lo screening opportunistico della fibrillazione atriale nelle popolazioni a rischio più elevato, quali i pazienti ipertesi o con sindrome delle apnee ostruttive e gli ultrasessantacinquenni (1,5,86). Le linee guida, inoltre, suggeriscono lo screening sistematico della fibrillazione atriale mediante elettrocardiogramma nei soggetti ultrasettantaciquenni ed in quelli ad elevato rischio di ictus (1). Lo screening opportunistico della fibrillazione atriale attraverso la palpazione del polso rappresenta l’approccio più seguito (87), ma la sua accuratezza diagnostica è piuttosto modesta, con una sensibilità dell’87% ed una specificità dell’81% (88). Invero, la fibrillazione atriale ha spesso carattere parossistico e, conseguentemente, può sfuggire alla singola rilevazione. Non di rado l’ictus embolico rappresenta l’evento con cui viene diagnosticata una fibrillazione atriale fino ad allora misconosciuta in ragione della sua sintomatologia modesta, se non del tutto assente. Per questo motivo le linee guida supportano l’uso di tecniche di monitoraggio per lo screening della fibrillazione atriale nei soggetti a rischio (1,5,86,89). In quest’ottica, oltre alla registrazione elettrocardiografica tradizionale, sono disponibili diversi sistemi per lo screening della fibrillazione atriale, alcuni dei quali con significative evidenze di validità, in termini di specificità e sensibilità, rispetto al gold standard diagnostico rappresentato ancora oggi dall’elettrocardiogramma a 12 derivazioni (Figura 8) (1). Sulla scorta di queste crescenti evidenze, le Linee Guida ESC per la fibrillazione atriale, nel sottolineare come per la diagnosi certa di fibrillazione atriale sia sempre necessaria la conferma elettrocardiografica, considerano la possibilità di utilizzare, oltre la classica registrazione elettrocardiografica a 12 derivazioni, anche una registrazione elettrocardiografica a singola derivazione con un tracciato di almeno 30 secondi (1). Invero, anche dalla registrazione di una singola derivazione possono essere derivate tutte le informazioni necessarie per individuare la presenza di fibrillazione atriale. In questo nuovo scenario tecnologico la European Heart Rhythm Association (EHRA), ha elaborato nel 2022 un Position Paper dal titolo “How to use digital devices to detect and manage arrhythmias: an EHRA practical guide” per fare il punto delle evidenze scientifiche a supporto sulle nuove tecnologie proponendo un diagramma di flusso che integra l’utilizzo delle varie tecnologie per lo screening della fibrillazione atriale, con snodi decisionali basati principalmente sull’età dei paziente e sulla sua storia clinica (Figura 9) (90). Questo documento dell’EHRA apre le porte all’uso sempre più diffuso dei moderni dispositivi che il progresso tecnologico degli ultimi anni ha reso disponibili. Il loro uso clinico, ovviamente, non può prescindere dalla rispondenza di questi dispositivi agli ovvi requisiti di validazione. Alcuni studi hanno valutato la possibilità di porre il sospetto di fibrillazione atriale utilizzando uno smartwatch, producendo evidenze di indubbio interesse, sia pur meritevoli di adeguate conferme (91,92). Non meno incoraggianti appaiono le prospettive di uno screening efficace della fibrillazione atriale ricorrendo all’intelligenza artificiale che potrebbe consentire di identificare individui con un precedente episodio di fibrillazione atriale esaminandone una registrazione elettrocardiografica in ritmo sinusale (93).
A fronte di un futuro prossimo tecnologico indubbiamente incoraggiante, esiste un presente certamente non meno interessante rappresentato dalla attuale possibilità di identificare l’enorme sommerso di fibrillazione ricorrendo ai già citati dispositivi che consentono di ottenere una registrazione di 1 o 6 derivazioni elettrocardiografiche della durata di 30 secondi, adeguata, secondo quanto indicato dalle linee guida, per lo screening della fibrillazione atriale (1). Questi dispositivi, di dimensioni contenute, comodamente riponibili in una tasca, interfacciandosi con una App dedicata, consentono di registrare addirittura 1 o 6 derivazioni elettrocardiografiche al proprio domicilio. Invero, non sono molti i dispositivi che hanno ricevuto adeguate validazioni da consentirne l’approvazione da parte di enti regolatori quali la Food and Drug Administration (FDA) (1). Tra questi, il dispositivo KardiaMobile rappresenta un esempio di connubio assai ben riuscito tra i requisiti, entrambi fondamentali, di accuratezza diagnostica e semplicità d’uso. Meritevoli di menzione, a tale riguardo, i risultati dello studio SEARCH-AF, condotto in una popolazione di 1000 ultrasessantacinquenni (età media 76 anni) utenti di farmacie, che hanno dimostrato una sensibilità nella identificazione della fibrillazione atriale del 98.5% (intervallo di confidenza, 92–100%) ed una specificità del 91.4% (intervallo di confidenza, 89–93%) (94). L’uso di questo dispositivo ha consentito di individuare una fibrillazione atriale misconosciuta nell’1.5% dei soggetti sottoposti a screening. Risultati analoghi sono stati ottenuti nello studio AF-SMART, condotto in una popolazione di 1805 individui ultrasessantacinquenni seguiti in un contesto di primary care, nel corso del quale l’uso di KardiaMobile ha consentito di individuare una fibrillazione atriale misconosciuta nell’1.1% dei soggetti sottoposti a screening (95). In un ulteriore studio, che ha coinvolto 184 medici di medicina generale canadesi chiamati ad effettuare uno screening della fibrillazione atriale nei loro pazienti ultrasessantacinquenni in un arco temporale di 3 mesi, l’uso di questo dispositivo ha consentito di identificare 471 casi di fibrillazione atriale misconosciuta su un totale di 7885 pazienti sottoposti a screening (96). La prevalenza del 6.2%, decisamente elevata, esprime probabilmente una particolare attenzione dei medici coinvolti nel ricercare la fibrillazione atriale nei loro pazienti a più alto rischio. La semplicità d’uso rappresenta indubitabilmente un valore aggiunto per ogni dispositivo che debba poter essere utilizzato prevalentemente in ambito domiciliare. A tale riguardo, il dispositivo KardiaMobile si interfaccia direttamente con una App dedicata scaricata sul proprio smartphone. Basta appoggiare i polpastrelli di una o due dita di ciascuna mano sui due elettrodi posti sulla parte superiore del dispositivo per avviare la registrazione di una traccia elettrocardiografica che si completa dopo 30 secondi. Esiste anche la possibilità, limitatamente a KardiaMobile 6L, di registrare 6 derivazioni appoggiando la parte inferiore del dispositivo sulla coscia sinistra, in prossimità del ginocchio, o sulla caviglia della stessa gamba, mentre si tengono i polpastrelli sui 2 elettrodi superiori. Non meno importante è l’utilizzo di dispositivi per la misurazione della pressione arteriosa dotati di un algoritmo validato per individuare la possibile presenza di fibrillazione atriale. Considerata la frequenza e la rilevanza clinica dell’associazione tra ipertensione arteriosa e fibrillazione atriale, appare immediatamente evidente l’utilità di questi dispositivi per la misurazione domiciliare della pressione arteriosa, anche in considerazione del fatto che l’automisurazione domiciliare della pressione arteriosa rappresenta attualmente uno dei pilastri su cui poggia la gestione dell’ipertensione arteriosa (19,97).
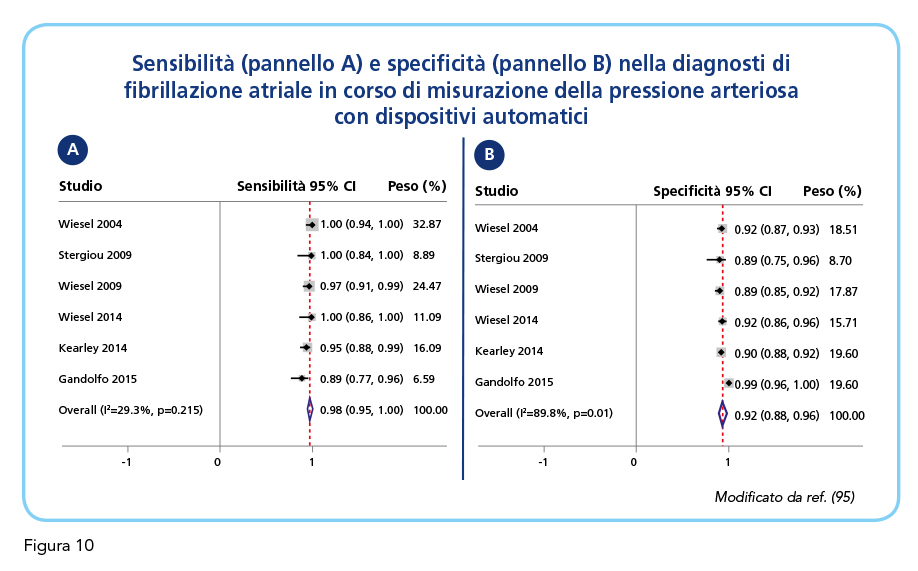
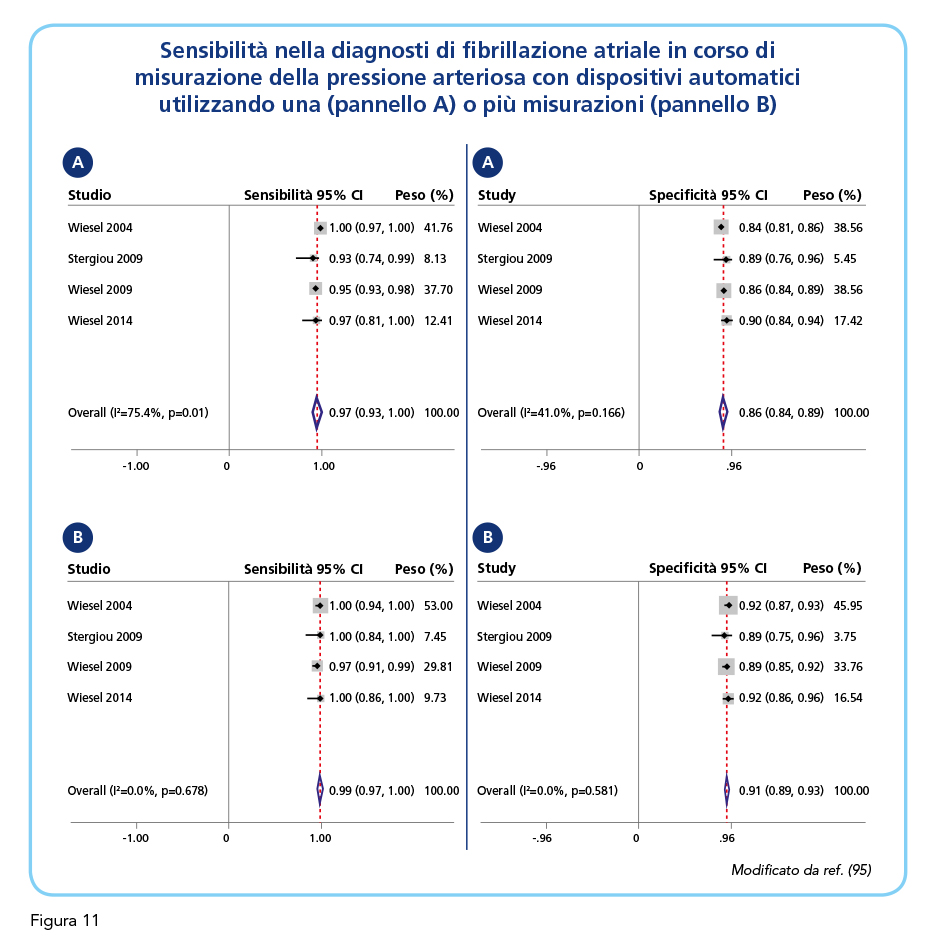
L’accuratezza diagnostica dell’identificazione della fibrillazione atriale durante la misurazione automatica della pressione arteriosa dipende molto dal numero di misurazione ottenute (98). Gli strumenti utilizzati per la misurazione domiciliare sono programmati per effettuare 3 misurazioni pressorie in sequenza per poi fornire un valore pressorio medio sulle 3 rilevazioni unitamente all’indicazione relativa alla presenza o meno di fibrillazione atriale. Le ragioni alla base di questa triplice rilevazione sono sostanzialmente 3 (98). In primo luogo, gli studi clinici suggeriscono che la ripetizione di 3 misurazioni consente di avere una stima più affidabile della pressione “reale” del paziente. Le linee guida raccomandano di effettuare almeno 2 rilevazioni pressorie e di prevedere misurazioni addizionali nel caso in cui le prime due differiscano considerevolmente (5 o più mmHg) tra di loro (19,97). In secondo luogo, l’effettuazione di misurazioni ripetute consente di superare le problematiche relative alla stima esatta della pressione arteriosa nei pazienti con irregolarità del ritmo cardiaco (99). Da ultimo, l’accuratezza diagnostica (in termini di specificità e sensibilità) nell’identificazione di una possibile fibrillazione atriale viene implementata dalle misurazioni ripetute (100). Una meta-analisi di 6 studi finalizzati alla valutazione dell’affidabilità diagnostica della misurazione automatica della pressione arteriosa nell’identificazione della fibrillazione atriale ha evidenziato una sensibilità pari a 0.98 (intervallo di confidenza al 95% compreso tra 0.95 e 1.00) ed una specificità pari a 0.92 (intervallo di confidenza al 95% compreso tra 0.88 e 0.96) (Figura 10) (98). L’uso di misurazioni ripetute è risultato associato ad un incremento, sia pur modesto, della sensibilità (da 0.97 con un intervallo di confidenza al 95% compreso tra 0.93 e 1.00 a 0.99 con un intervallo di confidenza al 95% compreso tra 0.97 e 1.00) e della specificità (da 0.86 con un intervallo di confidenza al 95% compreso tra 0.84 e 0.89 a 0.91 con un intervallo di confidenza al 95% compreso tra 0.89 e 0.93) (Figura 11). È evidente che l’utilità diagnostica dei dispositivi automatici per la misurazione della pressione arteriosa nell’individuazione della fibrillazione atriale è condizionata dalla validità degli algoritmi utilizzati. A questo riguardo è meritevole di menzione un recente studio condotto in 99 pazienti anziani (età media 70.2 anni) sottoposti simultaneamente a registrazione elettrocardiografica e a misurazione della pressione arteriosa con dispositivo automatico (Omron BP785N) provvisto di uno specifico algoritmo per la rilevazione di una possibile fibrillazione atriale. Questo studio ha dimostrato una accuratezza diagnostica dell’87.88% con una sensibilità del 100% ed una specificità dell’84.8% (101). In linea con queste evidenze uno studio, anch’esso, condotto in 227 pazienti in trattamento dialitico cronico ha dimostrato per il dispositivo Omron M6 una accuratezza diagnostica pari a 93.4% (intervallo di confidenza al 95% compreso tra 88.0 e 95.0), una sensibilità pari a 83.0% (intervallo di confidenza al 95% compreso tra 59.0 e 96.0) ed una specificità pari a 94% (intervallo di confidenza al 95% compreso tra 90.0 e 97.0) (102). Uno studio di confronto condotto da Marazzi G et al (103) in 503 pazienti ipertesi consecutivi sottoposti a misurazione della pressione arteriosa con 2 diversi dispositivi automatici dotati di algoritmo per la identificazione di irregolarità del ritmo cardiaco ha dimostrato per Omron M6 una sensibilità nella identificazione della fibrillazione atriale del 100%, una specificità del 94% ed una accuratezza diagnostica del 95% e per Microlife BP A200 Plus una sensibilità del 92%, una specificità del 97% ed una accuratezza diagnostica del 94%. Non appare inutile sottolineare l’importanza della semplicità degli strumenti automatici per la misurazione pressoria che ne consente l’agevole utilizzo anche da parte di soggetti anziani, tra i quali la fibrillazione atriale è particolarmente frequente. La possibilità, offerta da alcuni moderni dispositivi per l’automisurazione della pressione arteriosa, di effettuare misurazioni attendibili anche in presenza di circonferenze brachiali considerevoli rappresenta un ulteriore vantaggio pratico in ragione che il paziente iperteso con eccedenza ponderale presenta un elevato rischio di sviluppare fibrillazione atriale. La ricerca tecnologica ha reso oggi disponibili speciali manicotti – quali l’Intelli-wrap-cuff in dotazione con il misuratore automatico Omron M6 comfort-IT – che consentono di misurare correttamente la pressione arteriosa fino a 42 cm di circonferenza brachiale. Queste speciale manicotto, peraltro, consente di rilevare la pressione con accuratezza senza risentire di eventuali malposizionamenti a livello del braccio, dovuti ad una destrezza non sempre ottimale, che possono determinare una non trascurabile variabilità delle rilevazioni pressorie. Invero, questo aspetto appare non poco rilevante perchè il posizionamento non adeguato del bracciale rappresenta uno degli errori metodologici più spesso compiuti dal paziente e può portare ad una significativa sovrastima dei valori pressori. Mediamente un paziente su tre non posiziona correttamente la zona rilevatrice del bracciale rispetto all’arteria omerale. Un’ulteriore implementazione della misurazione domiciliare della pressione arteriosa è rappresentato dalla possibilità, offerta dai moderni dispositivi, del telemonitoraggio in remoto dei valori pressori misurati a livello domiciliare. In effetti la teletrasmissione a distanza dei dati automisurati si è dimostrata in grado di favorire un migliore controllo dell’ipertensione arteriosa (104). Questo aspetto appare di particolare rilevanza nella gestione dell’ipertensione in alcuni contesti clinici in cui l’interazione medico-paziente, anche da remoto, è particolarmente importante in ragione della relativa volubilità dell’assetto clinico come accade, ad esempio, nei pazienti con malattia renale cronica o scompenso cardiaco in fase avanzata. I pazienti ipertesi con malattia renale cronica generalmente seguono terapie molto complesse che prevedono quasi sempre l’utilizzo di diuretici e che sono soggette a una revisione col variare delle condizioni climatiche. La titolazione è quasi sempre necessaria, sistematica e se da un lato è importante che il paziente possa interagire agevolmente con il medico per la gestione dei farmaci, anche a distanza, del pari importante è l’acquisizione da parte del paziente con malattia renale cronica di un certo grado di autonomia gestionale della propria terapia sulla scorta dell’andamento dei propri valori pressori tenendo sotto controllo il proprio ritmo cardiaco. In questo ambito, alcuni moderni dispositivi – quali l’ORMON Complete – consentono la contemporanea misurazione della pressione arteriosa e la registrazione di un tracciato elettrocardiografico della durata di 30 secondi con un elettrocardiogramma a singola derivazione, coniugando in modo ideale le esigenze di una misurazione pressoria accurata con l’opportunità di uno screening adeguato della fibrillazione atriale in un contesto clinico, vale la pena ribadirlo, in cui la fibrillazione atriale è particolarmente frequente ed estremamente rilevante in chiave prognostica. Questa doppia funzionalità permette di poter contemporaneamente monitorare i valori pressori, la frequenza cardiaca e di registrare il tracciato elettrocardiografico, per la ricerca e segnalazione di eventuali anomalie cardiache attribuibili alla fibrillazione atriale. Il device, molto semplice da utilizzare, permette di comunicare con uno smartphone attraverso una App dedicata in modo che durante la misurazione della pressione arteriosa ed il tracciato elettrocardiografico, il tutto sia visibile, registrato, archiviato e condivisibile sulla App. L’algoritmo di cui questi device dispongo permette di restituire al paziente informazioni chiare ed affidabili, in seguito alla registrazione del proprio tracciato elettrocardiografico, in modo che queste possano poi essere condivise con il proprio medico di Medicina Generale o con il proprio specialista di riferimento. È evidente come questa tipologia di dispositivi possa trovare una sua collocazione, sulla scorta di quanto previsto dalla Linee Guida ESC e dal position paper dell’EHRA (1,90), nella ricerca opportunistica della fibrillazione atriale nella popolazione under 65 con almeno una comorbidità e nella ricerca sistematica della fibrillazione atriale nella popolazione degli ultrasessantacinquenni con o senza comorbilità.
CONSIDERAZIONI DI COSTO/EFFICACIA
La fibrillazione atriale è un problema di sanità pubblica con un impatto economico enorme. Nel 2010 le stime epidemiologiche parlavano di 33 milioni di pazienti con fibrillazione atriale nel mondo, cifra destinata a raddoppiarsi nel 2050 (1). La fibrillazione atriale comporta enormi costi per la collettività, sia diretti (principalmente ospedalizzazioni, visite ambulatoriali, accertamenti laboratoristi e strumentali) che indiretti (principalmente perdita di produttività e costi per caregiver), per un corrispettivo che nei paesi europei viene stimato intorno al 2.5% della spesa sanitaria annua totale (105). Tali costi sono soprattutto legati ai ricoveri e alla possibile insorgenza di complicanze tra cui spicca per rilevanza clinica ed impatto economico l’ictus (105,106). Entro il 2030 si prevede un aumento del numero di episodi di ictus e visite mediche legate alla fibrillazione atriale con 280-340.000 nuovi episodi di ictus ischemici, 3.5-4 milioni di ricoveri e 100-120 milioni di visite ambulatoriali (107).
Queste cifre, unitamente all’impatto non di rado devastante delle complicanze della fibrillazione atriale sullo stato di salute di chi ne è affetto, sottolineano l’opportunità di impostare strategie di screening che, attraverso una diagnosi precoce della fibrillazione atriale, consentano una gestione ottimale di questa aritmia impostando trattamenti e strategie di prevenzione efficaci. Basti pensare alla documentata efficacia della terapia anticoagulante di ridurre di oltre il 65% il rischio di ictus embolico (1). Non sorprende, quindi, che il già citato studio SEARCH-AF abbia dimostrato un rapporto costo/efficacia incrementale estendendo lo screening della fibrillazione atriale a livello di comunità con un risparmio, basato su una ipotesi di aderenza alla terapia anticoagulante con warfarin del 55%, di 3.142 euro per ogni anno di vita pesato per qualità di vita guadagnato e di 15.993 euro per ogni ictus prevenuto (94).
Recentemente il favorevole rapporto costo/efficacia dello screening della fibrillazione atriale con dispositivi portatili per la registrazione elettrocardiografica ha trovato conferma in uno studio inglese condotto in individui ultrasettantacinquenni che ha dimostrato un rapporto costo/efficacia incrementale di oltre 1000 sterline per ogni anno di vita pesato per qualità di vita guadagnato (108). I principali determinanti di questo vantaggio sono risultati rappresentati dai costi dell’assistenza a lungo termine per i casi di ictus, la prevalenza della fibrillazione atriale non valvolare misconosciuta e l’efficacia clinica della terapia anticoagulante nella prevenzione dell’ictus.
CONCLUSIONI
L’approccio tradizionale, rappresentato dalla palpazione del polso finalizzata a cogliere gli aspetti semeiologici del “delirium cordis”, tipico della fibrillazione atriale, è gravato da una accuratezza diagnostica modesta rispetto alla rilevanza della condizione cliniche che ci prefigge di individuare, anche in ragione del carattere parossistico della fibrillazione atriale che, conseguentemente, può sfuggire alla singola rilevazione da parte del clinico. Il progresso tecnologico ha reso oggi disponibili strumenti affidabili che possono essere gestiti direttamente da parte del paziente. Tra questi meritano particolare menzione i moderni dispositivi che consento di derivare, interfacciandosi con una App dedicata, una registrazione elettrocardiografica di 1 o più derivazioni della durata di 30 secondi, nel rispetto di quanto raccomandato dalle linee guida. Questi dispositivi rappresentano una opportunità preziosa per lo screening della fibrillazione atriale, in quanto sono gestiti direttamente dal paziente; queste rilevazioni possono essere effettuate dal paziente secondo le indicazioni del proprio medico di riferimento, il quale dovrà sempre coordinare ogni procedura di screening. Non meno importante è l’utilizzo di dispositivi per la misurazione della pressione arteriosa dotati di un algoritmo validato per individuare la possibile presenza di fibrillazione atriale. Considerata la frequenza e la rilevanza clinica dell’associazione tra ipertensione arteriosa e fibrillazione atriale, appare immediatamente evidente l’utilità di questi dispositivi per la misurazione domiciliare della pressione arteriosa. Peraltro, attualmente sono disponibili dispositivi che consentono la contemporanea misurazione della pressione arteriosa e la registrazione di un tracciato elettrocardiografico della durata di 30 secondi, con un elettrocardiogramma a singola derivazione coniugando in modo ideale le esigenze di una misurazione pressoria accurata con l’opportunità di uno screening adeguato della fibrillazione atriale.
Bibliografia
- Hindricks G, et al; ESC Scientific Document Group. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J. 2021 Feb 1;42(5):373-498.
- Kirchhof P, et al. Comprehensive risk reduction in patients with atrial fibrillation: emerging diagnostic and therapeutic options. Executive summary of the report from the 3rd AFNET/EHRA consensus conference. Thromb Haemost. 2011;106:1012–1019.
- McIntyre WF, Healey J. Stroke prevention for patients with atrial fibrillation: beyond the guidelines. J Atr Fibrillation. 2017;9:1475. doi: 10.4022/jafib.147
- Chugh SS, et al. Global burden of atrial fibrillation in developed and developing nations. Glob Heart. 2014;9:113–119.
- Kirchhof P, et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur J Cardiothorac Surg. 2016;50:e1–e88.
- Chugh SS, et al. Worldwide epidemiology of atrial fibrillation: a Global Burden of Disease 2010 Study. Circulation. 2014;129:837–847.
- Turakhia MP, et al. Economic burden of undiagnosed nonvalvular atrial fibrillation in the United States. Am J Cardiol 2015;116:733-739.
- Mairesse GH, et al. ESC Scientific Document Group. Screening for atrial fibrillation: a European Heart Rhythm Association (EHRA) consensus document endorsed by the Heart Rhythm Society (HRS), Asia Pacific Heart Rhythm Society (APHRS), and Sociedad Latinoamericana de Estimulacion Cardiaca y Electrofisiologia (SOLAECE). Europace 2017;19:1589-1623.
- Fay MR, et al. Screening of older patients for atrial fibrillation in general practice: current evidence and its implications for future practice. Eur J Gen Pract 2017;23:246-253.
- Lakshminarayan K, et al. Atrial fibrillation and stroke in the general medicare population: a 10- year perspective (1992 to 2002). Stroke 2006; 37(8):1969-74
- Marinigh R, Lip GY, Fiotti N, et al. Age as a risk factor for stroke in atrial fibrillation patients: implications for thromboprophylaxis. Journal of the Ame- rican College of Cardiology 2010; 56(11):827-837
- Rocken C, et al. An arrhythmogenic substrate for persistent atrial fibrillation. Circulation 2002; 106:2091-97
- Kistler P, Sanders P, Fynn S et al. Electrophysiologic and Electroanatomic changes in the human atrium associated with age. JACC 2004; 44:109-16
- Ha JT, et al. Benefits and harms of oral anticoagulant therapy in chronic kidney disease: a systematic review and meta-analysis. Ann Intern Med 2019;171:181-189.
- Lip GYH, et al. Hypertension and cardiac arrhythmias: a consensus document from the European Heart Rhythm Association (EHRA) and ESC Council on Hypertension, endorsed by the Heart Rhythm Society (HRS), Asia-Pacific Heart Rhythm Society (APHRS) and Sociedad Latinoamericana de Estimulacion Cardiaca y Electrofisiologia (SOLEACE). Europace 2017;19:891 911.
- Dzeshka MS, et al. Atrial fibrillation and hypertension. Hypertension 2017;70:854-861.
- Pokorney SD. RENal hemodialysis patients ALlocated apixaban versus warfarin in Atrial Fibrillation (RENAL-AF). Presentation at the American Heart Association Annual Scientific Sessions (AHA 2019), Philadelphia, PA, 16 November 2019.
- Violi F, et al. ARAPACIS Study Investigators. Prevalence of peripheral artery disease by abnormal ankle-brachial index in atrial fibrillation: implications for risk and therapy. J Am Coll Cardiol 2013;62:2255-2256.
- Mancia G, et al. Authors/Task Force Members:. 2023 ESH Guidelines for the management of arterial hypertension The Task Force for the management of arterial hypertension of the European Society of Hypertension Endorsed by the European Renal Association (ERA) and the International Society of Hypertension (ISH). J Hypertens. 2023 Jun 21. doi: 10.1097/HJH.0000000000003480.
- Buist AS, et al. BOLD Collaborative Research Group. International variation in the prevalence of COPD (the BOLD Study): a population-based prevalence study. Lancet 2007;370:741–750.
- Proietti M, et al. EORP-AF Investigators. Impact of chronic obstructive pulmonary disease on prognosis in atrial fibrillation: a report from the EURObservational Research Programme Pilot Survey on Atrial Fibrillation (EORP-AF) general registry. Am Heart J 2016;181:83–91.
- Rodrıguez-Manero M, et al. A prospective study of the clinical outcomes and prognosis associated with comorbid COPD in the atrial fibrillation population. Int J Chron Obstruct Pulmon Dis 2019;14:371–380.
- Konecny T, et al. Relation of chronic obstructive pulmonary disease to atrial and ventricular arrhythmias. Am J Cardiol 2014;114:272–277.
- Liao KM, et al. Incidence and risk factors of atrial fibrillation in Asian COPD patients. Int J Chron Obstruct Pulmon Dis. 2017 Aug 23;12:2523-2530.
- Chen X, et al. The progression in atrial fibrillation patients with COPD: a systematic review and meta-analysis. Oncotarget. 2017 Oct 26;8(60):102420-102427.
- Simons SO, et al. Chronic obstructive pulmonary disease and atrial fibrillation: an interdisciplinary perspective. Eur Heart J. 2021 Feb 1;42(5):532-540.
- Elia D, et al. Pulmonary hypertension and chronic lung disease: where are we headed? Eur Respir Rev 2019;28:190065.
- Linz D, et al. Associations of obstructive sleep apnea with atrial fibrillation and continuous positive airway pressure treatment: a review. JAMA Cardiol 2018;3:532–540.
- Agust A, et al. Update on the pathogenesis of chronic obstructive pulmonary disease. N Engl J Med 2019;381:1248–1256.
- Canepa M, et al. Diagnostic and therapeutic gaps in patients with heart failure and chronic obstructive pulmonary disease. JACC Heart Fail 2019;7:823–833.
- Stevenson IH, et al. Atrial electrophysiology is altered by acute hypercapnia but not hypoxemia: implications for promotion of atrial fibrillation in pulmonary disease and sleep apnea. Heart Rhythm 2010;7:1263–1270.
- Linz D, et al. Atrial autonomic innervation: a target for interventional antiarrhythmic therapy?. Int J Cardiol 2019;287:181–188.
- Santus P, et al. Switching to nebulised short acting bronchodilators does not increase the risk of arrhythmia in patients hospitalized with a COPD exacerbation. Pharmacol Res. 2021 Nov;173:105915. doi: 10.1016/j.phrs.2021.105915. Epub 2021 Sep 25. PMID: 34571145.
- Pisters R, et al. for the Euro Heart Survey Investigators. Clinical correlates of immediate success and outcome at 1-year follow-up of real-world cardioversion of atrial fibrillation: the Euro Heart Survey. Europace 2012;14:666–674.
- Gu J, et al. Impact of chronic obstructive pulmonary disease on procedural outcomes and quality of life in patients with atrial fibrillation undergoing catheter ablation. J Cardiovasc Electrophysiol 2013;24:148–154.
- Emren SV, et al. The role of HATCH score in predicting the success rate of sinus rhythm following electrical cardioversion of atrial fibrillation. Kardiol Pol 2016;74:978–984.
- Roh SY, et al. Catheter ablation of atrial fibrillation in patients with chronic lung disease. Circ Arrhythm Electrophysiol 2011;4:815–822.
- Arora S, et al. Causes and predictors of readmission in patients with atrial fibrillation undergoing catheter ablation: a national population-based cohort study. J Am Heart Assoc 2018;7:e009294.
- Seara JG, et al. Risk of atrial fibrillation, stroke, and death after radiofrequency catheter ablation of typical atrial flutter. Clin Res Cardiol 2014;103:543–552.
- Dransfield MT, et al. SUMMIT Investigators. b-Blocker therapy and clinical outcomes in patients with moderate chronic obstructive pulmonary disease and heightened cardiovascular risk. An observational substudy of SUMMIT. Ann Am Thorac Soc 2018;15:608–614.
- Mendez-Bailon M, et al. Chronic obstructive pulmonary disease predicts higher incidence and in hospital mortality for atrial fibrillation. An observational study using hospital discharge data in Spain (2004-2013). Int J Cardiol 2017;236:209–215.
- Xiao X, et al. Prevalence of atrial fibrillation in hospital encounters with end-stage COPD on home oxygen: national trends in the United States. Chest 2019;155:918–927.
- Hirayama A, et al. Acute exacerbation of chronic obstructive pulmonary disease and subsequent risk of emergency department visits and hospitalizations for atrial fibrillation. Circ Arrhythm Electrophysiol 2018;11:e006322.
- Desai R, et al. The burden and impact of arrhythmia in chronic obstructive pulmonary disease: insights from the National Inpatient Sample. Int J Cardiol 2019;281:49–55.
- Durheim MT, et al. Characteristics and outcomes of adults with chronic obstructive pulmonary disease and atrial fibrillation. Heart 2018;104:1850–1858.
- Movahed MR, et al. Diabetes mellitus is a strong, independent risk for atrial fibrillation and flutter in addition to other cardiovascular disease. Int J Cardiol 2005;105:315-318.
- Lee SR, et al. Evaluation of the association between diabetic retinopathy and the incidence of atrial fibrillation: a nationwide population-based study. Int J Cardiol 2016;223:953-957.
- Wang TJ, et al. Obesity and the risk of new-onset atrial fibrillation. JAMA 2004;292:2471-2477.
- Du X, et al. Risks of cardiovascular events and effects of routine blood pressure lowering among patients with type 2 diabetes and atrial fibrillation: results of the ADVANCE study. Eur Heart J 2009;30:1128 1135.
- Pallisgaard JL, et al. Risk of atrial fibrillation in diabetes mellitus: a nationwide cohort study. Eur J Prev Cardiol 2016;23:621-627.
- Rizzo MR, et al. Autonomic dysfunction is associated with brief episodes of atrial fibrillation in type 2 diabetes. J Diabetes Complications 2015;29:88-92.
- PhD LGMP. Association of Atrial Fibrillation with Diabetes Mellitus, High Risk Comorbidities. Maedica (Bucur). 2022 Mar;17(1):143-152.
- Fangel MV, et al. Type 1 versus type 2 diabetes and thromboembolic risk in patients with atrial fibrillation: a Danish nationwide cohort study. Int J Cardiol 2018;268:137-142
- Mozaffarian D, et al. American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Heart disease and stroke statistics 2015 update: a report from the American Heart Association. Circulation 2015;131:e29-322.
- Fatemi O, et al. Impact of intensive glycemic control on the incidence of atrial fibrillation and associated cardiovascular outcomes in patients with type 2 diabetes mellitus (from the Action to Control Cardiovascular Risk in Diabetes study). Am J Cardiol 2014;114:1217-1222.
- Donnellan E, et al. Association between pre-ablation glycemic control and outcomes among patients with diabetes undergoing atrial fibrillation ablation. JACC Clin Electrophysiol 2019;5:897-903.
- Chang SH, et al. Association of metformin with lower atrial fibrillation risk among patients with type 2 diabetes mellitus: a population-based dynamic cohort and in vitro studies. Cardiovasc Diabetol 2014;13:123.
- Bell DSH, et al. Atrial fibrillation and type 2 diabetes: prevalence, etiology, pathophysiology and effect of anti-diabetic therapies. Diabetes Obes Metab 2019;21:210 217.
- Javed S et al. Obesity and atrial fibrillation: making inroads through fat. Eur Heart J Cardiovasc Pharmacother 2021 Jan 16;7(1):59-67.
- Tedrow UB, et al. The long- and short-term impact of elevated body mass index on the risk of new atrial fibrillation the WHS (Women’s Health Study). J Am Coll Cardiol 2010;55:2319–2327.
- Echahidi N, et al. Obesity and metabolic syndrome are independent risk factors for atrial fibrillation after coronary artery bypass graft surgery. Circulation 2007;116:I213–I219.
- Wang TJ, et al. Obesity and the risk of new-onset atrial fibrillation. JAMA 2004;292:2471–2477.
- Morin DP, et al. The state of the art: atrial fibrillation epidemiology, prevention, and treatment. Mayo Clin Proc 2016;91:1778–1810.
- Huxley RR, et al. Absolute and attributable risks of atrial fibrillation in relation to optimal and borderline risk factors: the Atherosclerosis Risk in Communities (ARIC) study. Circulation 2011;123:1501–1508.
- Frost L, et al. Overweight and obesity as risk factors for atrial fibrillation or flutter: the Danish Diet, Cancer, and Health Study. Am J Med 2005;118:489–495.
- Tsang TS, et al. Obesity as a risk factor for the progression of paroxysmal to permanent atrial fibrillation: a longitudinal cohort study of 21 years. Eur Heart J 2008;29:2227–2233.
- Foy AJ, et al. Relation of obesity to new-onset atrial fibrillation and atrial flutter in adults. Am J Cardiol 2018;121:1072–1075.
- Karasoy D, et al. Obesity is a risk factor for atrial fibrillation among fertile young women: a nationwide cohort study. Europace 2013;15:781–786.
- Goudis CA, et al. Obstructive sleep and atrial fibrillation: pathophysiological mechanisms and therapeutic implications. Int J Cardiol 2017;230:293-300.
- Boriani G et al. Chronic kidney disease in patients with cardiac rhythm disturbances or implantable electrical devices: clinical significance and implications for decision making-a position paper of the European Heart Rhythm Association endorsed by the Heart Rhythm Society and the Asia Pacific Heart Rhythm Society. Europace (2015):17:1169–1196.
- Zimmerman D, et al. Systematic review and meta-analysis of incidence, prevalence and outcomes of atrial fibrillation in patients on dialysis. Nephrol Dial Transplant 2012;27:3816-3822.
- Wetmore JB, et al. The prevalence of and factors associated with chronic atrial fibrillation in Medicare/Medicaid-eligible dialysis patients. Kidney Int 2012;81:469–76.
- Ananthapanyasut W, et al. Prevalence of atrial fibrillation and its predictors in nondialysis patients with chronic kidney disease. Clin J Am Soc Nephrol 2010;5:173–81.
- Soliman EZ, et al. Chronic kidney disease and prevalent atrial fibrillation: the Chronic Renal Insufficiency Cohort (CRIC). Am Heart J 2010;159:1102–7.
- Baber U, et al. Association of chronic kidney disease with atrial fibrillation among adults in the United States: REasons for Geographic and Racial Differences in Stroke (REGARDS) Study. Circ Arrhythm Electrophysiol 2011;4:26–32.
- Olesen JB, Lip GY, Kamper AL, Hommel K, Kober L, Lane DA et al. Stroke and bleeding in atrial fibrillation with chronic kidney disease. N Engl J Med 2012;367:625–35.
- Potpara TS, et al. Use of oral anticoagulants in patients with atrial fibrillation and renal dysfunction. Nat Rev Nephrol 2018;14:337-351.
- Albertsen IE, et al. Risk of stroke or systemic embolism in atrial fibrillation patients treated with warfarin: a systematic review and meta-analysis. Stroke 2013;44:1329-1336.
- Olesen JB, et al. Stroke and bleeding in atrial fibrillation with chronic kidney disease. N Engl J Med 2012;367:625-635.
- Fauchier L, et al. Changes in glomerular filtration rate and outcomes in patients with atrial fibrillation. Am Heart J 2018;198:39-45.
- Szekely P. Systemic embolism and anticoagulant prophylaxis in rheumatic heart disease. Br Med J 1964;1:1209-1212.
- Philippart R, et al. Oral anticoagulation, stroke and thromboembolism in patients with atrial fibrillation and valve bioprosthesis. The Loire Valley Atrial Fibrillation Project. Thromb Haemost 2016;115:1056-1063.
- Fauchier L, et al. Should atrial fibrillation patients with only 1 nongender-related CHA2DS2-VASc risk factor be anticoagulated?Stroke 2016;47:1831-1836.
- Chao TF, et al. Acute myocardial infarction in patients with atrial fibrillation with a CHA2DS2-VASc score of 0 or 1: a nationwide cohort study. Heart Rhythm 2014;11:1941-1947.
- Soliman EZ, et al. Atrial fibrillation and the risk of myocardial infarction. JAMA Intern Med 2014;174:107-114.
- January CT, et al. 2014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation: executive summary: a report of the American College of Cardiology/American Heart Association Task Force on practice guidelines and the Heart Rhythm Society. Circulation. 2014;130:2071–2104.
- NICE, Hypertension: Clinical Management of Primary Hypertension in Adults, 2011 CG127. http://wwwniceorguk/ guidance/CG127 (Assessed 18 Aug. 2015).
- Hobbs FD, et al. A randomized controlled trial and cost effectiveness study of systematic screening (targeted and total population screening) versus routine practice for the detection of atrial fibrillation in people aged 65 and over. The SAFE study, Health Technol. Assess. 9 (iii-iv, ix-x) (2005) 1-74.
- Jones C, et al. Guideline Development Group. The management of atrial fibrillation: summary of updated NICE guidance. BMJ. 2014;348:g3655. doi: 10.1136/bmj.g3655
- Svennberg E, et al. How to use digital devices to detect and manage arrhythmias: an EHRA practical guide. EP Europace, 2022;6: 979–1005.
- Bumgarner JM, et al. Smartwatch algorithm for automated detection of atrial fibrillation. J Am Coll Cardiol 2018;71:2381-2388.
- Wasserlauf J, et al. Smartwatch performance for the detection and quantification of atrial fibrillation. Circ Arrhythm Electrophysiol 2019;12:e006834.
- Attia ZI, et al. Anartificial intelligence-enabled ECG algorithm for the identification of patients with atrial fibrillation during sinus rhythm: a retrospective analysis of outcome prediction. Lancet 2019;394:861-867.
- Lowres N, et al. Feasibility and cost-effectiveness of stroke prevention through community screening for atrial fibrillation using iPhone ECG in pharmacies. The SEARCH-AF study. Thromb Haemost 2014;111:1167–1176.
- Orchard J, et al. eHealth tools to provide structured assistance for atrial fibrillation screening, management, and guideline-recommended therapy in metropolitan general practice: the AF—SMART study. J Am Heart Assoc 2019;8: e010959.
- Godin R, et al. Screening for atrial fibrillation using a mobile, single-lead electrocardiogram in Canadian Primary Care Clinics. Can J Cardiol 2019;35:840–845
- Unger T, et al. 2020 International Society of Hypertension Global Hypertension Practice Guidelines. Hypertension. 2020;75:1334-1357.
- Verberk WJ, et al. Screening for atrial fibrillation with automated blood pressure measurement: Research evidence and practice recommendations. Int J Cardiol 2016; 203:465–473.
- Myers MG, et al. Should oscillometric blood pressure monitors be used in patients with atrial fibrillation? J Clin Hypertens (Greenwich) 2015;17: 565–566.
- Verberk WJ, et al. Accuracy of oscillometric blood pressure monitors for the detection of atrial fibrillation: a systematic review. Exp Rev Med Devices 2012;9:635–640.
- Balanis T, et al. Detection of Atrial Fibrillation Using a Home Blood Pressure Monitor. Vascular Health and Risk Management 2021:17 407–414
- Al Awwa I, et al. Accuracy and feasibility of portable blood pressure monitoring in the detection of atrial fibrillation in hemodialysis patients. Rev. Cardiovasc. Med. 2021 vol. 22(1), 225-229.
- Marazzi G, et al. Comparison of Microlife BP A200 Plus and Omron M6 Blood Pressure Monitors to Detect Atrial Fibrillation in Hypertensive Patients. Adv Ther (2012) 29(1):64-70.
- Parati G, et al. Home blood pressure telemonitoring improves hypertension control in general practice. The TeleBPCare study. J Hypertens 2009;27(1):198-203.
- Ball J, et al. (2013) Atrial fibrillation: profile and burden of an evolving epidemic in the 21st century. Int J Cardiol 2013;167(5):1807-1824.
- Stewart S, et al. Cost of an emerging epidemic: an economic analysis of atrial fibrillation in the UK. Heart 2004;90(3):286-292.
- Zoni-Berisso M, et al. Epidemiology of atrial fibrillation: European perspective. Clin Epidemiol 2014;6:213-220.
- Patel S, et al. Cost-effectiveness of targeted screening for non-valvular atrial fibrillation in the United Kingdom in older patients using digital approaches. J Med Econ. 2023 Jan-Dec;26(1):326-334.
La fibrillazione atriale è l’aritmia sostenuta di più ampio riscontro nella pratica clinica. Nei prossimi decenni il numero di pazienti affetti da fibrillazione atriale è destinato a raddoppiare a causa del progressivo invecchiamento della popolazione generale, in particolare nei paesi occidentali, con conseguente espansione di quelle fasce di età tra le quali fibrillazione atriale è più frequente (Figura 1) (1). La frequenza di questa aritmia oscilla tra l’1% e il 2% nella popolazione generale ma la sua prevalenza cresce da meno dello 0.5% nei soggetti con meno di 50 anni al 3-4% nei soggetti tra 60 e 70 anni fino a raggiungere tra gli ultraottantenni una frequenza stimata nelle diverse casistiche tra il 5% ed il 15% (2-6). La notevole rilevanza epidemiologica della fibrillazione atriale si associa ad una altrettanto importante rilevanza clinica in ragione della elevata quota di mortalità e morbilità legata a questa artimia con le conseguenti ricadute sulla salute del singolo paziente e della collettività e sugli aspetti socio-economici (1). Peraltro, l’estrinsecazione clinica della fibrillazione atriale non di rado è piuttosto modesta o del tutto assente a fronte di un impatto prognostico quoad vitam e quoad valetudinem decisamente rilevante (Figura 2) (1). È importante sottolineare come la fibrillazione atriale clinicamente manifesta rappresenti solo la punta dell’iceberg di un sommerso di patologia che espone chi ne è affetto ad un rischio di eventi particolarmente elevato.
SCREENING DELLA FA
La paucisintomaticità della fibrillazione atriale ed il primo riscontro di questa aritmia in circa il 10% di tutti gli ictus ischemici, suggerisce fortemente l’opportunità di ricercarla nei soggetti a rischio, anche in assenza di sintomi, in modo da avere l’opportunità di impostare il più precocemente possibile le strategie terapeutiche/preventive più opportune. I vantaggi dello screening della fibrillazione atriale sono molteplici e comprendono: la prevenzione dell’ictus su base cardio-embolica e dell’evoluzione sintomatica dell’aritmia; la prevenzione o la regressione dei fenomeni di rimodellamento elettrico e fibroso dell’atrio; la prevenzione delle conseguenze emodinamiche legate alla irregolarità del ritmo cardiaco e dell’insorgenza di cardiomiopatia indotta dalle elevate frequenze atriale e ventricolare (1) (Figura 3). La gestione precoce delle comorbidità che frequentemente si associano alla fibrillazione atriale, la cui individuazione può essere agevolata dallo stesso riscontro precoce di questa aritmia, rappresenta un ulteriore vantaggio che può derivare dal suo screening. La possibilità di prevenire, o quantomeno ridurre, la considerevole quota di morbilità, mortalità ed ospedalizzazioni legate alla fibrillazione atriale rappresenta, ovviamente, la principale ragione per una ricerca attenta di questa aritmia, almeno nei pazienti a rischio più elevato di presentare fibrillazione atriale. La possibilità che dallo screening della fibrillazione atriale possa derivare un certo grado di ansia per il paziente rappresenta un possibile svantaggio mentre non sembra concreta la possibilità, suggerita da taluni, che da una non corretta diagnosi di fibrillazione atriale possano derivare trattamenti e/o procedure non scevri di pericoli per il paziente (1). Gli elevati costi assistenziali legati alla fibrillazione atriale misconosciuta certamente rappresentano un ulteriore elemento da considerare nella programmazione di strategie di screening (7). Lo screening opportunistico della fibrillazione atriale sembra associarsi a costi minori rispetto allo screening sistematico (8), ma la valutazione corretta del bilancio costo-benefici risente inevitabilmente del tipo di approccio seguito e del contesto clinico in cui viene condotto (9). Nei pazienti a rischio elevato, infatti, lo screening della fibrillazione sembra poter garantire innegabili vantaggi anche in ragione del profilo di rischio cardiovascolare globale elevato che nella generalità dei casi caratterizza questi pazienti. A tale riguardo, l’età rappresenta un fattore di rischio assai importante per l’insorgenza di fibrillazione ma non meno rilevante appare il contributo di fattori di rischio potenzialmente modificabili quali l’ipertensione arteriosa, il diabete mellito, lo scompenso cardiaco, la malattia renale cronica, l’obesità, la broncopneumpatia cronica ostruttiva e la sindrome delle apnee ostruttive (1) (Figura 4).
Il soggetto anziano
L’impatto clinico della fibrillazione atriale è particolarmente rilevante nell’anziano. Il rischio di ictus ischemico nella popolazione con fibrillazione atriale, infatti, è 5 volte maggiore rispetto alla popolazione generale con una diretta responsabilità di questa aritmia su circa il 20% di tutti gli eventi ischemici cerebrali sintomatici, percentuale che nei pazienti anziani ultraottantenni sale al 25-30% (10,11). La particolare suscettibilità dell’anziano a sviluppare fibrillazione atriale è in parte da ricondurre ai fenomeni di rimodellamento elettrico e anatomico a carico dell’atrio sinistro legati anche alle modificazioni fisiologiche o “parafisiologiche” del miocardio atriale dovute alla senescenza. Infatti, dal punto di vista anatomico, nel paziente anziano si osserva una progressiva e costante deposizione di tessuto amiloide nell’atrio, con conseguente perdita di elasticità e contrattilità del miocardio e dilatazione della cavità cardiaca (12). Dal punto di vista elettrico si verifica un diffuso rallentamento nella conduzione del potenziale elettrico e un aumento dei periodi refrattari dell’atrio associato ad una riduzione della frequenza di scarica del nodo del seno (13). Questi fenomeni involutivi, ovviamente, non sono sempre sufficienti ad innescare una fibrillazione atriale che, se così fosse, dovrebbe interessare tutti gli anziani. Invero, le succitate modificazioni del miocardio rappresentano per lo più condizioni predisponenti che vengono amplificate nelle loro potenzialità aritmogeniche dalla cronica esposizione nel corso della vita ai diversi fattori di rischio cardiovascolare quali l’ipertensione arteriosa o il diabete mellito. Quanto sopra esposto sottolinea l’importanza di uno screening accurato della fibrillazione atriale in questa popolazione, peraltro in progressiva espansione, in ragione della sua elevata prevalenza e dell’enorme impatto prognostico degli eventi embolici ad essa correlati sia sull’ aspettativa che sulla qualità di vita. A tale riguardo, non appare inutile sottolineare come la fibrillazione atriale rappresenti un importante determinante fisiopatologico dello sviluppo di demenza, problematica di cui sono ben note le enormi ripercussioni cliniche e socioeconomiche (1). Un intervento precoce che porti al ripristino ed al mantenimento di un ritmo sinusale o, laddove ciò non fosse possibile, che consenta di impostare precocemente una terapia anticoagulante è di rilevanza strategica per prevenire la comparsa e la progressione del declino cognitivo in questi pazienti. Opportunamente le Linee Guida della European Society of Cardiology (ESC) per la fibrillazione atriale raccomandano lo screening opportunistico della fibrillazione atriale negli ultrassessantacinquenni (classe della raccomandazione I, livello di evidenza B) e lo screening sistematico negli ultrasettantacinquenni (classe della raccomandazione IIa, livello di evidenza B) (1).
Il paziente iperteso
L’ipertensione arteriosa è il più comune fattore di rischio modificabile per l’insorgenza di fibrillazione atriale in ragione della sua elevata prevalenza nella popolazione e del suo importante ruolo fisiopatologico nella genesi delle alterazioni strutturali a livello cardiaco che tipicamente favoriscono l’insorgenza di fibrillazione atriale, quali l’ipertrofia ventricolare sinistra, la dilatazione ed il rimodellamento strutturale della parete atriale (14). Il rischio di sviluppare fibrillazione atriale nel paziente iperteso è aumentato di circa il 70% rispetto ai soggetti normotesi (15,16). È interessante notare come il rischio di sviluppare fibrillazione atriale sia aumentato anche nei pazienti con pressione normale-alta (17,18). L’ipertensione arteriosa, inoltre, incrementa il rischio di complicanze nei pazienti con fibrillazione atriale, soprattutto ictus, scompenso cardiaco ed eventi emorragici, ragione per cui i pazienti con fibrillazione atriale che presentino una storia di ipertensione, soprattutto se di lunga durata e non adeguatamente controllata, devono essere considerati a rischio elevato. Invero, la fibrillazione atriale rappresenta una sorta di mini-epidemia nell’ambito dell’ampia popolazione degli anziani ipertesi. Peraltro, l’ictus ischemico dovuto alla fibrillazione atriale è spesso devastante negli ipertesi, soprattutto se anziani, con un enorme impatto prognostico, sia quoad valetudinem che quoad vitam, e ricadute socio-economiche di vaste proporzioni (2-6).
La presenza di fibrillazione atriale, peraltro, può creare qualche criticità nella rilevazione della pressione arteriosa in ragione delle variazioni del tempo di riempimento ventricolare, della contrattilità ventricolare e dello stroke volume con conseguente incremento della variabilità battito-battito (19). Per tale motivo è fondamentale che vengano utilizzati dispositivi che hanno ricevuto le adeguate validazioni. A tale riguardo, le linee guida europee 2023 per l’ipertensione arteriosa considerano la possibilità di utilizzare dispositivi automatici oscillometrici per misurare la pressione arteriosa nei pazienti con fibrillazione atriale, anche in ragione della possibilità di utilizzare questi strumenti in ambito domiciliare (19). La notevole rilevanza dell’ipertensione arteriosa quale fattore precipitante per la fibrillazione atriale, aritmia che dovrebbe essere considerata una delle manifestazioni di danno d’organo da ipertensione, impone la necessità nel paziente iperteso con fibrillazione atriale di ottenere un controllo ottimale della pressione che miri a raggiungere un target <130/80 mmHg per ridurre il rischio di outcome sfavorevoli (19). Le Linee Guida ESC per la fibrillazione atriale raccomandano lo screening opportunistico di questa aritmia atriale nei pazienti ipertesi (classe della raccomandazione I, livello di evidenza B) (1). Questo screening, quantomai opportuno, è reso più agevole dalla disponibilità di moderni dispositivi per l’automisurazione domiciliare della pressione arteriosa, provvisti di algoritmi validati per individuare alterazioni del ritmo, suggestive della presenza di fibrillazione atriale; inoltre, sono disponibili anche dispositivi di piccole dimensioni che consentono una registrazione elettrocardiografica al proprio domicilio, della durata raccomandata dalle linee guida, per porre diagnosi di fibrillazione atriale (1).
Il paziente con broncopneumopatia cronica ostruttiva
La prevalenza globale della broncopneumopatia cronica ostruttiva (BPCO) è di circa l’11% nella popolazione generale (20). Questa percentuale aumenta considerevolmente nei pazienti con fibrillazione atriale raggiungendo una prevalenza del 23% nei soggetti ultrasessantacinquenni (20-22). La prevalenza della fibrillazione atriale nei pazienti con BPCO stabile oscilla tra il 4.7% e il 15% nelle diverse casistiche con percentuali significativamente maggiori, pari a circa il 20-30%, nelle forme più severe di BPCO (23-26). Le ragioni di questa associazione tra BPCO e fibrillazione atriale vanno ricercate principalmente nella condivisione dei fattori di rischio. La BPCO, inoltre, può direttamente contribuire alla comparsa di fibrillazione atriale attraverso diversi meccanismi fisiopatologici (Figura 5) (26). Le alterazioni degli scambi gassosi, con conseguente ipossia e ipercapnia, determinano una vasocostrizione del circolo polmonare con conseguente comparsa di ipertensione polmonare che, a sua volta, favorisce la comparsa di ipertrofia ventricolare destra e disfunzione diastolica (27). L’ipossia cronica, inoltre, promuove un aumento della flogosi cronica sistemica e dello stress ossidativo che a loro volta facilitano il rimodellamento fibroso a livello atriale (28). Nel tempo la BPCO favorisce la comparsa e la progressione di insufficienza cardiaca destra (29). La presenza di condizioni cliniche concomitanti, quali l’obesità e l’ipertensione arteriosa, contribuisce in misura non trascurabile ai fenomeni di rimodellamento strutturale a livello atriale, di frequente riscontro nella BPCO. La malattia cardiovascolare rappresenta una della comorbidità più rilevanti nel paziente con BPCO. Circa il 30% dei pazienti con scompenso cardiaco presentano una storia di BPCO (30). La sindrome delle apnee ostruttive è anch’essa piuttosto frequente nei pazienti con BPCO e contribuisce in modo rilevante alla genesi di fibrillazione atriale (26). Lo sviluppo di fibrillazione atriale ed i suoi parossismi spesso si associano temporalmente alle riacutizzazioni di BPCO, favoriti nella loro insorgenza dalle alterazioni emogasanalitiche che, inducendo un aumento della pressione polmonare, possono indurre rigurgito tricuspidale che influenza la dinamica atriale. L’esacerbazione delle alterazioni emogasanalitiche legate alle riacutizzazioni di BPCO contribuisce, inoltre, all’instabilità elettrica dell’atrio destro (31). L’aumento della pressione intratoracica durante le riacutizzazioni a maggiore impronta ostruttiva rappresenta un ulteriore fattore che può favorire la comparsa di fibrillazione atriale. Da ultimo, i farmaci simpaticomimetici e parasimpaticolitici, di comune utilizzo nella gestione della BPCO, potrebbero, almeno in linea teorica, contribuire in varie misure all’insorgenza di fibrillazione atriale (32). Invero, il trattamento con agenti broncodilatatori a breve durata di azione non è associato ad alcun incremento significativo di aritmie in pazienti ospedalizzati per esacerbazioni di BPCO (33). La coesistenza di BPCO e fibrillazione atriale ha ricadute cliniche assai rilevanti. La presenza di BPCO, infatti, è associata ad una maggiore probabilità di progressione della fibrillazione atriale dalla forma parossistica alla forma persistente e ad una minore risposta al trattamento (34,35). Nei pazienti con BPCO, infatti, si osserva una riduzione dell’efficacia nel lungo termine delle procedure di cardioversione della fibrillazione atriale (34,36). Nei pazienti sottoposti ad ablazione della fibrillazione atriale, inoltre, la presenza di BPCO si associa ad una prognosi meno favorevole nel breve termine con un aumentato rischio di ospedalizzazioni, ictus e mortalità per tutte le cause (35,37-39). Nei pazienti con BPCO si osserva anche una maggiore difficoltà nel controllo della risposta ventricolare, in parte riconducibile all’uso non adeguatamente frequente di beta bloccanti in questi pazienti, per il timore, invero piuttosto inconsistente, per i beta bloccanti beta-1 selettivi, di un peggioramento della funzione respiratoria (40). La presenza di BPCO si associa ad un aumentato rischio di ospedalizzazione e di mortalità per tutte le cause nel paziente con fibrillazione atriale (44,41). Analogamente, la comparsa di riacutizzazioni di BPCO nei pazienti con fibrillazione atriale si associa ad un aumentato rischio di ospedalizzazione legata alla fibrillazione atriale nei primi 90 giorni successivi alla riacutizzazione (42,43). Circa il 30% dei pazienti ospedalizzati per BPCO presenta turbe del ritmo cardiaco che in oltre un quinto dei casi sono rappresentate dalla fibrillazione atriale (44). Da ultimo, nei pazienti con fibrillazione atriale la BPCO è tipicamente associata con una sintomatologia più eclatante, una peggiore qualità di vita e maggiore suscettibilità a sviluppare eventi cardiovascolari (45). Quanto sopra esposto suggerisce da un lato l’opportunità di una attenta valutazione della possibile presenza di fibrillazione atriale nel paziente con BPCO e dall’altro la necessità di una ottimizzazione della gestione della BPCO al fine di minimizzare il rischio di riacutizzazione il cui impatto fisiopatologico e clinico nel paziente con fibrillazione atriale è decisamente rilevante.
Il paziente con diabete mellito
Il diabete mellito è frequentemente associato a fibrillazione atriale. La prevalenza di questa aritmia è circa 2 volte maggiore nei pazienti diabetici rispetto ai soggetti non diabetici (46) e la sua incidenza aumenta progressivamente con la severità delle complicanze microvascolari del diabete (retinopatia e malattia renale) (47). Questa stretta associazione tra fibrillazione atriale e diabete mellito trova il suo substrato fisiopatologico nella frequente condivisione di alcuni determinanti di rischio, quali l’ipertensione e l’obesità (48,49) e nel ruolo predisponente del dismetabolismo glucidico sull’insorgenza di fibrillazione atriale, soprattutto nei soggetti giovani (50), favorita nella sua comparsa dalla presenza di disautonomia legata alla malattia diabetica (51). L’iperglicemia cronica, inoltre, rappresenta un importante modulatore dei fenomeni di rimodellamento atriale (52). Gli elevati livelli glicemici e le fluttuazioni della glicemia sono associate a fibrosi atriale, stress ossidativo e aumentata suscettibilità allo sviluppo di fibrillazione atriale (52). La stimolazione del sistema renina-angiotensina-aldosterone e l’induzione dell’espressione di fattori di crescita da parte dell’iperglicemia rappresentano ulteriori modulatori della sintesi di collagene con conseguente sviluppo di rimodellamento fibrotico a livello atriale (52). Da ultimo, l’iperglicemia induce la formazione di prodotti di glicazione avanzata (AGE) che, interagendo con gli specifici recettori (RAGE), favoriscono lo sviluppo di fibrosi atriale (52). La stretta associazione tra fibrillazione atriale e diabete mellito ha un impatto clinico assai rilevante. Il diabete mellito sia di tipo 1 che di tipo 2 aumenta considerevolmente il rischio di stroke, ulteriormente incrementato dalla presenza di fibrillazione atriale (53,54). La comparsa di fibrillazione atriale nel paziente diabetico non sembra venire significativamente influenzata dal controllo glicemico intensivo (55) che, tuttavia, parrebbe efficace nel prevenire le ricorrenze di fibrillazione atriale dopo terapia ablativa (56). Alcune evidenze suggeriscono la possibilità che il trattamento con metformina e pioglitazone si associ ad un ridotto rischio di insorgenza di fibrillazione atriale (57), evidenze non confermate per il rosiglitazone (47). Attualmente non sono ancora disponibili evidenze adeguatamente robuste che siano suggestive di un possibile effetto protettivo nei confronti della comparsa di fibrillazione atriale nel paziente diabetico da parte degli agonisti di glucagon-like peptide-1 (GLP-1), degli inibitori del sodium glucose cotransporter-2 (SGLT2-I) e degli inibitori di dipeptidyl peptidase-4 (DPP-4) (58). La rilevanza epidemiologica e prognostica della associazione tra fibrillazione atriale e diabete mellito suggerisce l’opportunità di uno screening attento della fibrillazione atriale anche nei pazienti con dismetabolismo glucidico.
Il paziente con eccedenza ponderale
Nel corso degli ultimi anni un numero crescente di evidenze suggeriscono un ruolo indipendente dell’obesità per lo sviluppo di fibrillazione atriale (59). I dati delle coorti di Framingham e del Women’s Health Study, ad esempio, dimostrano una stretta relazione tra incremento del peso corporeo e rischio di sviluppare fibrillazione atriale (60,61,62). Nello studio Atherosclerosis Risk in Communities (ARIC) circa un quinto dei nuovi casi di fibrillazione atriale è risultato riconducibile alla presenza di un indice di massa corporea >25 kg/m2 (63,64), dati che portano ad identificare nell’eccedenza ponderale il più importante fattore di rischio modificabile per fibrillazione atriale dopo l’ipertensione arteriosa. A tale riguardo, è interessante notare come lo sviluppo in tempi brevi di eccedenza ponderale comporti un significativo incremento del rischio di fibrillazione atriale laddove la riduzione dell’eccedenza ponderale si associa ad una significativa riduzione del rischio di fibrillazione atriale (60). La relazione tra obesità e fibrillazione atriale è indipendente dalla presenza di fattori che tipicamente ad essa si associano, quali il diabete e l’ipertensione arteriosa, come pure dalla presenza di sindrome delle apnee ostruttive, condizione di frequente riscontro nel paziente obeso (65-68). Queste evidenze suggeriscono un ruolo fisiopatologico diretto dell’obesità nella genesi della fibrillazione atriale (Figura 6) (59). A tale riguardo, le alterazioni emodinamiche che accompagnano l’obesità possono contribuire in misura rilevante all’insorgenza di fibrillazione atriale. Il paziente obeso presenta spesso un aumento della volemia che si traduce in un sovraccarico funzionale a livello cardiaco con conseguenti fenomeni di rimodellamento ventricolare che nel lungo termine possono indurre ripercussioni sull’emodinamica atriale e sulla sua architettura strutturale con fibrosi e dilatazione atriale (59). L’obesità, inoltre, si accompagna ad alterazione neuro-ormonali ed endocrino-metaboliche che possono contribuire all’insorgenza della fibrillazione atriale, quali l’attivazione del sistema renina-angiotensina-aldosterone, l’insulino-resistenza e la disfunzione autonomica. L’accumulo di grasso a livello epicardico rappresenta un ulteriore determinante fisiopatologico della fibrillazione atriale nel paziente con eccedenza ponderale in ragione della sua capacità di indurre fibrosi atriale attraverso una azione paracrina delle adipocitochine, l’infiltrazione nel tessuto miocardico e il rimodellamento fibroso del tessuto adiposo nell’epicardio atriale conseguente all’infiammazione. Peraltro, alcune evidenze sperimentali suggeriscono che gli adipociti possano modulare l’elettrofisiologia dei miociti atriale (59). La presenza di apnee ostruttive, molto frequente nel paziente obeso, contribuisce ad aumentare il rischio di fibrillazione atriale attraverso molteplici meccanismi fisiopatologici che includono l’aumento dello stress ossidativo, dell’infiammazione e dell’attivazione neuro-ormonale, i fenomeni ricorrenti di ipossiemia/ipercapnia notturne, le alterazioni dell’equilibrio simpato-vagale e le variazioni della pressione intratoracica (59,69).
Il paziente con malattia renale
L’associazione tra malattia renale cronica e fibrillazione atriale è particolarmente rilevante sia dal punto di vista epidemiologico che per ciò che attiene le reciproche influenze fisiopatologiche, gestionali e prognostiche, di queste due condizioni cliniche (1,70). Il 15-20% dei pazienti con malattia renale hanno fibrillazione atriale la cui presenza si associa ad un aumento della mortalità (71). Un variabile grado di compromissione della funzione renale si osserva nel 40-50% dei pazienti con fibrillazione. Nei pazienti in dialisi la prevalenza della fibrillazione atriale oscilla nelle diverse casistiche tra il 7 ed il 27% ed incrementa con l’età, anche se il rischio relativo appare più alto nei giovani (72). Una prevalenza simile si osserva nell’insufficienza renale in fase pre-dialitica (73-76). Indipendentemente dalla presenza di fibrillazione atriale, la malattia renale cronica rappresenta una condizione protrombotica e proemorragica (Figura 7) (77-79), mentre la fibrillazione atriale può accelerare la progressione della malattia renale. Peraltro, la progressione del danno renale rappresenta un predittore di stroke ischemico, embolizzazione sistemica e complicanze emorragiche più importante della insufficienza renale per sè (80). L’attenzione del clinico nei riguardi della associazione tra malattia renale cronica e fibrillazione atriale è ulteriormente stimolata dalla necessità di considerare il parametro “funzione renale” nella modulazione della terapia anticoagulante (1). Ciononostante, appare opportuno che venga rivolta una attenzione sempre maggiore alla precoce identificazione della fibrillazione atriale nel paziente nefropatico per le importanti ricadute cliniche che la sua comparsa può determinare.
Il paziente con malattia cardiovascolare
L’attenzione del clinico nei riguardi della fibrillazione atriale nel paziente con malattia cardiovascolare è sempre elevata in ragione della sua elevata prevalenza in questa tipologia di pazienti e della reciproca influenza prognostica di queste condizioni cliniche. Scompenso cardiaco e fibrillazione atriale spesso coesistono e si influenzano reciprocamente dal punto di vista prognostico (1). Lo scompenso cardiaco, inoltre, è un importante determinante del rischio cardioembolico nel paziente con fibrillazione atriale. Nel paziente con sindrome coronarica acuta l’incidenza di fibrillazione atriale oscilla tra il 2 e il 23% (81) con un rischio di fibrillazione atriale di nuova insorgenza aumentato del 60-77% nei pazienti con infarto miocardico (82). Viceversa, la presenza di fibrillazione atriale si associa ad un aumentato rischio di infarto miocardico con sopraelevazione del tratto ST (STEMI) e di sindrome coronarica acuta non-STEMI (83-85). Nonostante la sensibilità del clinico nel controllare il ritmo cardiaco del paziente con malattia cardiovascolare, una particolare attenzione alla identificazione precoce di questa aritmia è comunque sempre raccomandata in ragione della sua elevata prevalenza e del suo elevato impatto prognostico in questi pazienti.
TECNICHE DI SCREENING DELLA FIBRILLAZIONE ATRIALE
Le linee guida raccomandano lo screening opportunistico della fibrillazione atriale nelle popolazioni a rischio più elevato, quali i pazienti ipertesi o con sindrome delle apnee ostruttive e gli ultrasessantacinquenni (1,5,86). Le linee guida, inoltre, suggeriscono lo screening sistematico della fibrillazione atriale mediante elettrocardiogramma nei soggetti ultrasettantaciquenni ed in quelli ad elevato rischio di ictus (1). Lo screening opportunistico della fibrillazione atriale attraverso la palpazione del polso rappresenta l’approccio più seguito (87), ma la sua accuratezza diagnostica è piuttosto modesta, con una sensibilità dell’87% ed una specificità dell’81% (88). Invero, la fibrillazione atriale ha spesso carattere parossistico e, conseguentemente, può sfuggire alla singola rilevazione. Non di rado l’ictus embolico rappresenta l’evento con cui viene diagnosticata una fibrillazione atriale fino ad allora misconosciuta in ragione della sua sintomatologia modesta, se non del tutto assente. Per questo motivo le linee guida supportano l’uso di tecniche di monitoraggio per lo screening della fibrillazione atriale nei soggetti a rischio (1,5,86,89). In quest’ottica, oltre alla registrazione elettrocardiografica tradizionale, sono disponibili diversi sistemi per lo screening della fibrillazione atriale, alcuni dei quali con significative evidenze di validità, in termini di specificità e sensibilità, rispetto al gold standard diagnostico rappresentato ancora oggi dall’elettrocardiogramma a 12 derivazioni (Figura 8) (1). Sulla scorta di queste crescenti evidenze, le Linee Guida ESC per la fibrillazione atriale, nel sottolineare come per la diagnosi certa di fibrillazione atriale sia sempre necessaria la conferma elettrocardiografica, considerano la possibilità di utilizzare, oltre la classica registrazione elettrocardiografica a 12 derivazioni, anche una registrazione elettrocardiografica a singola derivazione con un tracciato di almeno 30 secondi (1). Invero, anche dalla registrazione di una singola derivazione possono essere derivate tutte le informazioni necessarie per individuare la presenza di fibrillazione atriale. In questo nuovo scenario tecnologico la European Heart Rhythm Association (EHRA), ha elaborato nel 2022 un Position Paper dal titolo “How to use digital devices to detect and manage arrhythmias: an EHRA practical guide” per fare il punto delle evidenze scientifiche a supporto sulle nuove tecnologie proponendo un diagramma di flusso che integra l’utilizzo delle varie tecnologie per lo screening della fibrillazione atriale, con snodi decisionali basati principalmente sull’età dei paziente e sulla sua storia clinica (Figura 9) (90). Questo documento dell’EHRA apre le porte all’uso sempre più diffuso dei moderni dispositivi che il progresso tecnologico degli ultimi anni ha reso disponibili. Il loro uso clinico, ovviamente, non può prescindere dalla rispondenza di questi dispositivi agli ovvi requisiti di validazione. Alcuni studi hanno valutato la possibilità di porre il sospetto di fibrillazione atriale utilizzando uno smartwatch, producendo evidenze di indubbio interesse, sia pur meritevoli di adeguate conferme (91,92). Non meno incoraggianti appaiono le prospettive di uno screening efficace della fibrillazione atriale ricorrendo all’intelligenza artificiale che potrebbe consentire di identificare individui con un precedente episodio di fibrillazione atriale esaminandone una registrazione elettrocardiografica in ritmo sinusale (93).
A fronte di un futuro prossimo tecnologico indubbiamente incoraggiante, esiste un presente certamente non meno interessante rappresentato dalla attuale possibilità di identificare l’enorme sommerso di fibrillazione ricorrendo ai già citati dispositivi che consentono di ottenere una registrazione di 1 o 6 derivazioni elettrocardiografiche della durata di 30 secondi, adeguata, secondo quanto indicato dalle linee guida, per lo screening della fibrillazione atriale (1). Questi dispositivi, di dimensioni contenute, comodamente riponibili in una tasca, interfacciandosi con una App dedicata, consentono di registrare addirittura 1 o 6 derivazioni elettrocardiografiche al proprio domicilio. Invero, non sono molti i dispositivi che hanno ricevuto adeguate validazioni da consentirne l’approvazione da parte di enti regolatori quali la Food and Drug Administration (FDA) (1). Tra questi, il dispositivo KardiaMobile rappresenta un esempio di connubio assai ben riuscito tra i requisiti, entrambi fondamentali, di accuratezza diagnostica e semplicità d’uso. Meritevoli di menzione, a tale riguardo, i risultati dello studio SEARCH-AF, condotto in una popolazione di 1000 ultrasessantacinquenni (età media 76 anni) utenti di farmacie, che hanno dimostrato una sensibilità nella identificazione della fibrillazione atriale del 98.5% (intervallo di confidenza, 92–100%) ed una specificità del 91.4% (intervallo di confidenza, 89–93%) (94). L’uso di questo dispositivo ha consentito di individuare una fibrillazione atriale misconosciuta nell’1.5% dei soggetti sottoposti a screening. Risultati analoghi sono stati ottenuti nello studio AF-SMART, condotto in una popolazione di 1805 individui ultrasessantacinquenni seguiti in un contesto di primary care, nel corso del quale l’uso di KardiaMobile ha consentito di individuare una fibrillazione atriale misconosciuta nell’1.1% dei soggetti sottoposti a screening (95). In un ulteriore studio, che ha coinvolto 184 medici di medicina generale canadesi chiamati ad effettuare uno screening della fibrillazione atriale nei loro pazienti ultrasessantacinquenni in un arco temporale di 3 mesi, l’uso di questo dispositivo ha consentito di identificare 471 casi di fibrillazione atriale misconosciuta su un totale di 7885 pazienti sottoposti a screening (96). La prevalenza del 6.2%, decisamente elevata, esprime probabilmente una particolare attenzione dei medici coinvolti nel ricercare la fibrillazione atriale nei loro pazienti a più alto rischio. La semplicità d’uso rappresenta indubitabilmente un valore aggiunto per ogni dispositivo che debba poter essere utilizzato prevalentemente in ambito domiciliare. A tale riguardo, il dispositivo KardiaMobile si interfaccia direttamente con una App dedicata scaricata sul proprio smartphone. Basta appoggiare i polpastrelli di una o due dita di ciascuna mano sui due elettrodi posti sulla parte superiore del dispositivo per avviare la registrazione di una traccia elettrocardiografica che si completa dopo 30 secondi. Esiste anche la possibilità, limitatamente a KardiaMobile 6L, di registrare 6 derivazioni appoggiando la parte inferiore del dispositivo sulla coscia sinistra, in prossimità del ginocchio, o sulla caviglia della stessa gamba, mentre si tengono i polpastrelli sui 2 elettrodi superiori. Non meno importante è l’utilizzo di dispositivi per la misurazione della pressione arteriosa dotati di un algoritmo validato per individuare la possibile presenza di fibrillazione atriale. Considerata la frequenza e la rilevanza clinica dell’associazione tra ipertensione arteriosa e fibrillazione atriale, appare immediatamente evidente l’utilità di questi dispositivi per la misurazione domiciliare della pressione arteriosa, anche in considerazione del fatto che l’automisurazione domiciliare della pressione arteriosa rappresenta attualmente uno dei pilastri su cui poggia la gestione dell’ipertensione arteriosa (19,97).
L’accuratezza diagnostica dell’identificazione della fibrillazione atriale durante la misurazione automatica della pressione arteriosa dipende molto dal numero di misurazione ottenute (98). Gli strumenti utilizzati per la misurazione domiciliare sono programmati per effettuare 3 misurazioni pressorie in sequenza per poi fornire un valore pressorio medio sulle 3 rilevazioni unitamente all’indicazione relativa alla presenza o meno di fibrillazione atriale. Le ragioni alla base di questa triplice rilevazione sono sostanzialmente 3 (98). In primo luogo, gli studi clinici suggeriscono che la ripetizione di 3 misurazioni consente di avere una stima più affidabile della pressione “reale” del paziente. Le linee guida raccomandano di effettuare almeno 2 rilevazioni pressorie e di prevedere misurazioni addizionali nel caso in cui le prime due differiscano considerevolmente (5 o più mmHg) tra di loro (19,97). In secondo luogo, l’effettuazione di misurazioni ripetute consente di superare le problematiche relative alla stima esatta della pressione arteriosa nei pazienti con irregolarità del ritmo cardiaco (99). Da ultimo, l’accuratezza diagnostica (in termini di specificità e sensibilità) nell’identificazione di una possibile fibrillazione atriale viene implementata dalle misurazioni ripetute (100). Una meta-analisi di 6 studi finalizzati alla valutazione dell’affidabilità diagnostica della misurazione automatica della pressione arteriosa nell’identificazione della fibrillazione atriale ha evidenziato una sensibilità pari a 0.98 (intervallo di confidenza al 95% compreso tra 0.95 e 1.00) ed una specificità pari a 0.92 (intervallo di confidenza al 95% compreso tra 0.88 e 0.96) (Figura 10) (98). L’uso di misurazioni ripetute è risultato associato ad un incremento, sia pur modesto, della sensibilità (da 0.97 con un intervallo di confidenza al 95% compreso tra 0.93 e 1.00 a 0.99 con un intervallo di confidenza al 95% compreso tra 0.97 e 1.00) e della specificità (da 0.86 con un intervallo di confidenza al 95% compreso tra 0.84 e 0.89 a 0.91 con un intervallo di confidenza al 95% compreso tra 0.89 e 0.93) (Figura 11). È evidente che l’utilità diagnostica dei dispositivi automatici per la misurazione della pressione arteriosa nell’individuazione della fibrillazione atriale è condizionata dalla validità degli algoritmi utilizzati. A questo riguardo è meritevole di menzione un recente studio condotto in 99 pazienti anziani (età media 70.2 anni) sottoposti simultaneamente a registrazione elettrocardiografica e a misurazione della pressione arteriosa con dispositivo automatico (Omron BP785N) provvisto di uno specifico algoritmo per la rilevazione di una possibile fibrillazione atriale. Questo studio ha dimostrato una accuratezza diagnostica dell’87.88% con una sensibilità del 100% ed una specificità dell’84.8% (101). In linea con queste evidenze uno studio, anch’esso, condotto in 227 pazienti in trattamento dialitico cronico ha dimostrato per il dispositivo Omron M6 una accuratezza diagnostica pari a 93.4% (intervallo di confidenza al 95% compreso tra 88.0 e 95.0), una sensibilità pari a 83.0% (intervallo di confidenza al 95% compreso tra 59.0 e 96.0) ed una specificità pari a 94% (intervallo di confidenza al 95% compreso tra 90.0 e 97.0) (102). Uno studio di confronto condotto da Marazzi G et al (103) in 503 pazienti ipertesi consecutivi sottoposti a misurazione della pressione arteriosa con 2 diversi dispositivi automatici dotati di algoritmo per la identificazione di irregolarità del ritmo cardiaco ha dimostrato per Omron M6 una sensibilità nella identificazione della fibrillazione atriale del 100%, una specificità del 94% ed una accuratezza diagnostica del 95% e per Microlife BP A200 Plus una sensibilità del 92%, una specificità del 97% ed una accuratezza diagnostica del 94%. Non appare inutile sottolineare l’importanza della semplicità degli strumenti automatici per la misurazione pressoria che ne consente l’agevole utilizzo anche da parte di soggetti anziani, tra i quali la fibrillazione atriale è particolarmente frequente. La possibilità, offerta da alcuni moderni dispositivi per l’automisurazione della pressione arteriosa, di effettuare misurazioni attendibili anche in presenza di circonferenze brachiali considerevoli rappresenta un ulteriore vantaggio pratico in ragione che il paziente iperteso con eccedenza ponderale presenta un elevato rischio di sviluppare fibrillazione atriale. La ricerca tecnologica ha reso oggi disponibili speciali manicotti – quali l’Intelli-wrap-cuff in dotazione con il misuratore automatico Omron M6 comfort-IT – che consentono di misurare correttamente la pressione arteriosa fino a 42 cm di circonferenza brachiale. Queste speciale manicotto, peraltro, consente di rilevare la pressione con accuratezza senza risentire di eventuali malposizionamenti a livello del braccio, dovuti ad una destrezza non sempre ottimale, che possono determinare una non trascurabile variabilità delle rilevazioni pressorie. Invero, questo aspetto appare non poco rilevante perchè il posizionamento non adeguato del bracciale rappresenta uno degli errori metodologici più spesso compiuti dal paziente e può portare ad una significativa sovrastima dei valori pressori. Mediamente un paziente su tre non posiziona correttamente la zona rilevatrice del bracciale rispetto all’arteria omerale. Un’ulteriore implementazione della misurazione domiciliare della pressione arteriosa è rappresentato dalla possibilità, offerta dai moderni dispositivi, del telemonitoraggio in remoto dei valori pressori misurati a livello domiciliare. In effetti la teletrasmissione a distanza dei dati automisurati si è dimostrata in grado di favorire un migliore controllo dell’ipertensione arteriosa (104). Questo aspetto appare di particolare rilevanza nella gestione dell’ipertensione in alcuni contesti clinici in cui l’interazione medico-paziente, anche da remoto, è particolarmente importante in ragione della relativa volubilità dell’assetto clinico come accade, ad esempio, nei pazienti con malattia renale cronica o scompenso cardiaco in fase avanzata. I pazienti ipertesi con malattia renale cronica generalmente seguono terapie molto complesse che prevedono quasi sempre l’utilizzo di diuretici e che sono soggette a una revisione col variare delle condizioni climatiche. La titolazione è quasi sempre necessaria, sistematica e se da un lato è importante che il paziente possa interagire agevolmente con il medico per la gestione dei farmaci, anche a distanza, del pari importante è l’acquisizione da parte del paziente con malattia renale cronica di un certo grado di autonomia gestionale della propria terapia sulla scorta dell’andamento dei propri valori pressori tenendo sotto controllo il proprio ritmo cardiaco. In questo ambito, alcuni moderni dispositivi – quali l’ORMON Complete – consentono la contemporanea misurazione della pressione arteriosa e la registrazione di un tracciato elettrocardiografico della durata di 30 secondi con un elettrocardiogramma a singola derivazione, coniugando in modo ideale le esigenze di una misurazione pressoria accurata con l’opportunità di uno screening adeguato della fibrillazione atriale in un contesto clinico, vale la pena ribadirlo, in cui la fibrillazione atriale è particolarmente frequente ed estremamente rilevante in chiave prognostica. Questa doppia funzionalità permette di poter contemporaneamente monitorare i valori pressori, la frequenza cardiaca e di registrare il tracciato elettrocardiografico, per la ricerca e segnalazione di eventuali anomalie cardiache attribuibili alla fibrillazione atriale. Il device, molto semplice da utilizzare, permette di comunicare con uno smartphone attraverso una App dedicata in modo che durante la misurazione della pressione arteriosa ed il tracciato elettrocardiografico, il tutto sia visibile, registrato, archiviato e condivisibile sulla App. L’algoritmo di cui questi device dispongo permette di restituire al paziente informazioni chiare ed affidabili, in seguito alla registrazione del proprio tracciato elettrocardiografico, in modo che queste possano poi essere condivise con il proprio medico di Medicina Generale o con il proprio specialista di riferimento. È evidente come questa tipologia di dispositivi possa trovare una sua collocazione, sulla scorta di quanto previsto dalla Linee Guida ESC e dal position paper dell’EHRA (1,90), nella ricerca opportunistica della fibrillazione atriale nella popolazione under 65 con almeno una comorbidità e nella ricerca sistematica della fibrillazione atriale nella popolazione degli ultrasessantacinquenni con o senza comorbilità.
CONSIDERAZIONI DI COSTO/EFFICACIA
La fibrillazione atriale è un problema di sanità pubblica con un impatto economico enorme. Nel 2010 le stime epidemiologiche parlavano di 33 milioni di pazienti con fibrillazione atriale nel mondo, cifra destinata a raddoppiarsi nel 2050 (1). La fibrillazione atriale comporta enormi costi per la collettività, sia diretti (principalmente ospedalizzazioni, visite ambulatoriali, accertamenti laboratoristi e strumentali) che indiretti (principalmente perdita di produttività e costi per caregiver), per un corrispettivo che nei paesi europei viene stimato intorno al 2.5% della spesa sanitaria annua totale (105). Tali costi sono soprattutto legati ai ricoveri e alla possibile insorgenza di complicanze tra cui spicca per rilevanza clinica ed impatto economico l’ictus (105,106). Entro il 2030 si prevede un aumento del numero di episodi di ictus e visite mediche legate alla fibrillazione atriale con 280-340.000 nuovi episodi di ictus ischemici, 3.5-4 milioni di ricoveri e 100-120 milioni di visite ambulatoriali (107).
Queste cifre, unitamente all’impatto non di rado devastante delle complicanze della fibrillazione atriale sullo stato di salute di chi ne è affetto, sottolineano l’opportunità di impostare strategie di screening che, attraverso una diagnosi precoce della fibrillazione atriale, consentano una gestione ottimale di questa aritmia impostando trattamenti e strategie di prevenzione efficaci. Basti pensare alla documentata efficacia della terapia anticoagulante di ridurre di oltre il 65% il rischio di ictus embolico (1). Non sorprende, quindi, che il già citato studio SEARCH-AF abbia dimostrato un rapporto costo/efficacia incrementale estendendo lo screening della fibrillazione atriale a livello di comunità con un risparmio, basato su una ipotesi di aderenza alla terapia anticoagulante con warfarin del 55%, di 3.142 euro per ogni anno di vita pesato per qualità di vita guadagnato e di 15.993 euro per ogni ictus prevenuto (94).
Recentemente il favorevole rapporto costo/efficacia dello screening della fibrillazione atriale con dispositivi portatili per la registrazione elettrocardiografica ha trovato conferma in uno studio inglese condotto in individui ultrasettantacinquenni che ha dimostrato un rapporto costo/efficacia incrementale di oltre 1000 sterline per ogni anno di vita pesato per qualità di vita guadagnato (108). I principali determinanti di questo vantaggio sono risultati rappresentati dai costi dell’assistenza a lungo termine per i casi di ictus, la prevalenza della fibrillazione atriale non valvolare misconosciuta e l’efficacia clinica della terapia anticoagulante nella prevenzione dell’ictus.
CONCLUSIONI
L’approccio tradizionale, rappresentato dalla palpazione del polso finalizzata a cogliere gli aspetti semeiologici del “delirium cordis”, tipico della fibrillazione atriale, è gravato da una accuratezza diagnostica modesta rispetto alla rilevanza della condizione cliniche che ci prefigge di individuare, anche in ragione del carattere parossistico della fibrillazione atriale che, conseguentemente, può sfuggire alla singola rilevazione da parte del clinico. Il progresso tecnologico ha reso oggi disponibili strumenti affidabili che possono essere gestiti direttamente da parte del paziente. Tra questi meritano particolare menzione i moderni dispositivi che consento di derivare, interfacciandosi con una App dedicata, una registrazione elettrocardiografica di 1 o più derivazioni della durata di 30 secondi, nel rispetto di quanto raccomandato dalle linee guida. Questi dispositivi rappresentano una opportunità preziosa per lo screening della fibrillazione atriale, in quanto sono gestiti direttamente dal paziente; queste rilevazioni possono essere effettuate dal paziente secondo le indicazioni del proprio medico di riferimento, il quale dovrà sempre coordinare ogni procedura di screening. Non meno importante è l’utilizzo di dispositivi per la misurazione della pressione arteriosa dotati di un algoritmo validato per individuare la possibile presenza di fibrillazione atriale. Considerata la frequenza e la rilevanza clinica dell’associazione tra ipertensione arteriosa e fibrillazione atriale, appare immediatamente evidente l’utilità di questi dispositivi per la misurazione domiciliare della pressione arteriosa. Peraltro, attualmente sono disponibili dispositivi che consentono la contemporanea misurazione della pressione arteriosa e la registrazione di un tracciato elettrocardiografico della durata di 30 secondi, con un elettrocardiogramma a singola derivazione coniugando in modo ideale le esigenze di una misurazione pressoria accurata con l’opportunità di uno screening adeguato della fibrillazione atriale.
Bibliografia
- Hindricks G, et al; ESC Scientific Document Group. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J. 2021 Feb 1;42(5):373-498.
- Kirchhof P, et al. Comprehensive risk reduction in patients with atrial fibrillation: emerging diagnostic and therapeutic options. Executive summary of the report from the 3rd AFNET/EHRA consensus conference. Thromb Haemost. 2011;106:1012–1019.
- McIntyre WF, Healey J. Stroke prevention for patients with atrial fibrillation: beyond the guidelines. J Atr Fibrillation. 2017;9:1475. doi: 10.4022/jafib.147
- Chugh SS, et al. Global burden of atrial fibrillation in developed and developing nations. Glob Heart. 2014;9:113–119.
- Kirchhof P, et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur J Cardiothorac Surg. 2016;50:e1–e88.
- Chugh SS, et al. Worldwide epidemiology of atrial fibrillation: a Global Burden of Disease 2010 Study. Circulation. 2014;129:837–847.
- Turakhia MP, et al. Economic burden of undiagnosed nonvalvular atrial fibrillation in the United States. Am J Cardiol 2015;116:733-739.
- Mairesse GH, et al. ESC Scientific Document Group. Screening for atrial fibrillation: a European Heart Rhythm Association (EHRA) consensus document endorsed by the Heart Rhythm Society (HRS), Asia Pacific Heart Rhythm Society (APHRS), and Sociedad Latinoamericana de Estimulacion Cardiaca y Electrofisiologia (SOLAECE). Europace 2017;19:1589-1623.
- Fay MR, et al. Screening of older patients for atrial fibrillation in general practice: current evidence and its implications for future practice. Eur J Gen Pract 2017;23:246-253.
- Lakshminarayan K, et al. Atrial fibrillation and stroke in the general medicare population: a 10- year perspective (1992 to 2002). Stroke 2006; 37(8):1969-74
- Marinigh R, Lip GY, Fiotti N, et al. Age as a risk factor for stroke in atrial fibrillation patients: implications for thromboprophylaxis. Journal of the Ame- rican College of Cardiology 2010; 56(11):827-837
- Rocken C, et al. An arrhythmogenic substrate for persistent atrial fibrillation. Circulation 2002; 106:2091-97
- Kistler P, Sanders P, Fynn S et al. Electrophysiologic and Electroanatomic changes in the human atrium associated with age. JACC 2004; 44:109-16
- Ha JT, et al. Benefits and harms of oral anticoagulant therapy in chronic kidney disease: a systematic review and meta-analysis. Ann Intern Med 2019;171:181-189.
- Lip GYH, et al. Hypertension and cardiac arrhythmias: a consensus document from the European Heart Rhythm Association (EHRA) and ESC Council on Hypertension, endorsed by the Heart Rhythm Society (HRS), Asia-Pacific Heart Rhythm Society (APHRS) and Sociedad Latinoamericana de Estimulacion Cardiaca y Electrofisiologia (SOLEACE). Europace 2017;19:891 911.
- Dzeshka MS, et al. Atrial fibrillation and hypertension. Hypertension 2017;70:854-861.
- Pokorney SD. RENal hemodialysis patients ALlocated apixaban versus warfarin in Atrial Fibrillation (RENAL-AF). Presentation at the American Heart Association Annual Scientific Sessions (AHA 2019), Philadelphia, PA, 16 November 2019.
- Violi F, et al. ARAPACIS Study Investigators. Prevalence of peripheral artery disease by abnormal ankle-brachial index in atrial fibrillation: implications for risk and therapy. J Am Coll Cardiol 2013;62:2255-2256.
- Mancia G, et al. Authors/Task Force Members:. 2023 ESH Guidelines for the management of arterial hypertension The Task Force for the management of arterial hypertension of the European Society of Hypertension Endorsed by the European Renal Association (ERA) and the International Society of Hypertension (ISH). J Hypertens. 2023 Jun 21. doi: 10.1097/HJH.0000000000003480.
- Buist AS, et al. BOLD Collaborative Research Group. International variation in the prevalence of COPD (the BOLD Study): a population-based prevalence study. Lancet 2007;370:741–750.
- Proietti M, et al. EORP-AF Investigators. Impact of chronic obstructive pulmonary disease on prognosis in atrial fibrillation: a report from the EURObservational Research Programme Pilot Survey on Atrial Fibrillation (EORP-AF) general registry. Am Heart J 2016;181:83–91.
- Rodrıguez-Manero M, et al. A prospective study of the clinical outcomes and prognosis associated with comorbid COPD in the atrial fibrillation population. Int J Chron Obstruct Pulmon Dis 2019;14:371–380.
- Konecny T, et al. Relation of chronic obstructive pulmonary disease to atrial and ventricular arrhythmias. Am J Cardiol 2014;114:272–277.
- Liao KM, et al. Incidence and risk factors of atrial fibrillation in Asian COPD patients. Int J Chron Obstruct Pulmon Dis. 2017 Aug 23;12:2523-2530.
- Chen X, et al. The progression in atrial fibrillation patients with COPD: a systematic review and meta-analysis. Oncotarget. 2017 Oct 26;8(60):102420-102427.
- Simons SO, et al. Chronic obstructive pulmonary disease and atrial fibrillation: an interdisciplinary perspective. Eur Heart J. 2021 Feb 1;42(5):532-540.
- Elia D, et al. Pulmonary hypertension and chronic lung disease: where are we headed? Eur Respir Rev 2019;28:190065.
- Linz D, et al. Associations of obstructive sleep apnea with atrial fibrillation and continuous positive airway pressure treatment: a review. JAMA Cardiol 2018;3:532–540.
- Agust A, et al. Update on the pathogenesis of chronic obstructive pulmonary disease. N Engl J Med 2019;381:1248–1256.
- Canepa M, et al. Diagnostic and therapeutic gaps in patients with heart failure and chronic obstructive pulmonary disease. JACC Heart Fail 2019;7:823–833.
- Stevenson IH, et al. Atrial electrophysiology is altered by acute hypercapnia but not hypoxemia: implications for promotion of atrial fibrillation in pulmonary disease and sleep apnea. Heart Rhythm 2010;7:1263–1270.
- Linz D, et al. Atrial autonomic innervation: a target for interventional antiarrhythmic therapy?. Int J Cardiol 2019;287:181–188.
- Santus P, et al. Switching to nebulised short acting bronchodilators does not increase the risk of arrhythmia in patients hospitalized with a COPD exacerbation. Pharmacol Res. 2021 Nov;173:105915. doi: 10.1016/j.phrs.2021.105915. Epub 2021 Sep 25. PMID: 34571145.
- Pisters R, et al. for the Euro Heart Survey Investigators. Clinical correlates of immediate success and outcome at 1-year follow-up of real-world cardioversion of atrial fibrillation: the Euro Heart Survey. Europace 2012;14:666–674.
- Gu J, et al. Impact of chronic obstructive pulmonary disease on procedural outcomes and quality of life in patients with atrial fibrillation undergoing catheter ablation. J Cardiovasc Electrophysiol 2013;24:148–154.
- Emren SV, et al. The role of HATCH score in predicting the success rate of sinus rhythm following electrical cardioversion of atrial fibrillation. Kardiol Pol 2016;74:978–984.
- Roh SY, et al. Catheter ablation of atrial fibrillation in patients with chronic lung disease. Circ Arrhythm Electrophysiol 2011;4:815–822.
- Arora S, et al. Causes and predictors of readmission in patients with atrial fibrillation undergoing catheter ablation: a national population-based cohort study. J Am Heart Assoc 2018;7:e009294.
- Seara JG, et al. Risk of atrial fibrillation, stroke, and death after radiofrequency catheter ablation of typical atrial flutter. Clin Res Cardiol 2014;103:543–552.
- Dransfield MT, et al. SUMMIT Investigators. b-Blocker therapy and clinical outcomes in patients with moderate chronic obstructive pulmonary disease and heightened cardiovascular risk. An observational substudy of SUMMIT. Ann Am Thorac Soc 2018;15:608–614.
- Mendez-Bailon M, et al. Chronic obstructive pulmonary disease predicts higher incidence and in hospital mortality for atrial fibrillation. An observational study using hospital discharge data in Spain (2004-2013). Int J Cardiol 2017;236:209–215.
- Xiao X, et al. Prevalence of atrial fibrillation in hospital encounters with end-stage COPD on home oxygen: national trends in the United States. Chest 2019;155:918–927.
- Hirayama A, et al. Acute exacerbation of chronic obstructive pulmonary disease and subsequent risk of emergency department visits and hospitalizations for atrial fibrillation. Circ Arrhythm Electrophysiol 2018;11:e006322.
- Desai R, et al. The burden and impact of arrhythmia in chronic obstructive pulmonary disease: insights from the National Inpatient Sample. Int J Cardiol 2019;281:49–55.
- Durheim MT, et al. Characteristics and outcomes of adults with chronic obstructive pulmonary disease and atrial fibrillation. Heart 2018;104:1850–1858.
- Movahed MR, et al. Diabetes mellitus is a strong, independent risk for atrial fibrillation and flutter in addition to other cardiovascular disease. Int J Cardiol 2005;105:315-318.
- Lee SR, et al. Evaluation of the association between diabetic retinopathy and the incidence of atrial fibrillation: a nationwide population-based study. Int J Cardiol 2016;223:953-957.
- Wang TJ, et al. Obesity and the risk of new-onset atrial fibrillation. JAMA 2004;292:2471-2477.
- Du X, et al. Risks of cardiovascular events and effects of routine blood pressure lowering among patients with type 2 diabetes and atrial fibrillation: results of the ADVANCE study. Eur Heart J 2009;30:1128 1135.
- Pallisgaard JL, et al. Risk of atrial fibrillation in diabetes mellitus: a nationwide cohort study. Eur J Prev Cardiol 2016;23:621-627.
- Rizzo MR, et al. Autonomic dysfunction is associated with brief episodes of atrial fibrillation in type 2 diabetes. J Diabetes Complications 2015;29:88-92.
- PhD LGMP. Association of Atrial Fibrillation with Diabetes Mellitus, High Risk Comorbidities. Maedica (Bucur). 2022 Mar;17(1):143-152.
- Fangel MV, et al. Type 1 versus type 2 diabetes and thromboembolic risk in patients with atrial fibrillation: a Danish nationwide cohort study. Int J Cardiol 2018;268:137-142
- Mozaffarian D, et al. American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Heart disease and stroke statistics 2015 update: a report from the American Heart Association. Circulation 2015;131:e29-322.
- Fatemi O, et al. Impact of intensive glycemic control on the incidence of atrial fibrillation and associated cardiovascular outcomes in patients with type 2 diabetes mellitus (from the Action to Control Cardiovascular Risk in Diabetes study). Am J Cardiol 2014;114:1217-1222.
- Donnellan E, et al. Association between pre-ablation glycemic control and outcomes among patients with diabetes undergoing atrial fibrillation ablation. JACC Clin Electrophysiol 2019;5:897-903.
- Chang SH, et al. Association of metformin with lower atrial fibrillation risk among patients with type 2 diabetes mellitus: a population-based dynamic cohort and in vitro studies. Cardiovasc Diabetol 2014;13:123.
- Bell DSH, et al. Atrial fibrillation and type 2 diabetes: prevalence, etiology, pathophysiology and effect of anti-diabetic therapies. Diabetes Obes Metab 2019;21:210 217.
- Javed S et al. Obesity and atrial fibrillation: making inroads through fat. Eur Heart J Cardiovasc Pharmacother 2021 Jan 16;7(1):59-67.
- Tedrow UB, et al. The long- and short-term impact of elevated body mass index on the risk of new atrial fibrillation the WHS (Women’s Health Study). J Am Coll Cardiol 2010;55:2319–2327.
- Echahidi N, et al. Obesity and metabolic syndrome are independent risk factors for atrial fibrillation after coronary artery bypass graft surgery. Circulation 2007;116:I213–I219.
- Wang TJ, et al. Obesity and the risk of new-onset atrial fibrillation. JAMA 2004;292:2471–2477.
- Morin DP, et al. The state of the art: atrial fibrillation epidemiology, prevention, and treatment. Mayo Clin Proc 2016;91:1778–1810.
- Huxley RR, et al. Absolute and attributable risks of atrial fibrillation in relation to optimal and borderline risk factors: the Atherosclerosis Risk in Communities (ARIC) study. Circulation 2011;123:1501–1508.
- Frost L, et al. Overweight and obesity as risk factors for atrial fibrillation or flutter: the Danish Diet, Cancer, and Health Study. Am J Med 2005;118:489–495.
- Tsang TS, et al. Obesity as a risk factor for the progression of paroxysmal to permanent atrial fibrillation: a longitudinal cohort study of 21 years. Eur Heart J 2008;29:2227–2233.
- Foy AJ, et al. Relation of obesity to new-onset atrial fibrillation and atrial flutter in adults. Am J Cardiol 2018;121:1072–1075.
- Karasoy D, et al. Obesity is a risk factor for atrial fibrillation among fertile young women: a nationwide cohort study. Europace 2013;15:781–786.
- Goudis CA, et al. Obstructive sleep and atrial fibrillation: pathophysiological mechanisms and therapeutic implications. Int J Cardiol 2017;230:293-300.
- Boriani G et al. Chronic kidney disease in patients with cardiac rhythm disturbances or implantable electrical devices: clinical significance and implications for decision making-a position paper of the European Heart Rhythm Association endorsed by the Heart Rhythm Society and the Asia Pacific Heart Rhythm Society. Europace (2015):17:1169–1196.
- Zimmerman D, et al. Systematic review and meta-analysis of incidence, prevalence and outcomes of atrial fibrillation in patients on dialysis. Nephrol Dial Transplant 2012;27:3816-3822.
- Wetmore JB, et al. The prevalence of and factors associated with chronic atrial fibrillation in Medicare/Medicaid-eligible dialysis patients. Kidney Int 2012;81:469–76.
- Ananthapanyasut W, et al. Prevalence of atrial fibrillation and its predictors in nondialysis patients with chronic kidney disease. Clin J Am Soc Nephrol 2010;5:173–81.
- Soliman EZ, et al. Chronic kidney disease and prevalent atrial fibrillation: the Chronic Renal Insufficiency Cohort (CRIC). Am Heart J 2010;159:1102–7.
- Baber U, et al. Association of chronic kidney disease with atrial fibrillation among adults in the United States: REasons for Geographic and Racial Differences in Stroke (REGARDS) Study. Circ Arrhythm Electrophysiol 2011;4:26–32.
- Olesen JB, Lip GY, Kamper AL, Hommel K, Kober L, Lane DA et al. Stroke and bleeding in atrial fibrillation with chronic kidney disease. N Engl J Med 2012;367:625–35.
- Potpara TS, et al. Use of oral anticoagulants in patients with atrial fibrillation and renal dysfunction. Nat Rev Nephrol 2018;14:337-351.
- Albertsen IE, et al. Risk of stroke or systemic embolism in atrial fibrillation patients treated with warfarin: a systematic review and meta-analysis. Stroke 2013;44:1329-1336.
- Olesen JB, et al. Stroke and bleeding in atrial fibrillation with chronic kidney disease. N Engl J Med 2012;367:625-635.
- Fauchier L, et al. Changes in glomerular filtration rate and outcomes in patients with atrial fibrillation. Am Heart J 2018;198:39-45.
- Szekely P. Systemic embolism and anticoagulant prophylaxis in rheumatic heart disease. Br Med J 1964;1:1209-1212.
- Philippart R, et al. Oral anticoagulation, stroke and thromboembolism in patients with atrial fibrillation and valve bioprosthesis. The Loire Valley Atrial Fibrillation Project. Thromb Haemost 2016;115:1056-1063.
- Fauchier L, et al. Should atrial fibrillation patients with only 1 nongender-related CHA2DS2-VASc risk factor be anticoagulated?Stroke 2016;47:1831-1836.
- Chao TF, et al. Acute myocardial infarction in patients with atrial fibrillation with a CHA2DS2-VASc score of 0 or 1: a nationwide cohort study. Heart Rhythm 2014;11:1941-1947.
- Soliman EZ, et al. Atrial fibrillation and the risk of myocardial infarction. JAMA Intern Med 2014;174:107-114.
- January CT, et al. 2014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation: executive summary: a report of the American College of Cardiology/American Heart Association Task Force on practice guidelines and the Heart Rhythm Society. Circulation. 2014;130:2071–2104.
- NICE, Hypertension: Clinical Management of Primary Hypertension in Adults, 2011 CG127. http://wwwniceorguk/ guidance/CG127 (Assessed 18 Aug. 2015).
- Hobbs FD, et al. A randomized controlled trial and cost effectiveness study of systematic screening (targeted and total population screening) versus routine practice for the detection of atrial fibrillation in people aged 65 and over. The SAFE study, Health Technol. Assess. 9 (iii-iv, ix-x) (2005) 1-74.
- Jones C, et al. Guideline Development Group. The management of atrial fibrillation: summary of updated NICE guidance. BMJ. 2014;348:g3655. doi: 10.1136/bmj.g3655
- Svennberg E, et al. How to use digital devices to detect and manage arrhythmias: an EHRA practical guide. EP Europace, 2022;6: 979–1005.
- Bumgarner JM, et al. Smartwatch algorithm for automated detection of atrial fibrillation. J Am Coll Cardiol 2018;71:2381-2388.
- Wasserlauf J, et al. Smartwatch performance for the detection and quantification of atrial fibrillation. Circ Arrhythm Electrophysiol 2019;12:e006834.
- Attia ZI, et al. Anartificial intelligence-enabled ECG algorithm for the identification of patients with atrial fibrillation during sinus rhythm: a retrospective analysis of outcome prediction. Lancet 2019;394:861-867.
- Lowres N, et al. Feasibility and cost-effectiveness of stroke prevention through community screening for atrial fibrillation using iPhone ECG in pharmacies. The SEARCH-AF study. Thromb Haemost 2014;111:1167–1176.
- Orchard J, et al. eHealth tools to provide structured assistance for atrial fibrillation screening, management, and guideline-recommended therapy in metropolitan general practice: the AF—SMART study. J Am Heart Assoc 2019;8: e010959.
- Godin R, et al. Screening for atrial fibrillation using a mobile, single-lead electrocardiogram in Canadian Primary Care Clinics. Can J Cardiol 2019;35:840–845
- Unger T, et al. 2020 International Society of Hypertension Global Hypertension Practice Guidelines. Hypertension. 2020;75:1334-1357.
- Verberk WJ, et al. Screening for atrial fibrillation with automated blood pressure measurement: Research evidence and practice recommendations. Int J Cardiol 2016; 203:465–473.
- Myers MG, et al. Should oscillometric blood pressure monitors be used in patients with atrial fibrillation? J Clin Hypertens (Greenwich) 2015;17: 565–566.
- Verberk WJ, et al. Accuracy of oscillometric blood pressure monitors for the detection of atrial fibrillation: a systematic review. Exp Rev Med Devices 2012;9:635–640.
- Balanis T, et al. Detection of Atrial Fibrillation Using a Home Blood Pressure Monitor. Vascular Health and Risk Management 2021:17 407–414
- Al Awwa I, et al. Accuracy and feasibility of portable blood pressure monitoring in the detection of atrial fibrillation in hemodialysis patients. Rev. Cardiovasc. Med. 2021 vol. 22(1), 225-229.
- Marazzi G, et al. Comparison of Microlife BP A200 Plus and Omron M6 Blood Pressure Monitors to Detect Atrial Fibrillation in Hypertensive Patients. Adv Ther (2012) 29(1):64-70.
- Parati G, et al. Home blood pressure telemonitoring improves hypertension control in general practice. The TeleBPCare study. J Hypertens 2009;27(1):198-203.
- Ball J, et al. (2013) Atrial fibrillation: profile and burden of an evolving epidemic in the 21st century. Int J Cardiol 2013;167(5):1807-1824.
- Stewart S, et al. Cost of an emerging epidemic: an economic analysis of atrial fibrillation in the UK. Heart 2004;90(3):286-292.
- Zoni-Berisso M, et al. Epidemiology of atrial fibrillation: European perspective. Clin Epidemiol 2014;6:213-220.
- Patel S, et al. Cost-effectiveness of targeted screening for non-valvular atrial fibrillation in the United Kingdom in older patients using digital approaches. J Med Econ. 2023 Jan-Dec;26(1):326-334.
Related papers
Lo scenario della medicina attuale è caratterizzato da elementi di complessità generale inimmaginabili due decenni fa ed in grado di rendere molto più difficile la pratica clinica giornaliera. In particolare, la coesistenza di multiple condizioni passibili di un trattamento farmacologico nello stesso soggetto condiziona in maniera forzata alcune delle scelte terapeutiche spingendo alla ricerca di [more info]
Premessa Nell’ultimo decennio l’orizzonte della terapia ipolipemizzante si è arricchita di formidabili strumenti terapeutici quali ezitimibe, inibitori della proteina PCSK9 (PCSK9i) e acido bempedoico. Gli studi su queste molecole hanno permesso non solo di dimostrarne l’efficacia, ma hanno fornito importanti informazioni sull’importanza dell’abbassamento delle LDL nella riduzione del rischio cardiovascolare (CV) e costituiscono la base [more info]
Colesterolemia subottimale come fattore di rischio per le malattie cardiovascolari Il miglioramento delle abitudini alimentari e l’ottimizzazione dei livelli di colesterolo LDL nel sangue – fattore causale e cumulativo - sembrano essere strumenti efficaci per ridurre il rischio di malattie cardiovascolari su base aterosclerotica, che ancora oggi rappresentano una delle principali cause di morte e [more info]