1. L’ipertensione arteriosa: eziopatologia e focus sul sistema adrenergico
L’ipertensione arteriosa vienefinita ce dome la rilevazione di una pressione arteriosa sistolica (SBP) > 140mmHg e/o diastolica >90mmHg (DBP) (1). Sulla base delle multifattoriali origini eziopatologiche dell’ipertensione arteriosa si distingue generalmente fra ipertensione primitiva e secondaria. Quest’ultima, trova origine in condizioni mediche preesistenti come stenosi dell’arteria renale o iperaldosteronismo primitivo; in questo caso, il trattamento è mirato all’eliminazione della causa di ipertensione sottostante (2). L’ipertensione primitiva (o essenziale), invece, solitamente origina da un errato stile di vita e/o predisposizioni genetiche e rappresenta il 90-95% di tutti i casi di ipertensione diagnosticati: essa viene quindi trattata tramite modifiche dello stile di vita e l’assunzione di farmaci antipertensivi, qualora necessario.
Tra i vari fattori coinvolti nell’insorgenza dell’ipertensione, è importante citare obesità, stress e eccessiva assunzione di alcol e sale, che concorrono ad alterazioni dei sistemi di ritenzione e escrezione del sodio, disfunzione endoteliale e attivazione del sistema nervoso simpatico (SNS) e del tono adrenergico (3). L’attivazione del SNS, mediata da elevati livelli di catecolamine circolanti, porta infatti ad un incremento sia della frequenza e contrattilità cardiaca sia della funzionalità del RAAS (Sistema renina-angiotensina-aldosterone) causando quindi ritenzione di acqua e sodio e vasocostrizione periferica (3).
Le principali catecolamine coinvolte nell’attivazione del tono adrenergico sono i neurotrasmettitori adrenalina e noradrenalina, che esercitano il loro effetto legandosi a specifici recettori adrenergici di superficie, suddivisi in α e β 4). In particolare, l’attivazione dei recettori β1 adrenergici, localizzati nei vasi sanguigni periferici, porta alla loro costrizione. Allo stesso modo, l’attivazione del recettore β2, localizzato principalmente nella muscolatura liscia bronchiale e dei grandi vasi periferici, conduce a contrazione muscolare e conseguente costrizione bronchiale e vasale (4). Il recettore β3, invece, risulta essere principalmente localizzato nel tessuto adiposo, dove sembra svolgere il ruolo di attivazione di lipasi che agiscono sui trigliceridi di deposito (5).
Il muscolo cardiaco esprime tutti e 3 i recettori appartenenti alla famiglia dei recettori β-adrenergici, che rivestono il ruolo di regolazione della frequenza e della contrattilità cardiaca in risposta ad adrenalina e noradrenalina; tuttavia, il recettore β-adrenergico con una selettiva predominanza nel muscolo cardiaco risulta essere il β1 (6).
Riassumendo, l’attivazione dei recettori adrenergici comporta una varietà di effetti cardiovascolari come un’azione ionotropa, cronotropa e lusitropa positiva a livello del muscolo cardiaco (aumento della contrattilità, frequenza e velocità di rilassamento) e una costrizione dei vasi periferici, che concorrono certamente all’eziopatogenesi e al mantenimento dell’ipertensione arteriosa.
Tuttavia, il sistema adrenergico non è il solo contribuente al tono e alla costrizione vascolare; infatti, l’endotelio stesso è in grado di produrre, in risposta a stimoli fisiologici o patologici, una serie di mediatori vasocostrittori o dilatatori. Fra questi ultimi, è utile ricordare in particolar modo l’ossido nitrico (NO) che gioca un ruolo principale nella regolazione del tono vascolare e della pressione arteriosa.
2. Farmaci antipertensivi: classe dei β-bloccanti
I β-bloccanti sono una classe di farmaci utilizzata da più di 30 anni nella terapia antipertensiva (7). Nonostante siano accomunati dal meccanismo d’azione, in quanto antagonisti di recettori adrenergici, le molecole appartenenti a questa classe si differenziano marcatamente per diversi parametri che impattano sull’effetto clinico: il profilo di selettività d’azione per β1 e β2, l’eventuale attività simpaticomimetica intrinseca, il differente grado di solubilità che influisce sull’assorbimento a livello del sistema nervoso centrale, il profilo farmacocinetico e proprietà aggiuntive di agonismo inverso o di vasodilatazione (7).
Esistono 3 generazioni di farmaci β-bloccanti, col tempo introdotte nella pratica clinica (7). La prima generazione include molecole che non presentano un’affinità selettiva per β1 o β2; di conseguenza, a causa dell’azione antagonizzante su β2 a livello periferico, l’utilizzo di questa generazione di farmaci causa comuni e rilevanti effetti collaterali come il broncospasmo, la vasocostrizione periferica (causa di sensazione di arti freddi e disfunzione erettile) e l’aumento di peso (dovuto all’antagonismo dei recettori β2 a livello del pancreas) (6,7). Gli effetti collaterali appena citati non solo incidono in modo rilevante sulla qualità della vita dei pazienti, ma sono anche alla base della controindicazione di questa generazione di β-bloccanti per il trattamento dell’ipertensione in pazienti con alterazioni metaboliche o asmatici. Dall’esigenza di evitare gli effetti collaterali dovuti dall’antagonismo dei recettori β2, mantenendo però l’azione antipertensiva a livello cardiaco data dal blocco dei recettori β1, sono nati i farmaci β-bloccanti di seconda generazione, caratterizzati da una selettività superiore (ma non assoluta) e dose-dipendente per il recettore β1 e quindi meglio tollerati, soprattutto nei pazienti respiratori o con patologie vascolari periferiche (7). La terza generazione di β-bloccanti, invece, è composta da molecole sia selettive sia non selettive per β1 che però possiedono proprietà addizionali (7) (come la capacità vasodilatatoria di stimolare la produzione di NO) che devono essere prese in considerazione per ottimizzare una terapia di tipo personalizzato.
Inoltre, come già accennato, alcuni farmaci -bloccanti possiedono un’attività simpaticomimetica intrinseca (ISA), ovvero una residua capacità di stimolare l’attività basale dei -recettori, agendo come agonisti parziali in assenza di catecolamine (7); questa caratteristica può diventare funzionale qualora fosse necessario limitare una condizione di eccessiva bradicardia a riposo.
Infine, alcune molecole appartenenti alla classe dei -bloccanti, possono esercitare un meccanismo d’azione da agonista inverso (7): in questo caso, a differenza degli antagonisti competitivi che si sostituiscono al ligando endogeno, le molecole possono agire inibendo l’attività recettoriale basale anche in assenza di catecolamine.
Tutte le proprietà presentate, quindi, entrano in gioco nel definire il profilo di un -bloccante, in un’ottica di terapia centrata sulle esigenze e caratteristiche cliniche del paziente. Da ricordare, infine, che secondo le linee guida europee, l’utilizzo dei -bloccanti nel trattamento dell’ipertensione è particolarmente raccomandato in specifiche condizioni, come in presenza di una evidente ed eccessiva stimolazione simpatica.
3. Bisoprololo
3.1 Indicazioni e posologia
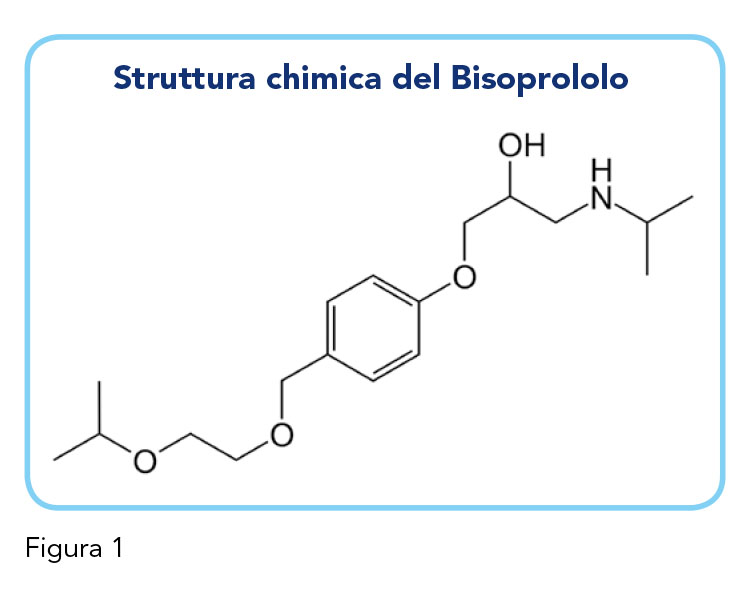
Il Bisoprololo è un agente bloccante 1-adrenergico cardioselettivo usato per il trattamento dell’ipertensione di grado lieve-moderato e dell’insufficienza cardiaca cronica (Figura 1).
Grazie alla sua lunga emivita, può essere utilizzato una volta al giorno, a tutto vantaggio della semplificazione dello schema terapeutico. Il Bisoprololo è generalmente ben tollerato, vista la selettività del recettore 1-adrenergico. Può essere usato da solo o in combinazione con altri farmaci per gestire l’insufficienza cardiaca e può essere utile nei pazienti con concomitante broncopneumopatia cronica ostruttiva (BPCO) (8).
Il Bisoprololo può essere usato nel (9,10):
• Trattamento dell’ipertensione (lieve-moderata)
• Trattamento dell’angina pectoris cronica stabile
• Trattamento dell’insufficienza cardiaca cronica stabile, con ridotta funzione ventricolare sistolica in aggiunta a terapia con ACE inibitori e diuretici, ed eventualmente glicosidi cardioattivi.
La strategia raccomandata per il trattamento dell’ipertensione e dell’angina pectoris cronica stabile negli adulti prevede di iniziare con un dosaggio di Bisoprololo di 5 mg una volta al giorno e, se ben tollerato, di titolare la dose fine al dosaggio standard di 10 mg una volta al giorno. Per quanto riguarda gli anziani, di solito non è richiesto un aggiustamento del dosaggio ma è bene iniziare con la dose più bassa possibile; l’uso di Bisoprololo non è invece raccomandato nei bambini. Bisogna usare cautela quando si aumenta il dosaggio di Bisoprololo in pazienti con insufficienza cardiaca cronica e compromissione della funzione renale o epatica (11).
Quando si inizia il trattamento con Bisoprololo, il paziente deve essere emodinamicamente stabile e la somministrazione del Bisoprololo deve essere effettuata attraverso un periodo di titolazione iniziale.
L’iniziale aumento del dosaggio deve essere effettuato a intervalli settimanali in base alla tolleranza del paziente, iniziando nella prima settimana con 1,25 mg al giorno, per poi aumentare di 1,25 mg ogni settimana successiva fino ad arrivare a 10 mg al giorno. La dose raccomandata e di mantenimento è di 10 mg una volta al giorno. Inoltre, è necessario monitorare i segni vitali (frequenza cardiaca, pressione sanguigna) e gli eventuali peggioramenti dell’insufficienza cardiaca durante la fase iniziale di titolazione per poter adattare la terapia, che sarà a lungo termine, in base ai bisogni del paziente. Tra le informazioni sulla prescrizione è riportato che il dosaggio di Bisoprololo può dover essere ridotto se i pazienti non tollerano il trattamento o se si verifica un peggioramento dell’insufficienza cardiaca. In tal caso, è necessario non sospendere in modo improvviso il trattamento ma il dosaggio deve essere diminuito lentamente, con un dimezzamento settimanale della dose.
Meccanismo d’azione
Il Bisoprololo è un antagonista altamente cardioselettivo del 1-adrenocettore senza attività simpaticomimetica intrinseca (agonista parziale) o stabilizzante della membrana (anestetico locale) (12).
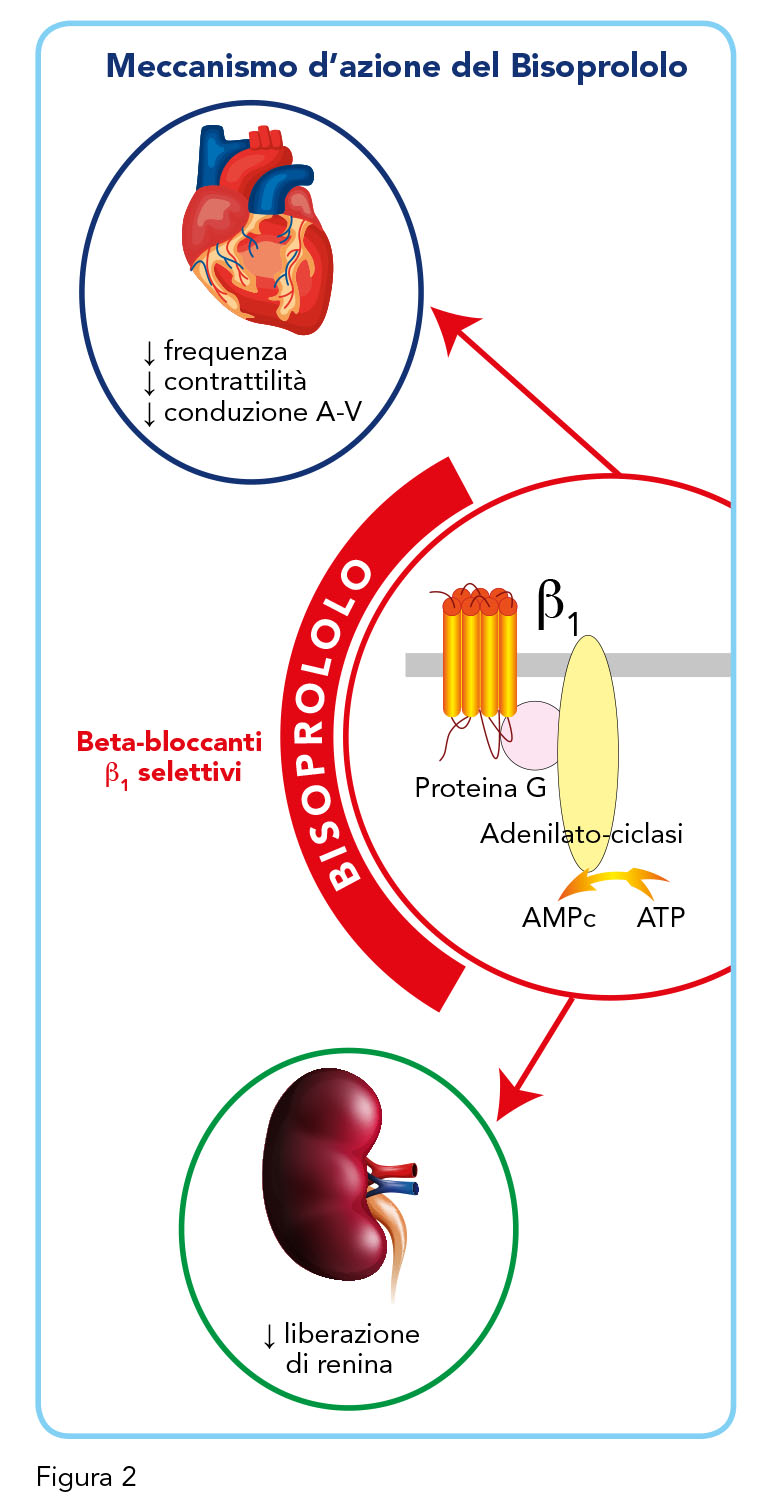
I recettori 1 si trovano principalmente nel tessuto nodale cardiaco, nei miociti cardiaci e nei reni. I 1 bloccanti, come il Bisoprololo, esercitano il loro effetto legandosi selettivamente ai siti dei recettori 1, inibendo l’azione dell’adrenalina e della norepinefrina su questi recettori. I recettori 1 sono recettori accoppiati a proteine G (in particolare la subunità alfa Gs) la cui azione è esercitata attraverso l’azione ciclica dell’AMP (cAMP) e dell’azione della protein-chinasi cAMP-dipendente con conseguente aumento della concentrazione di ioni calcio.
Normalmente, l’attivazione del recettore 1 nel cuore aumenta il nodo senoatriale (SA) e il nodo atrioventricolare (AV) con successivo aumento della frequenza cardiaca e della contrattilità. Di conseguenza, aumenteranno anche la gittata sistolica e la gittata cardiaca. Nel rene, la renina viene rilasciata quando vengono attivate le cellule muscolari lisce nell’apparato iuxtaglomerulare. Il volume del sangue è infine aumentato a causa della produzione a valle di angiotensina II e della produzione di aldosterone innescata dalla renina. Questa risposta adrenergica si traduce in un aumento di inotropismo, cronotropismo e dromotropismo. Il blocco di questa via con il Bisoprololo provoca una diminuzione della contrattilità (inotropismo), una diminuzione della frequenza cardiaca (cronotropismo), un aumento del rilassamento (lusitropismo) e una diminuzione dei tempi di conduzione cardiaca (dromotropismo) e riduce la produzione di renina nei reni (13) (Figura 2).
Due importanti studi randomizzati, in doppio cieco, controllati con placebo e multicentrici hanno esaminato l’efficacia clinica del Bisoprololo in combinazione con ACE inibitori e diuretici in pazienti con insufficienza cardiaca cronica stabile di classe III o IV secondo la NYHA (New York Heart Association): il Cardiac Insufficiency Bisoprolol Study CIBIS (n = 641) e CIBIS II (n = 2.647). I dati hanno dimostrato che il trattamento con Bisoprololo è stato associato a riduzioni significative delle cause di mortalità (14,15). In una meta-analisi di CIBIS e CIBIS II (n = 3.288), una riduzione del 29% dell’incidenza della mortalità è stata registrata nei pazienti con insufficienza cardiaca cronica in trattamento con Bisoprololo rispetto al placebo (16).
3.2 Farmacocinetica
Il Bisoprololo è ben assorbito dopo la somministrazione orale con una biodisponibilità di circa il 90% e l’assorbimento non è influenzato dall’assunzione di cibo. Il Bisoprololo ha una farmacocinetica lineare che è indipendente dall’età. Le concentrazioni plasmatiche di picco del Bisoprololo (Cmax) vengono raggiunte entro 2-4 ore (17) e le concentrazioni allo stato stazionario vengono raggiunte entro 5 giorni dalla somministrazione. Il Bisoprololo è legato per il 30% alle proteine plasmatiche con un volume di distribuzione apparente di 3,5 L/kg (18). L’emivita plasmatica media del Bisoprololo è di circa di 10-12 ore. Il Bisoprololo viene eliminato tramite escrezione renale come farmaco invariato (50%) e tramite metabolismo epatico dal CYP3A4 come metaboliti farmacologicamente inattivi (50%). La clearance totale del Bisoprololo è 15 L/h. L’emivita di eliminazione plasmatica (t½) del Bisoprololo è prolungata nei pazienti con insufficienza renale rispetto ai soggetti sani (19).
L’emivita di eliminazione plasmatica del Bisoprololo è stata studiata sia in soggetti che in pazienti ipertesi più giovani (età media 49 anni, range di età 26-63 anni) e anziani (range di età 69-80 anni). In condizioni di stato stazionario, l’emivita di eliminazione plasmatica era sempre nell’intervallo di 10-12 ore. Questo significa che il Bisoprololo può essere somministrato una volta al giorno e questo ha un effetto positivo sulla compliance del paziente (18).
Sicurezza e tollerabilità
Gli effetti avversi comuni dei beta-bloccanti cardio-selettivi comprendono bradicardia, ridotta capacità di esercizio, ipotensione, blocco del nodo atrioventricolare e insufficienza cardiaca. Altri effetti avversi comuni includono nausea, vomito, disturbi addominali, vertigini, debolezza, mal di testa, affaticamento e secchezza delle fauci e degli occhi. Gli effetti avversi meno comuni sono la disfunzione sessuale, la perdita di memoria e la confusione. Un ulteriore rischio dei β-1 bloccanti è il mascheramento dei sintomi ipoglicemici neurogeni innescati dalle catecolamine come tremore, tachicardia e irritabilità, tutti sintomi che fungono da segnale di avvertimento del fatto che i livelli di glucosio nel sangue del paziente sono troppo bassi. La sudorazione, tuttavia, rimane smascherata e probabilmente è l’unico segno consistente di ipoglicemia negli individui trattati con -bloccanti (20).
Il Bisoprololo è controindicato nei pazienti con insufficienza cardiaca acuta o scompensata che richiede terapia inotropa per via endovenosa, shock cardiogeno, blocco atrioventricolare di secondo o terzo grado (senza pacemaker), sindrome del seno malato, blocco sinoatriale, bradicardia (frequenza cardiaca <60 bpm prima della terapia) o ipotensione (pressione sanguigna sistolica <100 mmHg). È anche controindicato nei pazienti con asma bronchiale grave o grave malattia polmonare cronica ostruttiva, malattia arteriosa periferica occlusiva in fase avanzata e sindrome di Raynaud, feocromocitoma non trattato o acidosi metabolica.
Associazioni non raccomandate, riguardano farmaci antiaritmici di classe I (ad es. disopiramide, lidocaina, fenitoina flecainide, propafenone): l’effetto sul tempo di conduzione atrio-ventricolare può essere aumentato e si può avere una diminuzione della forza di contrazione del cuore.
Calcio-antagonisti non diidropiridinici possono provocare una riduzione sulla contrattilità e conduzione atrio-ventricolare. La somministrazione endovenosa di verapamil in pazienti che sono in trattamento con beta-bloccanti può causare una forte ipotensione e un blocco atrio-ventricolare. Farmaci antiipertensivi che agiscono centralmente come clonidina possono peggiorare lo scompenso cardiaco per riduzione del tono simpatico a livello centrale, tramite diminuzione del tono simpatico centrale (riduzione della frequenza e della gittata cardiaca, vasodilatazione).
Studi clinici più rilevanti
L’efficacia clinica del Bisoprololo orale nell’insufficienza cardiaca cronica stabile è stata studiata in due grandi studi randomizzati, in doppio cieco e multicentrici (CIBIS [n = 641] e CIBIS II [n = 2.647]. I pazienti (classe NYHA III o IV) sono stati randomizzati a ricevere Bisoprololo (dosaggio iniziale di 1,25 mg/die titolato a un massimo di 5 [CIBIS] o 10 mg/die [CIBIS II]) o placebo; i pazienti ricevevano anche una terapia standard (preferibilmente un ACE-inibitore e un diuretico).
Nello studio clinico CIBIS, 641 pazienti con insufficienza cardiaca cronica di varie eziologie e una frazione di eiezione ventricolare sinistra <40% hanno ricevuto una terapia di fondo con diuretici e vasodilatatori (un inibitore dell’enzima di conversione dell’angiotensina nel 90% dei casi). Un totale di 320 pazienti è stato assegnato in maniera random al Bisoprololo e 321 al Placebo. Il follow-up medio è stato di 1,9 anni. Il Bisoprololo è stato ben tollerato senza differenza tra i gruppi nelle interruzioni premature del trattamento (82 nel gruppo Placebo, 75 nel gruppo Bisoprololo). La differenza osservata nella mortalità tra i gruppi non ha raggiunto la significatività statistica. Il Bisoprololo ha migliorato significativamente lo stato funzionale dei pazienti; meno pazienti nel gruppo Bisoprololo hanno richiesto l’ospedalizzazione per scompenso cardiaco (90 nel gruppo Placebo contro 61 nel gruppo Bisoprololo, P < 0,01), e più pazienti sono migliorati di almeno una classe funzionale della NYHA (48 nel gruppo Placebo contro 68 nel gruppo Bisoprololo, P = 0,04) alla fine del periodo di follow-up. I risultati avevano confermato che una dose progressivamente crescente di beta-bloccante nell’insufficienza cardiaca grave conferisce un beneficio funzionale.
Lo studio clinico CIBIS II ha indagato l’indicazione del Bisoprololo nell’insufficienza cardiaca: su un totale di 2.647 pazienti, dei quali l’83% (n=2.202) era in classe NYHA III, mentre il 17% (n=445) era in classe NYHA IV. I pazienti erano affetti da insufficienza cardiaca sistolica stabile e sintomatica (frazione di eiezione ≤ 35%, rilevata tramite ecocardiografia).
La mortalità per tutte le cause (endpoint primario) è stata significativamente più bassa nei destinatari del Bisoprololo che in quelli del placebo in CIBIS II (11,8 vs 17,3%), ed è stata ridotta dal Bisoprololo indipendentemente dal dosaggio. Riduzioni significative della mortalità per tutte le cause sono state osservate nei destinatari del Bisoprololo, rispetto al placebo, nel Bisoprololo a basso dosaggio 1,25, 2,5 o 3,75 mg/giorno (rischio relativo [RR] 0,64; 95% intervallo di confidenza [CI] 0,46-0,88), Bisoprololo a dose moderata 5 o 7 mg/giorno (RR 0,34; 95% CI 0,22-0,52) e Bisoprololo ad alta dose 10 mg/giorno (RR 0,63; 95% CI 0,43-0,94). La morbilità per tutte le cause era anche più bassa con il Bisoprololo rispetto al placebo nel CIBIS (16,6 vs 20,9%), anche se la differenza non ha raggiunto la significatività statistica.
In CIBIS II, il Bisoprololo ha ridotto la pressione arteriosa (PA) rispetto al basale (-4,1 ± 16,4 vs -2,3 ± 16,4 mmHg con placebo per la BP sistolica, e -2,6 ± 10,7 vs -0.9 ± 10.9 mm Hg con placebo, p <0,0001 in entrambi i casi). Non c’era alcuna relazione tra i cambiamenti di pressione sanguigna e la mortalità nel CIBIS.
È interessante notare che una pressione bassa è predittiva di un aumento della mortalità, piuttosto che il contrario, nei pazienti con insufficienza cardiaca. I risultati degli studi CIBIS e CIBIS II sono riassunti in Tabella 1.
In una meta-analisi (16) di CIBIS e CIBIS II (n = 3.288), una riduzione relativa del 29% nell’incidenza di mortalità per tutte le cause è stata vista nei destinatari del Bisoprololo rispetto al placebo. Il Bisoprololo ha ridotto la mortalità nei pazienti con insufficienza cardiaca cronica indipendentemente dall’eziologia o dalla gravità.
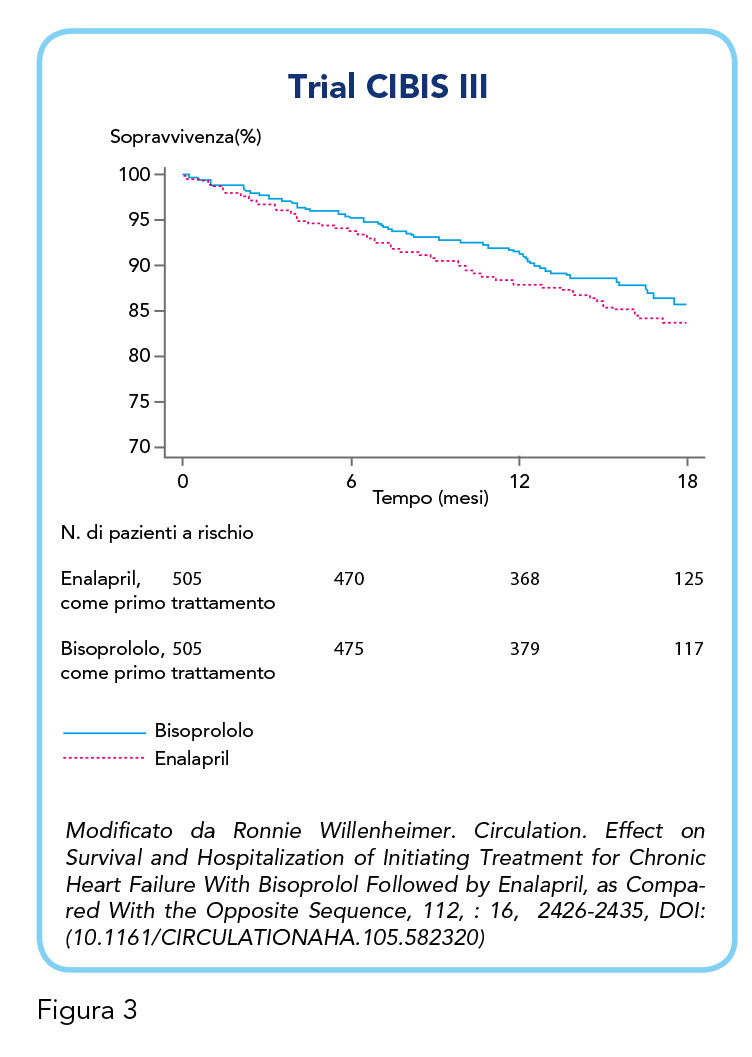
In pazienti con insufficienza cardiaca cronica, un beta-bloccante viene generalmente aggiunto a un regime contenente un inibitore dell’enzima di conversione dell’angiotensina (ACE). In base a ciò, lo studio CIBIS III aveva lo scopo di valutare se il trattamento dello scompenso cardiaco cronico con il beta-bloccante β-1 selettivo Bisoprololo (a cui viene successivamente aggiunto l’enalapril) fosse altrettanto efficace e sicuro rispetto a un regime di trattamento iniziale basato su ACE-inibitore enalapril (a cui viene successivamente aggiunto il Bisoprololo). Quindi, l’endpoint primario dello studio era dimostrare che l’inizio della terapia con Bisoprololo, seguito dalla terapia combinata con enalapril, era paragonabile all’inizio della terapia con enalapril, seguito dalla terapia combinata con Bisoprololo, per quanto riguarda la prevenzione della morte e dei ricoveri in pazienti con scompenso cardiaco cronico. CIBIS III ha dimostrato che non c’è alcuna differenza rispetto all’efficacia e alla sicurezza tra l’inizio del trattamento con Bisoprololo o enalapril in pazienti con NHYA classe II o III. Questo studio ha anche suggerito un maggiore beneficio sulla mortalità iniziando il trattamento con Bisoprololo, piuttosto che con l’enalapril (21) (Figura 3).
In conclusione, l’aggiunta del Bisoprololo, un β-1 bloccante altamente selettivo, a un regime di trattamento che comprende un ACE inibitore e un diuretico migliora significativamente la sopravvivenza nei pazienti con insufficienza cardiaca cronica stabile e riduce la necessità di ospedalizzazione. L’uso del Bisoprololo in questo disturbo è generalmente ben tollerato ed è economicamente vantaggioso. Pertanto, il Bisoprololo dovrebbe essere considerato un’opzione di trattamento standard quando si seleziona un β-bloccante da usare in combinazione con ACE-inibitori e diuretici in pazienti con insufficienza cardiaca cronica stabile, da moderata a grave (Tabella 2).
3.3 Conclusioni
I beta-bloccanti selettivi per β-1 sono usati per trattare l’ipertensione e molte altre malattie cardiache in tutto il mondo. Il Bisoprololo risulta essere efficace nel trattamento dell’ipertensione lieve-moderata e nell’insufficienza cardiaca cronica. Pertanto, è necessario prestare attenzione quando si sospende il Bisoprololo poiché può causare ipertensione di rimbalzo e, in alcuni casi, angina. Il Bisoprololo maschera l’ipoglicemia nei pazienti con diabete, quindi il personale sanitario dovrebbe essere a conoscenza di tutti gli effetti collaterali del farmaco. La tossicità da sovradosaggio accidentale del Bisoprololo è possibile anche nei pazienti con ipertensione, quindi è essenziale sapere come antagonizzare l’effetto del farmaco.
Essendo cardioselettivo grazie alla forte affinità con i recettori β-1, il Bisoprololo assicura un’ottima tollerabilità e diminuisce gli effetti avversi. Grazie alla lunga emivita, è possibile avere un’unica somministrazione giornaliera assicurando un’ottima compliance nel paziente. Avendo una clearance sia renale che epatica non impatta in modo significativo nei pazienti con ridotta capacità renale o epatica. Il Bisoprololo è associato a una riduzione altamente significativa della mortalità e dei tassi di ospedalizzazione nei pazienti con insufficienza cardiaca, grazie alla conferma dei risultati di studi controllati e randomizzati.
Bibliografia
- Mancia G, Fagard R, Narkiewicz K, et al. 2013 ESH/ESC guidelines for the management of arterial hypertension: the Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). Eur Heart J. 2013;34(28):2159-2219. doi:10.1093/eurheartj/eht151
- Taler SJ. Secondary causes of hypertension. Prim Care. 2008;35(3):489-500, vi. doi:10.1016/j.pop.2008.06.001
- Johnson RJ, Feig DI, Nakagawa T, Sanchez-Lozada LG, Rodriguez-Iturbe B. Pathogenesis of essential hypertension: historical paradigms and modern insights. J Hypertens. 2008;26(3):381-391. doi:10.1097/HJH.0b013e3282f29876
- Triposkiadis F, Karayannis G, Giamouzis G, Skoularigis J, Louridas G, Butler J. The sympathetic nervous system in heart failure physiology, pathophysiology, and clinical implications. J Am Coll Cardiol. 2009;54(19):1747-1762. doi:10.1016/j.jacc.2009.05.015
- Enocksson S, Shimizu M, Lönnqvist F, Nordenström J, Arner P. Demonstration of an in vivo functional beta 3-adrenoceptor in man. J Clin Invest. 1995;95(5):2239-2245. doi:10.1172/JCI117914
- Pathak A, Mrabeti S. -Blockade for Patients with Hypertension, Ischemic Heart Disease or Heart Failure: Where are We Now? Vasc Health Risk Manag. 2021;Volume 17:337-348. doi:10.2147/VHRM.S285907
- Fumagalli C, Maurizi N, Marchionni N, Fornasari D. -blockers: Their new life from hypertension to cancer and migraine. Pharmacol Res. 2020;151:104587. doi:10.1016/j.phrs.2019.104587
- Albouaini K, Andron M, Alahmar A, Egred M. Beta-blockers use in patients with chronic obstructive pulmonary disease and concomitant cardiovascular conditions. Int J Chron Obstruct Pulmon Dis. 2007;2(4):535-540.
- Ishiguro H, Ikeda T, Abe A, et al. Antiarrhythmic effect of bisoprolol, a highly selective beta1-blocker, in patients with paroxysmal atrial fibrillation. Int Heart J. 2008;49(3):281-293. doi:10.1536/ihj.49.281
- Lancaster SG, Sorkin EM. Bisoprolol. A preliminary review of its pharmacodynamic and pharmacokinetic properties, and therapeutic efficacy in hypertension and angina pectoris. Drugs. 1988;36(3):256-285. doi:10.2165/00003495-198836030-00002
- AIFA, Bisoprololo RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO.
- Leopold G, Ungethüm W, Pabst J, Simane Z, Bühring KU, Wiemann H. Pharmacodynamic profile of bisoprolol, a new beta 1-selective adrenoceptor antagonist. Br J Clin Pharmacol. 1986;22(3):293-300.
- Tucker WD, Sankar P, Theetha Kariyanna P. Selective Beta-1-Blockers. In: StatPearls. StatPearls Publishing; 2022. Accessed February 22, 2022. http://www.ncbi.nlm.nih.gov/books/NBK499982/
- A randomized trial of beta-blockade in heart failure. The Cardiac Insufficiency Bisoprolol Study (CIBIS). CIBIS Investigators and Committees. Circulation. 1994;90(4):1765-1773. doi:10.1161/01.cir.90.4.1765
- The Cardiac Insufficiency Bisoprolol Study II (CIBIS-II): a randomised trial. The Lancet. 1999;353(9146):9-13. doi:10.1016/S0140-6736(98)11181-9
- Leizorovicz A, Lechat P, Cucherat M, Bugnard F. Bisoprolol for the treatment of chronic heart failure: A meta-analysis on individual data of two placebo-controlled studies—CIBIS and CIBIS II. Am Heart J. 2002;143(2):301-307. doi:10.1067/mhj.2002.120768
- Leopold G. Balanced pharmacokinetics and metabolism of bisoprolol. J Cardiovasc Pharmacol. 1986;8 Suppl 11:S16-20. doi:10.1097/00005344-198511001-00003
- McGavin JK, Keating GM. Bisoprolol. Drugs. 2002;62(18): 2677-2696. doi:10.2165/00003495-200262180-00017
- Kirch W, Rose I, Demers HG, Leopold G, Pabst J, Ohnhaus EE. Pharmacokinetics of bisoprolol during repeated oral administration to healthy volunteers and patients with kidney or liver disease. Clin Pharmacokinet. 1987;13(2):110-117. doi:10.2165/00003088-198713020-00003
- White JR, Campbell RK. Dangerous and common drug interactions in patients with diabetes mellitus. Endocrinol Metab Clin North Am. 2000;29(4):789-802. doi:10.1016/s0889-8529(05)70164-x
- Willenheimer R, van Veldhuisen DJ, Silke B, et al. Effect on survival and hospitalization of initiating treatment for chronic heart failure with bisoprolol followed by enalapril, as compared with the opposite sequence: results of the randomized Cardiac Insufficiency Bisoprolol Study (CIBIS) III. Circulation. 2005;112(16):2426-2435. doi:10.1161/CIRCULATIONAHA.105.582320
Related papers
La pubblicazione recente di alcuni lavori scientifici basati sulle risultanze di alcuni osservatori epidemiologi mondiali, ha riportato alla ribalta il ruolo chiave delle malattie cardiovascolari come prima causa di morte e disabilità, non solo nel presente, ma anche nel futuro proiettato oggi al 2050 con un incremento più o meno equamente distribuito tra le malattie [more info]
1) Lipoproteine ed aterosclerosi Le lipoproteine sono particelle composte da un nucleo ricco in esteri del colesterolo e trigliceridi (TG) circondati da colesterolo libero, fosfolipidi e apolipoproteine. Le lipoproteine plasmatiche vengono suddivise in varie classi (VLDL, IDL, LDL, HDL e chilomicroni) in base alle dimensioni, alla composizione lipidica e alle apolipoproteine presenti (Tabella 1). I [more info]
Introduzione Le malattie cardiovascolari rappresentano la principale causa di morbilità e mortalità a livello globale, nonostante i progressi nella prevenzione e nel trattamento farmacologico. In questo contesto, l’adozione di strategie terapeutiche efficaci per la gestione dei fattori di rischio cardiovascolare è fondamentale. La combinazione farmacologica di farmaci con meccanismi d’azione complementari è diventata una pratica [more info]