1. Sistema Renina-Angiotensina-Aldosterone (SRAA) e ipertensione
Il Sistema Renina-Angiotensina-Aldosterone (SRAA) è un meccanismo ormonale di vitale importanza per la regolazione della pressione sanguigna e l’omeostasi idroelettrolitica. Il sistema viene innescato dalla secrezione dell’enzima renina, prodotto dai reni in risposta a stimoli quali ridotta pressione sanguigna, ipovolemia o scarsità di sodio (1). Al suo rilascio, consegue una reazione a catena che conduce alla produzione di angiotensina II ad opera dell’enzima di conversione dell’angiotensina (ACE), presente nelle cellule endoteliali dei piccoli e grandi vasi. Angiotensina II è un potente vasocostrittore, attiva il sistema simpatico e stimola la secrezione surrenalica di aldosterone con conseguente ritenzione di sodio (1). L’angiotensina II può essere sia circolante che tissutale e si lega a due tipi di recettore definiti recettore dell’angiotensina II di tipo 1 e 2 (AT1 e AT2). Dei due, AT1 – localizzato in tessuti quali muscolatura liscia, cuore, reni, aorta, cervello, adipociti e placenta – è il principale responsabile dell’aumento della pressione sanguigna (3). Al contrario, AT2 controbilancia AT1 favorendo la vasodilatazione, ma la sua espressione sembra essere limitata allo sviluppo fetale o in particolari condizioni di stress, e non è ancora ben chiaro come funzioni l’equilibrio tra l’azione di questi due recettori (4,5). Fondamentale è anche l’azione dell’aldosterone, ormone terminale del SRAA, che regola l’equilibrio dei liquidi corporei e di vari elettroliti, tra cui sodio e potassio (1). Il SRAA regola dunque la pressione sanguigna, mantiene la tonicità vascolare e l’omeostasi idroelettrolitica corporea fondamentale per un corretto funzionamento di cuore e reni, senza rispettivi sovraccarichi (2). Tuttavia, la sua attivazione cronica, in molteplici patologie, comporta svariati effetti negativi, soprattutto a livello cardiovascolare.
L’iperattivazione del SRAA ha un’azione fortemente vasocostrittiva, ipertrofica, pro-fibrotica e pro-infiammatoria, a livello della muscolatura liscia, e conduce all’ipertensione sistemica e al rimodellamento dei tessuti cardiovascolari e renali. Inoltre favorisce l’insorgenza e la progressione del danno cardiovascolare in patologie quali ipertensione, infarto miocardico acuto e insufficienza cardiaca cronica. L’attivazione cronica del SRAA è anche coinvolta nello sviluppo di malattie renali croniche, complicazioni epatiche (alimentate dall’azione pro-infiammatoria), obesità (per l’azione sugli adipociti), diabete e disturbi del sistema nervoso (2). Di fatto, la disregolazione del SRAA alimenta il rischio cardiovascolare e di danno d’organo a cui conseguono eventi clinici anche fatali. Per questa ragione, sono molti i farmaci ideati per agire sull’iperattivazione del SRAA: gli ACE-inibitori impediscono la conversione di angiotensina I in angiotensina II; i sartani bloccano il legame dell’angiotensina II al suo recettore AT1 (per questo noti in inglese come ARBs, Angiotensin II Receptor Blockers); e, infine, gli antagonisti dei recettori dei mineralcorticoidi agiscono a valle, frenando le conseguenze dell’azione dell’aldosterone.
2. Farmaci antipertensivi: antagonisti del recettore dell’angiotensina II o sartani
Il primo antagonista del recettore dell’angiotensina II ad essere approvato è stato Losartan, poi seguito da diversi altri quali Valsartan, Olmesartan, Irbesartan e Candesartan. Come anche gli ACE-inibitori, questi farmaci vengono assunti per via orale ma le differenze nella loro struttura molecolare si traduce in una diversa affinità di legame al recettore e in differenti profili farmacocinetici. I sartani si legano al recettore AT1 impedendo l’interazione con il ligando naturale e riducendo la pressione sanguigna attraverso il rilasciamento della muscolatura liscia dei vasi, l’escrezione di sale e acqua e la riduzione del volume del plasma (6). Nella loro azione antipertensiva, i sartani non alterano gittata e frequenza cardiaca e, nonostante l’abbassamento della pressione, non sembrano indurre ipotensione posturale (3). La dissociazione dal recettore è molto lenta, fattore da tenere in considerazione nella farmacocinetica del principio attivo (7). La maggior parte dei sartani commercialmente disponibili controlla la pressione sanguigna sulle 24 ore anche con una singola somministrazione giornaliera, senza alterare il ritmo circadiano, e la loro efficacia persiste nei trattamenti a lungo termine, senza evidenze di tachifilassi (6). I sartani apportano svariati benefici cardiovascolari tra cui: 1) riduzione dell’ipertrofia ventricolare sinistra, 2) miglioramento della funzione diastolica, 3) riduzione della dispersione anomala del QT nell’elettrocardiogramma, 4) miglioramento della disfunzione endoteliale e 5) miglioramento della capacitanza delle grandi arterie (6). I sartani sono infatti raccomandati nei pazienti con scompenso cardiaco e frazione di eiezione ridotta intolleranti agli ACE-inibitori. Lo studio Val-HeFT ha mostrato come l’aggiunta di Valsartan alla terapia standard riducesse le ospedalizzazioni per scompenso e, nello studio CHARM-Alternative, Candesartan ha ridotto sia le ospedalizzazioni per scompenso che la mortalità cardiovascolare. L’unico dei sartani ad essere impiegato nella gestione dei pazienti che hanno subito un recente infarto del miocardio è Valsartan, che nello studio VALIANT ha dimostrato un’efficacia sovrapponibile a quella di un ACE-inibitore.
I sartani sono stati sviluppati per superare alcuni limiti del meccanismo d’azione degli ACE-inibitori, che infatti modulano la produzione di angiotensina II, impedendo la conversione da angiotensina I, ma falliscono nel sopprimerne la produzione da parte di vie enzimatiche alternative (3). Inoltre, gli ACE-inibitori sono causa di un aumento della concentrazione plasmatica di bradichinina, fattore correlato ad alcuni degli effetti collaterali tipici quali tosse secca e rischio di angioedema. Quest’ultima è una reazione rara, ma comunque pericolosa, che può manifestarsi nelle prime settimane di terapia. Rispetto agli ACE-inibitori, i sartani agiscono più a valle e sono associati ad un minor rischio – ma non nullo – di tosse secca e angioedema (7). L’efficacia dei sartani è pari a quella degli ACE-inibitori nel trattamento contro l’ipertensione, sia moderata che severa, e cresce all’aumentare della dose. A inizio terapia, i sartani possono apparire meno efficaci degli ACE-inibitori, in cui però il rischio di ipotensione iniziale è maggiore (7).
Gli antagonisti del recettore dell’angiotensina II sono generalmente farmaci ben tollerati: non compromettono la regolazione del flusso ematico cerebrale, il metabolismo del glucosio o dei lipidi, non provocano alterazioni clinicamente significative delle misure di laboratorio di chimica del siero, ematologia e analisi delle urine (6). Il trattamento con sartani prevede l’impiego di una dose iniziale che va poi titolata a raggiungimento della dose target o del massimo dosaggio tollerato. Il loro utilizzo richiede attenzione nei pazienti affetti da malattia renale cronica e insufficienza cardiaca, o diabete, e che ricevono diuretici risparmiatori di potassio o integratori di potassio, poiché possono causare iperkaliemia (7). Nei pazienti trattati con sartani da lungo tempo, è importante considerare che l’interruzione brusca della terapia può causare un improvviso aumento della pressione. Alcuni effetti collaterali comuni sono mal di testa, vertigine, astenia e infiammazione delle vie respiratorie superiori (5). I sartani sono infine sconsigliati in gravidanza a causa della loro tossicità fetale.
3. Olmesartan
3.1 Indicazioni e posologia
Olmesartan medoxomil, sviluppato all’inizio degli anni ’90 e in uso da circa un decennio dopo (8) (Figura 1), appartiene alla famiglia degli antagonisti del recettore AT1. Questi inibiscono l’azione sul sistema SRAA, che ha un ruolo cruciale nella patogenesi dell’ipertensione (9,10). Olmesartan medoxomil è un profarmaco rapidamente convertito in Olmesartan che ne è il metabolita farmacologicamente attivo. La caratteristica principale di Olmesartan è che si lega al recettore AT1, ma non ad AT2, con un grado di selettività e di affinità più alto di molti degli altri sartani (8). Agendo sul SRAA, Olmesartan svolge un ruolo importante nell’emostasi e nella regolazione delle funzioni cardiache, vascolari e renali. Nello specifico, tra gli effetti fisiologici principali di Olmesartan vanno annoverati la riduzione della pressione sanguigna – cui controllo è sostenuto durante l’intervallo di dosaggio di 24 ore, comprese le ultime 4 ore di questo periodo (9) −, la riduzione dei livelli di aldosterone, la riduzione dell’attività cardiaca e una maggiore escrezione di sodio. Oltre che essere comunemente usato per la gestione dell’ipertensione, Olmesartan è anche indicato nel trattamento della nefropatia associata al diabete di tipo 2, in particolare nei pazienti che non sono in grado di tollerare gli ACE-inibitori, rallentandone la progressione grazie ai suoi effetti nefroprotettivi (9). Diversi studi clinici hanno dimostrato la migliore efficacia di Olmesartan − in monoterapia − rispetto a Losartan, e un’uguale efficacia rispetto a Valsartan, con un inizio d’azione più rapido di altri sartani in termini di riduzioni dal basale della pressione diastolica e, nella maggior parte dei casi, della pressione sistolica (9).
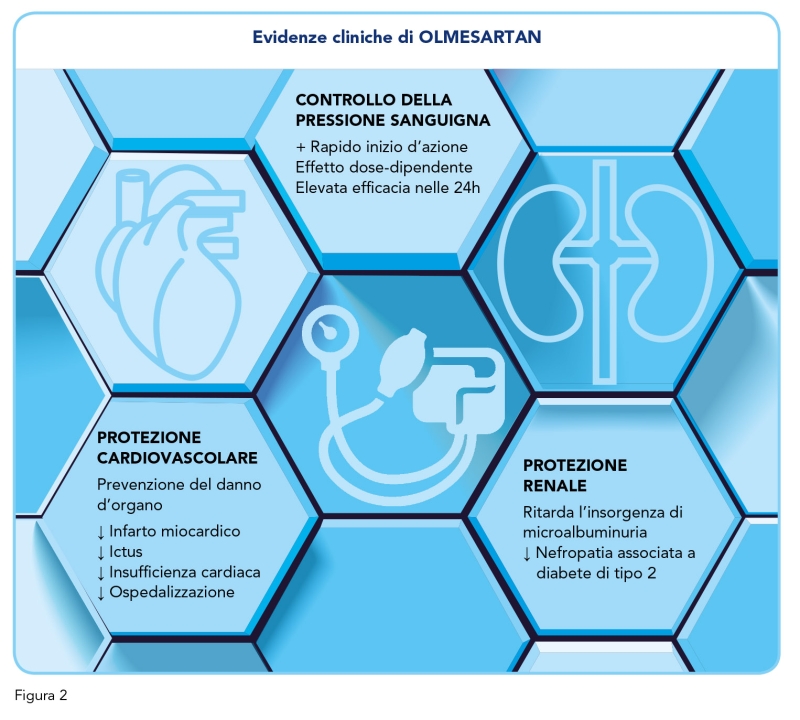
La terapia di combinazione con Olmesartan più idroclorotiazide (un diuretico) è altrettanto efficace di quella con Losartan più idroclorotiazide (9). Ad ogni modo, l’efficacia antipertensiva costante durante l’intero intervallo di dosaggio di 24 ore – compreso il periodo ad alto rischio del mattino/risveglio – rende Olmesartan una valida opzione per il trattamento dei pazienti adulti con ipertensione, compresi gli anziani (9). Olmesartan ha un effetto protettivo a livello cardiovascolare, compresa la riduzione del rischio di infarto del miocardio, di ictus, di progressione dell’insufficienza cardiaca e di ospedalizzazione (Figura 2).
Come tutti i sartani, Olmesartan si somministra oralmente e si raccomanda, per una migliore aderenza al trattamento, l’assunzione approssimativamente alla stessa ora ogni giorno, indipendentemente se a digiuno o a stomaco pieno. Olmesartan è indicato per il trattamento dell’ipertensione arteriosa essenziale negli adulti, e per il trattamento dell’ipertensione nei bambini e negli adolescenti di età compresa tra 6 e 18 anni. Come da raccomandazioni dell’Agenzia del Farmaco Italiana (AIFA), negli adulti la dose iniziale consigliata è di 10 mg una volta al giorno. Se questo dosaggio non riesce a garantire un adeguato controllo pressorio, la dose può essere aumentata a 20 mg una volta al giorno come dose ottimale. Nell’eventualità in cui sia richiesta un’ulteriore riduzione dei valori pressori, la dose può essere aumentata fino a un massimo di 40 mg al giorno o può essere associata a terapia con idroclorotiazide. Quando è necessario pianificare un aggiustamento posologico, qualunque sia la tipologia del paziente, bisogna tenere in considerazione che l’effetto antipertensivo viene raggiunto entro circa 2 settimane dall’inizio del trattamento, mentre sono necessarie circa 8 settimane per raggiungere il livello massimo. In generale, non sono necessari aggiustamenti posologici negli anziani (≥ 65 anni), e comunque si applicano gli stessi accorgimenti posologici dei pazienti con compromissione renale. Nel caso fosse necessaria la somministrazione della dose massima di 40 mg al giorno, si raccomanda di monitorare attentamente la pressione arteriosa. A causa della limitata esperienza clinica con dosaggi maggiori, nei pazienti con compromissione renale lieve o moderata (clearance della creatinina compresa tra 20 e 60 ml/min) si raccomanda un dosaggio massimo di Olmesartan di 20 mg una volta al giorno, mentre non è raccomandato nei pazienti con grave compromissione renale (clearance della creatinina < 20 ml/min).
Nei pazienti con compromissione epatica lieve, non sono necessari aggiustamenti posologici; in quelli con compromissione epatica moderata la dose iniziale raccomandata è di 10 mg una volta al giorno e la dose massima non deve superare i 20 mg una volta al giorno; in quelli con compromissione epatica che assumono diuretici e/o altri farmaci antipertensivi si consiglia un attento monitoraggio della pressione arteriosa e della funzionalità renale; nei pazienti con grave compromissione della funzionalità epatica, invece, l’uso di Olmesartan non è raccomandato a causa della scarsa esperienza clinica con questi pazienti; infine, Olmesartan non deve essere utilizzato in pazienti con ostruzione biliare.
Nella popolazione pediatrica di età compresa tra 6 e 18 anni, la dose iniziale raccomandata è di 10 mg una volta al giorno. In bambini la cui pressione arteriosa non riesce a essere adeguatamente controllata con tale dose, questa può essere aumentata a 20 mg una volta al giorno. Nel caso in cui fosse necessario una ulteriore riduzione della pressione arteriosa, nei bambini di peso ≥ 35 kg la dose può essere aumentata fino a un massimo di 40 mg, mentre nei bambini di peso < 35 kg non è raccomandato un aggiustamento e quindi la dose non deve essere superiore a 20 mg. Infine, per quanto riguarda i bambini di età compresa tra 1 e 5 anni, ma anche quelli al di sotto di 1 anno di età, la sicurezza e l’efficacia di Olmesartan non sono state stabilite e quindi, a causa degli scarsi dati a disposizione, non esiste ancora alcuna raccomandazione sulla posologia.
L’utilizzo di Olmesartan non è raccomandato durante il primo trimestre di gravidanza ed è controindicato durante il secondo e il terzo trimestre di gravidanza. Ci sono evidenze che Olmesartan è escreto nel latte materno degli animali da laboratorio, ma non sono disponibili dati in merito al latte umano e di conseguenza non è raccomandato.
3.2 Meccanismo d’azione
Come menzionato prima, Olmesartan, un sartano non peptidico, si lega con alta selettività ai recettori AT1 e blocca il legame dell’angiotensina II, che gioca un ruolo cruciale nella regolazione della pressione sanguigna e dell’equilibrio elettrolitico, ma non si lega al recettore di tipo 2 (AT2). Così facendo, Olmesartan antagonizza in maniera dose-dipendente le contrazioni indotte dall’angiotensina II nel tessuto aortico e inibisce la risposta pressoria all’angiotensina II (11). Detto altrimenti, Olmesartan blocca gli effetti vasocostrittori dell’angiotensina II bloccandone selettivamente il legame al recettore AT1 nella muscolatura liscia vascolare. La sua azione è, quindi, indipendente dalle vie di sintesi dell’angiotensina II. Nel complesso, gli effetti fisiologici di Olmesartan portano a una riduzione della pressione sanguigna, a livelli più bassi di aldosterone, a una ridotta attività cardiaca e a una maggiore escrezione di sodio. Olmesartan ha effetti sul SRAA che svolge un ruolo importante nell’emostasi e nella regolazione delle funzioni renali, vascolari e cardiache. Il blocco farmacologico del SRAA attraverso il blocco del recettore AT1 inibisce il feedback regolatorio negativo all’interno del SRAA, fattore che contribuisce alla patogenesi e alla progressione delle malattie cardiovascolari, dell’insufficienza cardiaca e della malattia renale. In particolare, l’insufficienza cardiaca è associata all’attivazione cronica del SRAA, che porta alla ritenzione inappropriata di liquidi, alla vasocostrizione e, infine, a un ulteriore declino della funzione ventricolare sinistra. È stato dimostrato inoltre che i sartani hanno un effetto protettivo sul cuore migliorando la funzione cardiaca, riducendo il postcarico, aumentando la portata cardiaca e prevenendo l’ipertrofia ventricolare e il rimodellamento. Infine, Olmesartan riduce o inverte lo sviluppo di un numero di indicatori di danno agli organi bersaglio, e queste azioni sembrano essere parzialmente indipendenti dagli effetti del farmaco nel ridurre la pressione arteriosa (9).
3.3 Farmacocinetica
Olmesartan (medoxomil) si somministra oralmente ed è completamente metabolizzato – metabolismo di primo passaggio − nella sua forma attiva Olmesartan dalle esterasi della mucosa gastrointestinale, del sistema circolatorio portale e del fegato dopo essere stato assorbito dal tratto gastrointestinale (12). La biodisponibilità assoluta dopo una singola dose orale di Olmesartan (20mg) in soggetti sani è del 25,6%−26% (13), e tale biodisponibilità non è influenzata dall’assunzione di cibo. In seguito all’assorbimento, Olmesartan non è ulteriormente metabolizzato (13) e non vi è traccia di Olmesartan intatto nel plasma o negli escreti. Il picco medio di concentrazione plasmatica (0,22−2,1 mg/L) viene raggiunto in media entro circa 1−3 ore dalla somministrazione e la concentrazione plasmatica aumenta in modo approssimativamente lineare all’aumentare della monodose fino a circa 80 mg (14,15).
Olmesartan è altamente legato alle proteine plasmatiche (≥ 99%), ma il potenziale per interazioni di spostamento del legame proteico clinicamente significative tra Olmesartan e altri farmaci co-somministrati altamente legati è basso. Il legame di Olmesartan con le cellule ematiche è trascurabile. Il volume di distribuzione medio dopo somministrazione endovenosa è di limitata entità (16−29 L). La clearance plasmatica totale è pari a 1,3 L/h (CV 19%), relativamente ridotta se confrontata al flusso epatico (circa 90 L/h). La principale via di eliminazione di Olmesartan è nella forma invariata attraverso le feci (~60%) (16). Dopo assunzione singola, dalla dose sistemicamente biodisponibile, circa il 10-16% viene eliminato nelle urine (in gran parte entro le 24 ore successive alla somministrazione) (14,15). In base a una biodisponibilità sistemica del 25,6%, è possibile calcolare quanto Olmesartan assorbito viene eliminato per escrezione renale (~40%) e epatobiliare (~60%). Poiché una grande quantità di Olmesartan è eliminata per via biliare, l’uso in pazienti con ostruzione biliare e controindicato. L’emivita di eliminazione terminale di Olmesartan varia tra le 10 e le 15 ore dopo somministrazioni ripetute per via orale. Lo stato di equilibrio viene raggiunto dopo le prime 3−5 somministrazioni e nessun ulteriore accumulo viene rilevato dopo 14 giorni di somministrazione ripetuta. La clearance renale risulta essere di circa 0,5−0,7 L/h ed è indipendente dalla dose. Infine, non sono state osservate differenze clinicamente rilevanti nella farmacocinetica di Olmesartan dipendenti dal sesso del paziente (14,15).
3.4 Sicurezza e tollerabilità
Nei casi di ipertensione, Olmesartan determina una riduzione a lungo termine, dose-dipendente, della pressione arteriosa. Non sono riportati casi di ipotensione dopo la prima somministrazione, di tachifilassi nel corso di trattamenti prolungati o di ipertensione da rebound all’interruzione della terapia. La somministrazione monodose giornaliera assicura un’efficace e costante riduzione della pressione arteriosa nelle 24 ore di intervallo tra una dose e quella successiva, e lo stesso vale a parità di dosaggio complessivo. Con un trattamento continuato, la riduzione massima della pressione arteriosa viene raggiunta entro le 8 settimane successive all’inizio della terapia, sebbene una sostanziale diminuzione della pressione arteriosa venga già osservata dopo 2 settimane di trattamento. Se utilizzato in associazione con idroclorotiazide, si registra un’ulteriore diminuzione della pressione arteriosa e la co-somministrazione è ben tollerata. Le reazioni avverse più comunemente segnalate (sia pur assai poco frequenti) durante il trattamento con Olmesartan sono la cefalea (7,7%), i sintomi simil-influenzali (4,0%) e i capogiri (3,7%).
Numerosi studi clinici e più recenti metanalisi hanno confermato l’efficacia antipertensiva e il buon profilo di tollerabilità di Olmesartan, sia in monoterapia che in combinazione con idroclorotiazide (9,15,17–21). In particolare, è stato dimostrato che Olmesartan viene generalmente ben tollerato, fino a 24 settimane, nei pazienti con ipertensione o con ipertensione sistolica isolata. Il verificarsi di eventi avversi nei pazienti trattati con Olmesartan risulta simile a quella dei pazienti trattati con placebo (42,2% e 42,7%, rispettivamente) (18). Tra i più comuni eventi avversi riportati in entrambi i gruppi, vanno menzionati mal di testa, infezioni del tratto respiratorio superiore e sintomi simil-influenzali. L’iperglicemia è stata rilevata più comunemente nei pazienti trattati con placebo che in quelli trattati con Olmesartan (2,7% vs 1.3%; p = 0,02) mentre, viceversa, le vertigini erano più comuni nel gruppo trattato con Olmesartan che nel gruppo trattato con placebo (2,8% vs 0,9%; p = 0,01). Invero, un altro studio ha invece rilevato un uguale tasso di vertigini nel gruppo Olmesartan e nel gruppo placebo, come anche per altri sartani, inclusi il Losartan e il Valsartan (19). È quindi possibile affermare che Olmesartan sia generalmente ben tollerato nei pazienti ipertesi e che gli eventi avversi emergenti dal trattamento sono generalmente di natura e frequenza simili a quelli che si verificano nei destinatari del placebo e sono di lieve intensità, transitori, senza alcuna relazione dose-risposta. L’unico evento avverso che si è verificato con una frequenza > 1% dei pazienti e con una maggiore incidenza nella monoterapia con Olmesartan rispetto al gruppo placebo è stato il capogiro.
Il profilo di sicurezza complessivo di Olmesartan nei pazienti pediatrici non differisce significativamente dal profilo di sicurezza negli adulti, anche se epistassi, capogiri e cefalea sono riportati più frequentemente.
3.5 Studi clinici più rilevanti
• Lo studio ESPORT (2010) (22): Olmesartan è efficace e sicuro nei pazienti anziani con ipertensione essenziale da lieve a moderata
Considerando che lo sviluppo e la progressione dell’ipertensione essenziale ha una prevalenza di ben oltre il 50% in donne e uomini al di sopra dei 65 anni, il gruppo di studio italiano multicentrico ESPORT (22) ha reclutato un totale di n = 1.998 pazienti ipertesi di età compresa tra i 65 e gli 89 anni, per valutare l’efficacia e la sicurezza di Olmesartan in confronto agli ACE-inibitori. Lo studio, randomizzato, in doppio cieco, a gruppi paralleli, consisteva in un periodo di wash-out di 2 settimane con placebo, seguito da 12 settimane di trattamento con Olmesartan o di un ACE-inibitore alle dosi iniziali di 10 mg o 2,5 mg somministrate una volta al giorno (tra le 9:00 e le 11:00). Dopo le prime 2 e 6 settimane di trattamento attivo, la dose del farmaco è stata raddoppiata se la pressione sistolica era ≥ 140 mmHg o se la pressione diastolica era ≥ 90 mmHg nei pazienti non diabetici, e se la pressione sistolica era ≥ 130 mmHg o se la pressione diastolica era ≥ 80 mmHg nei pazienti diabetici, fino a un massimo di 40 mg per Olmesartan e 10 mg per ACE-inibitore. A ogni visita sono stati effettuati l’esame fisico e la misurazione della pressione sanguigna e della frequenza cardiaca, mentre un ecocardiogramma (ECG) e campioni di sangue sono stati prelevati alla randomizzazione e alle visite finali.
Il risultato primario emerso è che, al momento della valutazione finale (12 settimane dopo la randomizzazione), la riduzione media della pressione sistolica da seduti in ufficio, aggiustata al basale, ottenuta con Olmesartan era significativamente maggiore, nei pazienti di 65−69 anni, di quella osservata con l’ACE-inibitore (17,8 vs 15,7; p = 0,01), e lo stesso valeva per la pressione diastolica (9,2 vs 7,7; p = 0,01). Nei pazienti più anziani (≥ 70) una riduzione significativa a opera di Olmesartan è stata rilevata solo nella pressione diastolica. Olmesartan, inoltre, ha indotto un più elevato tasso di normalizzazione della pressione, e anche la riduzione della pressione media nelle 24 ore era maggiore rispetto all’ACE-inibitore. La proporzione di pazienti con eventi avversi correlati al farmaco è risultata essere comparabile nei due gruppi (3,6% vs 3,6%), così come il numero di pazienti che hanno interrotto il farmaco in studio a causa di un effetto collaterale (14 vs 19).
Una recente analisi osservazionale (23) su un campione di 156.682 pazienti ipertesi provenienti da 20 studi diversi ha valutato la sicurezza di Olmesartan monitorando le reazioni avverse al farmaco. In generale, il 43,8% dei pazienti ha ricevuto Olmesartan in monoterapia, il 29% Olmesartan con idroclorotiazide e il 27,2% Olmesartan in combinazione con altri antipertensivi. Olmesartan è risultato essere molto ben tollerato e gli eventi avversi erano comparabili nei pazienti < 65 anni e nei pazienti ≥ 65 anni. Inoltre, i tassi di risposta a Olmesartan erano alti, anche se gli obiettivi di pressione sanguigna sono stati raggiunti solo in una minoranza di pazienti ad alto rischio, con disfunzione renale o che assumevano farmaci antinfiammatori non steroidei (FANS).
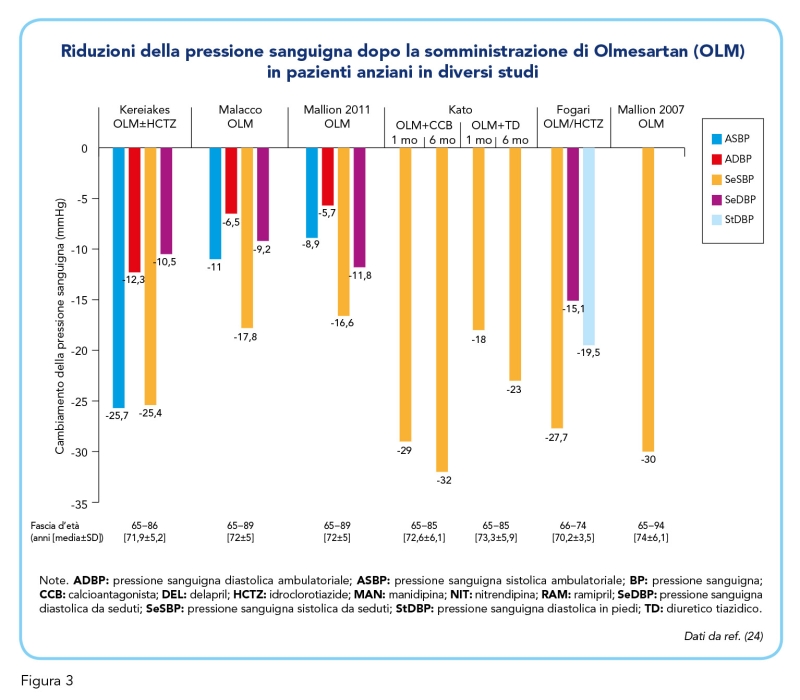
Infine, la Figura 3 mostra una panoramica delle principali evidenze cliniche degli ultimi anni a supporto dell’uso della terapia a lungo termine a base di Olmesartan nei pazienti anziani con ipertensione, rielaborata da un articolo di revisione ancora più recente (24).
• Olmesartan è efficace nel controllare la pressione nelle 24 ore, in particolare nelle ultime 6 ore dall’assunzione del farmaco e durante il risveglio, quando il rischio di eventi cardiovascolari è più alto
Nei pazienti ipertesi, e in particolare negli anziani, il mantenimento del controllo della pressione arteriosa per l’intero arco della giornata è fondamentale al fine di evitare una pressione eccessivamente elevata durante la notte e al risveglio (picco mattutino), quando il rischio di eventi cardiovascolari è molto elevato (25).
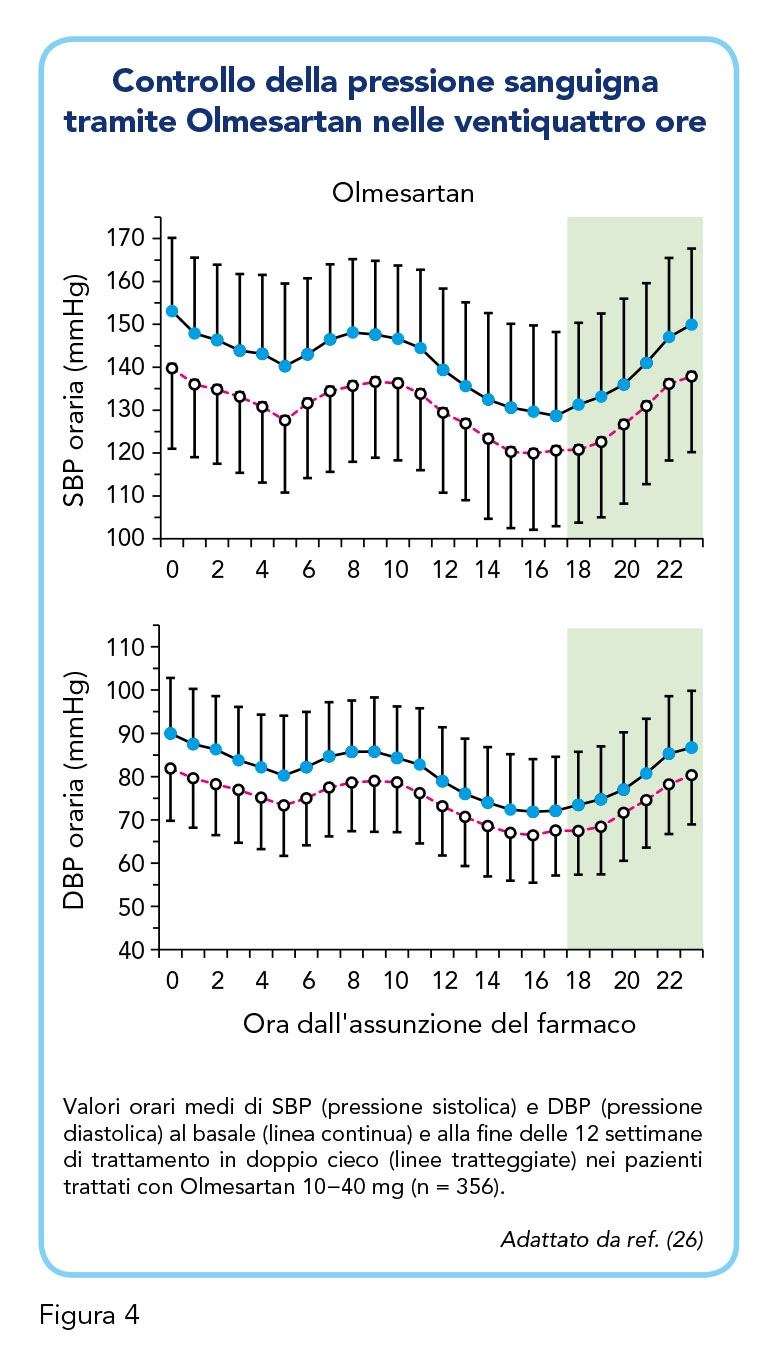
La scelta di agenti antipertensivi a lunga durata d’azione, e che forniscono un controllo costante durante un intervallo di dosaggio di 24 ore, è quindi particolarmente importante in questa categoria di età ad alto rischio, ancor più che nei giovani pazienti ipertesi. Il monitoraggio ambulatoriale della pressione sanguigna, effettuato attraverso un dispositivo oscillometrico convalidato, è necessario per verificare se tale controllo della pressione è raggiunto nelle 24 ore (26). Rispetto agli altri sartani, Olmesartan, sia esso somministrato in monoterapia che in associazione ad altri farmaci, risulta avere un’efficacia superiore agli altri farmaci (ad esempio gli ACE-inibitori) in termini di controllo della pressione sanguigna nelle 24 ore, e in particolare nelle ultime 6 ore dall’assunzione del farmaco e durante il risveglio (picco mattutino) dove il rischio di eventi cardiovascolari è più alto (Figura 4). È importante notare come questo risultato sia emerso in particolare nei pazienti anziani ipertesi, a riprova dell’efficacia generale di Olmesartan in questa popolazione, come menzionato in precedenza. Olmesartan, inoltre, si è rivelato superiore in efficacia ad altri trattamenti in pazienti ipertesi sostenuti che presentavano il verificarsi concomitante di un’elevata pressione sanguigna sia da ufficio (pressione sistolica ≥ 140 mmHg e/o pressione diastolica ≥ 90 mmHg) che ambulatoriale (24 ore: pressione sistolica ≥ 130 mmHg e/o pressione diastolica ≥ 80 mmHg) (26,27). Dopo 8 settimane di trattamento, è emerso che Olmesartan riduce significativamente, dal basale, la pressione diastolica media ambulatoriale di 24 ore (di 11,2 mmHg) e la pressione sistolica media ambulatoriale (di 14,6 mmHg), la pressione diastolica diurna (di 11,8 mmHg) e la pressione sistolica diurna (di 15,0 mmHg), e la pressione diastolica notturna (di 9,7 mmHg) e la pressione sistolica notturna (di 13,7 mmHg). L’efficacia superiore di Olmesartan nell’attività antipertensiva, in aggiunta alla comprovata maggiore sicurezza e a bassi tassi di interruzione sono fondamentali per considerare Olmesartan come un utile agente antipertensivo non soltanto nei pazienti anziani ma anche in altre categorie a rischio (e.g. pazienti diabetici e pazienti con sindrome metabolica) (27).
Questa capacità di controllare in modo robusto ed efficace la pressione nelle 24 ore, sia di giorno che di notte che nei periodi di intervallo di fine dosaggio, sarebbe da attribuirsi alla maggiore selettività ed efficacia, rispetto agli altri sartani, di Olmesartan nel bloccare i recettori AT1 in maniera dose-dipendente (28), che si accompagna a un aumento delle concentrazioni di renina e angiotensina II nel plasma (16).
• Gli studi ROADMAP e ROADMAP-OFU (2011-2014) (29,30): Olmesartan ritarda lo sviluppo della microalbuminuria, un marker importante sia di nefropatia diabetica che di mortalità da eventi cardiovascolari
L’ipertensione rappresenta, per i pazienti con diabete mellito, un importante fattore di rischio di malattie cardiovascolari e nefropatia. Tra i pazienti con diabete, infatti, quelli con ipertensione hanno un rischio maggiore di sviluppare sia malattie cardiovascolari che malattia renale, rispetto a quelli senza ipertensione (31). Il primo segno clinico della nefropatia diabetica, responsabile della maggior parte delle malattie renali allo stadio finale in molti paesi (29,32), è la comparsa di albumina nelle urine – albuminuria −, e il suo progressivo peggioramento è associato a significativi aumenti del tasso di mortalità, in particolare per eventi cardiovascolari. Di conseguenza, la microalbuminuria costituisce un fattore di rischio anche per la morbilità e la mortalità cardiovascolare. È stato suggerito che questa stretta relazione tra microalbuminuria e malattia cardiovascolare rifletta un disturbo vascolare generalizzato con aumento della permeabilità vascolare e disfunzione delle cellule endoteliali (29,32). Lo studio multicentrico Randomised Olmesartan And Diabetes Microalbuminuria Prevention (ROADMAP) è uno studio di prevenzione primaria progettato per determinare se Olmesartan possa prevenire lo sviluppo iniziale della microalbuminuria e se, a sua volta, la prevenzione della microalbuminuria possa proteggere dalle complicazioni cardiovascolari e renali. In questo studio di fase III, randomizzato, in doppio cieco e a gruppi paralleli, sono stati inclusi quasi 4.500 pazienti con diabete mellito di tipo 2 con almeno un fattore di rischio cardiovascolare e normoalbuminuria. In particolare, nell’arco di circa 3,2 anni, sono stati confrontati due gruppi di cui uno ha ricevuto una dose giornaliera di 40 mg di Olmesartan e l’altro una dose giornaliera di placebo (un ulteriore farmaco antipertensivo non-RAS che ha permesso ai pazienti di raggiungere l’obiettivo pressione sanguigna di < 130/80 mmHg, in linea con le raccomandazioni dell’epoca) (29,32). Lo studio ROADMAP ha dimostrato che il trattamento con Olmesartan ritardava significativamente (del 23%) il tempo di insorgenza della microalbuminuria a fronte di un ottimo controllo della pressione sanguigna in entrambi i gruppi di studio. Questo risultato è stato interpretato come un effetto di Olmesartan nel diminuire la resistenza vascolare intrarenale e nell’aumentare la perfusione renale nonostante una significativa riduzione della pressione sanguigna (29,32).
Successivamente, lo studio longitudinale di follow-up osservazionale (ROADMAP-OFU) (30), ha valutato se il trattamento prolungato con Olmesartan durante lo studio ROADMAP avesse indotto effetti benefici sostenuti (legacy). Quasi 1.800 pazienti dello studio ROADMAP originale sono stati visitati in due ulteriori momenti: in media 2,3 anni (fascia: 1,4−5,1 anni) e 3,3 anni (fascia: 2,1−6,7 anni) dopo l’ultima visita ROADMAP. I parametri misurati includevano la microalbuminuria, morbilità e mortalità cardiovascolare e cerebrovascolare, la mortalità totale, la malattia renale, la retinopatia diabetica e altri segni vitali. La microalbuminuria è stata diagnosticata in circa il 20%−25% dei pazienti dopo la fine dello studio ROADMAP. Fino al terzo anno di follow-up la prevalenza di microalbuminuria era più bassa nel gruppo che era stato trattato con Olmesartan (rispetto al gruppo trattato con placebo) nella coorte totale e nella coorte senza pazienti che avevano sviluppato microalbuminuria durante lo studio principale. I pazienti che avevano sviluppato microalbuminuria durante lo studio ROADMAP sono risultati avere un rischio 1,8 volte maggiore di sviluppare complicazioni cardio-/cerebrovascolari durante il follow-up rispetto ai pazienti che non avevano sviluppato microalbuminuria (Tabella 1). L’insufficienza cardiaca congestizia con necessità di ricovero e gli attacchi ischemici transitori (TIA) sono risultati essere statisticamente più comuni nel gruppo di pazienti (del follow-up) che avevano precedentemente sviluppato microalbuminuria durante lo studio ROADMAP. Anche la retinopatia diabetica era significativamente ridotta nei pazienti trattati con Olmesartan (Tabella 1). In conclusione, questo studio mostra (i) come la comparsa di microalbuminuria sia un buon predittore di morbilità cardiovascolare e (ii) che un beneficio clinico sostenuto può essere osservato dopo il trattamento con 40 mg giornalieri di Olmesartan per 3,2 anni. Questo beneficio in termini di riduzione degli eventi macrovascolari (significativa per ictus e insufficienza cardiaca congestizia) e di riduzione degli eventi microvascolari (significativa per comparsa di retinopatia diabetica) nel gruppo trattato in precedenza con Olmesartan è stato documentato fino a 3 anni dopo l’interruzione del farmaco (30).
3.6 Conclusioni
I sartani si legano al recettore AT1 impendendo l’interazione con il ligando naturale e riducendo la pressione sanguigna attraverso il rilassamento della muscolatura liscia dei vasi, l’escrezione di sale e acqua e la riduzione del volume del plasma (6). Tra i sartani, Olmesartan è quello che si lega con più alta selettività ai recettori AT1, e non si lega al recettore AT2. Così facendo, Olmesartan antagonizza in maniera dose-dipendente le contrazioni indotte dall’angiotensina II nel tessuto aortico e inibisce la risposta pressoria all’angiotensina II (11). Agendo sul SRAA, Olmesartan è efficace nel ridurre la pressione sanguigna, la riduzione dei livelli di aldosterone, la riduzione dell’attività cardiaca e una maggiore escrezione di sodio. Oltre che essere comunemente usato per la gestione dell’ipertensione, Olmesartan è anche indicato nel trattamento della nefropatia associata al diabete di tipo 2, in particolare nei pazienti che non sono in grado di tollerare gli ACE−inibitori, rallentandone la progressione grazie ai suoi effetti nefroprotettivi (9). Olmesartan è indicato, oltre che negli adulti ipertesi, anche in bambini e adolescenti (6−18 anni), ma ha rivelato efficacia accompagnata a tollerabilità e sicurezza soprattutto negli anziani con ipertensione da lieve a moderata. Olmesartan è particolarmente efficace, rispetto agli altri sartani, nel controllare la pressione nelle 24 ore, in particolare nelle ultime 6 ore dall’assunzione del farmaco e durante il risveglio (picco mattutino), quando il rischio di eventi cardiovascolari è più alto. Olmesartan, inoltre, ritarda lo sviluppo della microalbuminuria, che è attualmente considerata non solo un marker importante della nefropatia diabetica ma anche della mortalità da eventi cardiovascolari.
Bibliografia
- Ames MK, Atkins CE, Pitt B. The renin-angiotensin-aldosterone system and its suppression. Journal of Veterinary Internal Medicine. 2019;33(2):363-382. doi:10.1111/jvim.15454
- Patel S, Rauf A, Khan H, Abu-Izneid T. Renin-angiotensin-aldosterone (RAAS): The ubiquitous system for homeostasis and pathologies. Biomedicine and Pharmacotherapy. 2017;94:317-325. doi:10.1016/j.biopha.2017.07.091
- Laurent S. Antihypertensive drugs. Pharmacological Research. 2017;124:116-125. doi:10.1016/j.phrs.2017.07.026
- Ram CVS. Angiotensin Receptor Blockers: Current Status and Future Prospects. American Journal of Medicine. 2008;121(8):656-663. doi:10.1016/j.amjmed.2008.02.038
- Hernández-Hernández R, Sosa-Canache B, Velasco M, Armas-Hernández MJ, Armas-Padilla MC, Cammarata R. Angiotensin II receptor antagonists role in arterial hypertension. Journal of Human Hypertension. 2002;(1):93-99. doi:10.1038/sj/jhh/1001352
- Israili ZH. Clinical Pharmacokinetics of Angiotensin II (AT 1) Receptor Blockers in Hypertension, 2000; 14(1),573-586. doi:10.1038/sj.jhh.1000991
- Dina R, Jafari M. Angiotensin II-Receptor Antagonists: An Overview. Vol 57.; 2000. https://academic.oup.com/ajhp/article-abstract/57/13/1231/5150491
- Mire DE, Silfani TN, Pugsley MK. A Review of the Structural and Functional Features of Olmesartan Medoxomil, An Angiotensin Receptor Blocker. J Cardiovasc Pharmacol, 2005; 46(5) 585-593. doi: 10.1097/01.fjc.0000180902.78230.fd
- Scott LJ, Mccormack PL, Achard JM. ADIS DRUG EVALUATION Olmesartan Medoxomil A Review of Its Use in the Management of Hypertension. Vol 68.; 2008.
- Warner GT, Jarvis B. Olmesartan Medoxomil.; 2002.
- Mizuno M, Sada T, Ikeda M, et al. Pharmacology of CS-866, a novel nonpeptide angiotensin II receptor antagonist. European Journal of Pharmacology. 1995;285(2):181-188. doi:10.1016/0014-2999(95)00401-6
- Ma SF, Anraku M, Iwao Y, et al. hydrolysis of angiotensin ii receptor blocker prodrug olmesartan medoxomil by human serum albumin and identification of its catalytic active sites. Drug Metabolism and Disposition. 2005;33(12):1911-1919. doi:10.1124/DMD.105.006163
- Laeis P, Püchler K, Kirch W. The pharmacokinetic and metabolic profile of olmesartan medoxomil limits the risk of clinically relevant drug interaction. Journal of Hypertension. 2001;19. https://journals.lww.com/jhypertension/Fulltext/2001/06001/The_pharmacokinetic_and_metabolic_profile_of.4.aspx
- Brunner HR. Olmesartan medoxomil: current status of its use in monotherapy. Vascular Health and Risk Management. 2006;2(4):327. doi:10.2147/VHRM.2006.2.4.327
- Brunner HR. The new oral angiotensin II antagonist olmesartan medoxomil: a concise overview. Journal of Human Hypertension 2002 16:2. 2002;16(2):S13-S16. doi:10.1038/sj.jhh.1001391
- Brunner HR. Olmesartan medoxomil: current status of its use in monotherapy. Vascular Health and Risk Management. 2006;2(4):327-340.
- Neutel JM, Elliott WJ, Izzo JL, Chen CL, Masonson HN. Antihypertensive Efficacy of Olmesartan Medoxomil, a New Angiotensin II Receptor Antagonist, as Assessed by Ambulatory Blood Pressure Measurements. The Journal of Clinical Hypertension. 2002;4(5):325-331. doi:10.1111/J.1524-6175.2002.01051.X
- Neutel JM. Clinical studies of CS-866, the newest angiotensin II receptor antagonist. Am J Cardiol. 2001;87(8A):37-43. doi:10.1016/S0002-9149(01)01510-7
- Oparil S, Williams D, Chrysant SG, Marbury TC, Neutel J. Comparative Efficacy of Olmesartan, Losartan, Valsartan, and Irbesartan in the Control of Essential Hypertension. The Journal of Clinical Hypertension. 2001;3(5):283-318. doi:10.1111/J.1524-6175.2001.01136.X
- Püchler K, Laeis P, Stumpe KO. Blood pressure response, but not adverse event incidence, correlates with dose of angiotensin II antagonist. J Hypertens Suppl. 2001;19(1). doi:10.1097/00004872-200106001-00006
- Stumpe K, Ludwig M. Antihypertensive efficacy of olmesartan compared with other antihypertensive drugs. Journal of Human Hypertension. 2002;(2):24-28. doi:10.1038/sj/jhh/1001395
- Malacco E, Omboni S, Volpe M, Auteri A, Zanchetti A. Antihypertensive efficacy and safety of olmesartan medoxomil and ramipril in elderly patients with mild to moderate essential hypertension: The ESPORT study. Journal of Hypertension. 2010;28(11):2342-2350. doi:10.1097/HJH.0b013e32833e116b
- Scholze J, Schaefer A, Kreutz R. Safety and efficacy of olmesartan: An observational pooled-analysis of 156,682 hypertensive patients. Expert Opinion on Drug Safety. 2011;10(2):185-196. doi:10.1517/14740338.2011.552426
- Volpe M, Tocci G. Olmesartan in the treatment of hypertension in elderly patients: A review of the primary evidence. Drugs and Aging. 2013;30(12):987-998. doi:10.1007/s40266-013-0130-8
- Kario K, Pickering TG, Umeda Y, et al. Morning surge in blood pressure as a predictor of silent and clinical cerebrovascular disease in elderly hypertensives: A prospective study. Circulation. 2003;107(10):1401-1406. doi:10.1161/01.CIR.0000056521.67546.AA
- Omboni S, Malacco E, Mallion JM, Volpe M, Zanchetti A. Twenty-four hour and early morning blood pressure control of olmesartan vs. ramipril in elderly hypertensive patients: Pooled individual data analysis of two randomized, double-blind, parallel-group studies. Journal of Hypertension. 2012;30(7):1468-1477. doi:10.1097/HJH.0b013e32835466ac
- Omboni S, Volpe M. Angiotensin Receptor Blockers Versus Angiotensin Converting Enzyme Inhibitors for the Treatment of Arterial Hypertension and the Role of Olmesartan. Advances in Therapy. 36. doi:10.6084/m9.figshare.7423655
- Kreutz R. Olmesartan/amlodipine: A review of its use in the management of hypertension. Vascular Health and Risk Management. 2011;7(1):183-192. doi:10.2147/VHRM.S16852
- Haller H, Ito S, Izzo JL, et al. Olmesartan for the Delay or Prevention of Microalbuminuria in Type 2 Diabetes. N Engl J Med, 2011; 364:907-917. doi:10.1056/NEJMoa1007994
- Menne J, Ritz E, Ruilope LM, Chatzikyrkou C, Viberti G, Haller H. The Randomized Olmesartan and Diabetes Microalbuminuria Prevention (ROADMAP) observational follow-up study: benefits of RAS blockade with olmesartan treatment are sustained after study discontinuation. J Am Heart Assoc. 2014;3(2). doi:10.1161/JAHA.114.000810
- van Buren PN, Toto R. Hypertension in Diabetic Nephropathy: Epidemiology, Mechanisms, and Management. Advances in Chronic Kidney Disease. 2011;18(1):28-41. doi:10.1053/j.ackd.2010.10.003
- Haller H, Viberti GC, Mimran A, et al. Preventing Microalbuminuria in Patients with Diabetes: Rationale and Design of the Randomised Olmesartan and Diabetes Microalbuminuria Prevention (ROADMAP) Study. J Hypertes, 2006; 24:403-408. doi:10.1097/01.hjh.0000202820.56201.e6
Related papers
La pubblicazione recente di alcuni lavori scientifici basati sulle risultanze di alcuni osservatori epidemiologi mondiali, ha riportato alla ribalta il ruolo chiave delle malattie cardiovascolari come prima causa di morte e disabilità, non solo nel presente, ma anche nel futuro proiettato oggi al 2050 con un incremento più o meno equamente distribuito tra le malattie [more info]
1) Lipoproteine ed aterosclerosi Le lipoproteine sono particelle composte da un nucleo ricco in esteri del colesterolo e trigliceridi (TG) circondati da colesterolo libero, fosfolipidi e apolipoproteine. Le lipoproteine plasmatiche vengono suddivise in varie classi (VLDL, IDL, LDL, HDL e chilomicroni) in base alle dimensioni, alla composizione lipidica e alle apolipoproteine presenti (Tabella 1). I [more info]
Introduzione Le malattie cardiovascolari rappresentano la principale causa di morbilità e mortalità a livello globale, nonostante i progressi nella prevenzione e nel trattamento farmacologico. In questo contesto, l’adozione di strategie terapeutiche efficaci per la gestione dei fattori di rischio cardiovascolare è fondamentale. La combinazione farmacologica di farmaci con meccanismi d’azione complementari è diventata una pratica [more info]