1 Introduzione
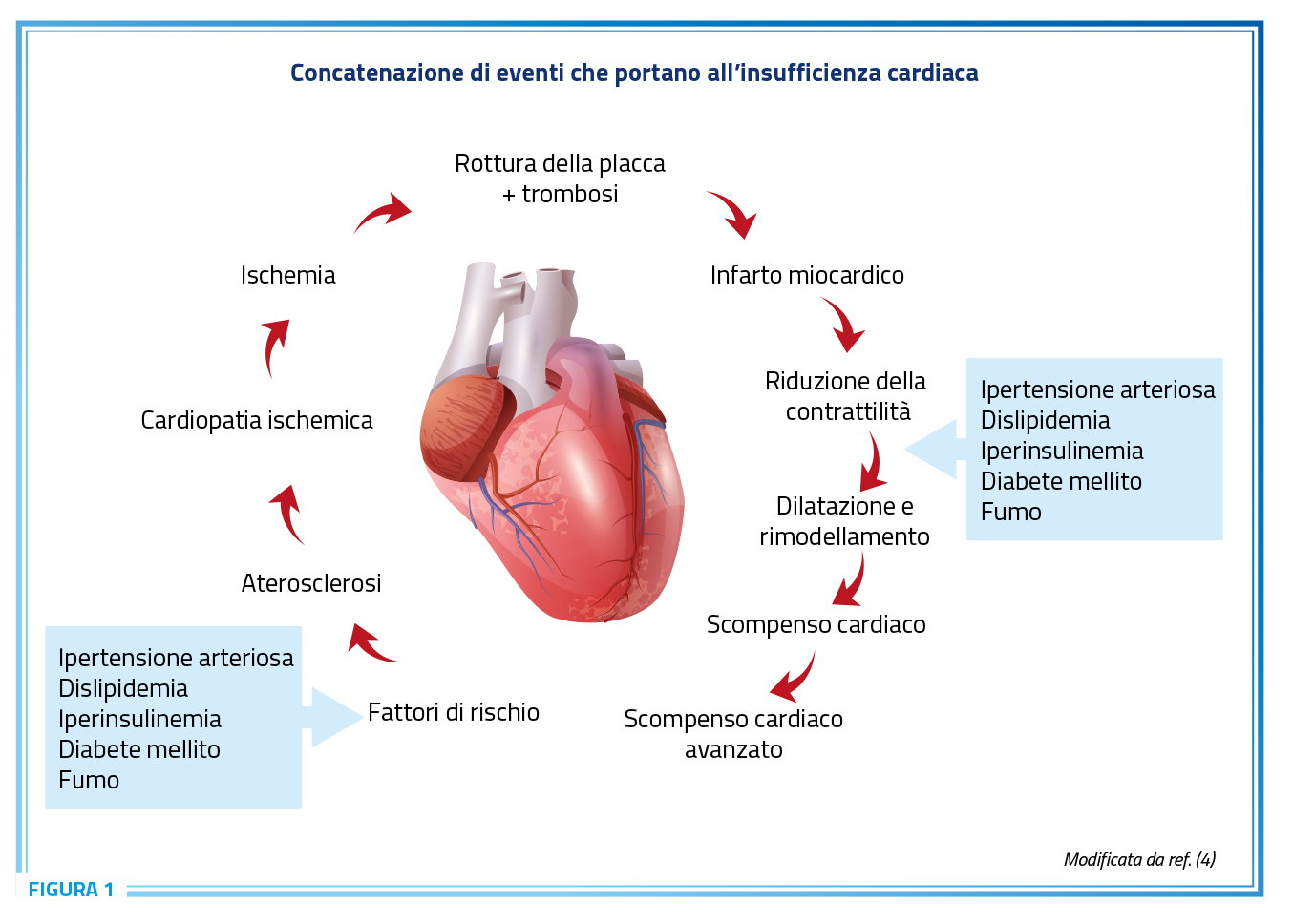
Le malattie cardiovascolari rappresentano la prima causa di morte nel mondo occidentale come conseguenza della interazione tra un numero crescente di fattori di rischio in grado di promuovere la malattia aterosclerotica e le sue complicanze. Tra i diversi fattori di rischio cardiovascolare, l’ipertensione arteriosa ha un ruolo centrale con una diretta responsabilità su una rilevante quota (circa 11 milioni di decessi/anno) della mortalità e morbilità nella popolazione mondiale (1,2). Inoltre, la presenza di alterazioni di tipo metabolico quali dislipidemie, obesità, diabete e complessivamente sindrome metabolica è particolarmente comune nei pazienti con ipertensione arteriosa e condiziona in maniera significativa la salute e la prognosi clinica dei pazienti affetti da ipertensione e malattie cardiovascolari conclamate (Figura 1) (3,4).
2 Il paziente iperteso dismetabolico: caratteristiche, necessità cliniche e il ruolo di zofenopril
La sindrome metabolica è una condizione caratterizzata dalla presenza di diversi fattori di rischio cardiovascolare quali l’obesità addominale, la dislipidemia aterogena, la resistenza insulinica o la ridotta tolleranza agli idrati di carbonio e l’aumento dei livelli pressori (2,5). I pazienti con sindrome metabolica presentano un rischio di eventi cardiovascolari fatali e non fatali aumentato di 2-3 volte rispetto ai soggetti normali, rischio che viene addirittura quintuplicato in presenza di diabete mellito (6–9). Nei pazienti con sindrome metabolica non associata a diabete, il più importante determinante del rischio cardiovascolare è l’ipertensione arteriosa, seguita in ordine di rilevanza dalla dislipidemia, dalla alterata glicemia a digiuno e dall’obesità (8,10). Per quanto concerne la dislipidemia, numerose evidenze dimostrano che elevate concentrazioni di colesterolo LDL rappresentano il fattore scatenante l’aterogenesi e favoriscono lo sviluppo dell’aterosclerosi. Tuttavia, elevati livelli di LDL si associano spesso ad altre anomalie lipoproteiche, come un lieve aumento dei trigliceridi e una riduzione del colesterolo HDL. Queste tre alterazioni sono, di fatto, strettamente correlate sul piano metabolico; ciascuna di esse può contribuire al rischio aterogeno, ma è complesso distinguere il loro peso relativo nel processo di aterogenesi. Per questo motivo, la combinazione di trigliceridi lievemente aumentati, elevati livelli di LDL e bassi livelli di HDL è stata riunita sotto il termine “fenotipo lipoproteico aterogenico”. In questo contesto, la dislipidemia aterogena, nota anche come “triade lipidica”, è definita dalla concomitanza di bassi livelli di HDL-C (<40 mg/dL negli uomini o <50 mg/dL nelle donne), livelli elevati di LDL-C (≥100 mg/dL) e trigliceridi aumentati (≥150 mg/dL) (11–13).
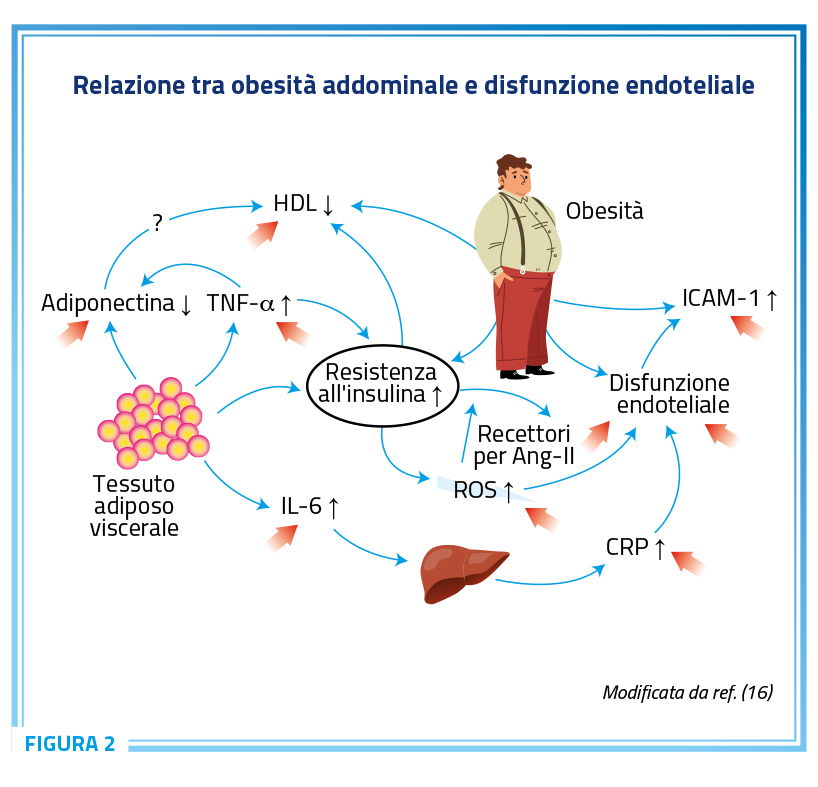
La sindrome metabolica complicata da obesità e sovrappeso rappresenta un fenotipo assai comune nel mondo dei pazienti a rischio cardiovascolare ed è caratterizzata dalla presenza di insulino-resistenza con conseguente iperinsulinemia ed attivazione del sistema SRAA a livello vascolare (14,15). Tale attivazione condiziona un’espressione esagerata e dose dipendente dei recettori della angiotensina II che contribuisce allo sviluppo di complicanze cardiovascolari ed al progressivo peggioramento del profilo metabolico e dell’incremento del peso corporeo (Figura 2) (16).
Nel paziente iperteso, la presenza di sindrome metabolica ha un impatto non trascurabile sulla definizione delle strategie preventive e terapeutiche più adeguate a tenere sotto controllo sia gli aspetti di rischio cardiovascolare che lo scarso controllo del profilo glucidico e lipidico; è quindi evidente come nella gestione di questo paziente si debbano prendere in considerazione le varie condizioni cardiovascolari e metaboliche e le loro rispettive interazioni, impostando un trattamento antipertensivo che sia rispettoso del profilo lipidico e glucidico del paziente e che tenga conto della difficoltà nel portare a target la pressione arteriosa in questi pazienti (2).
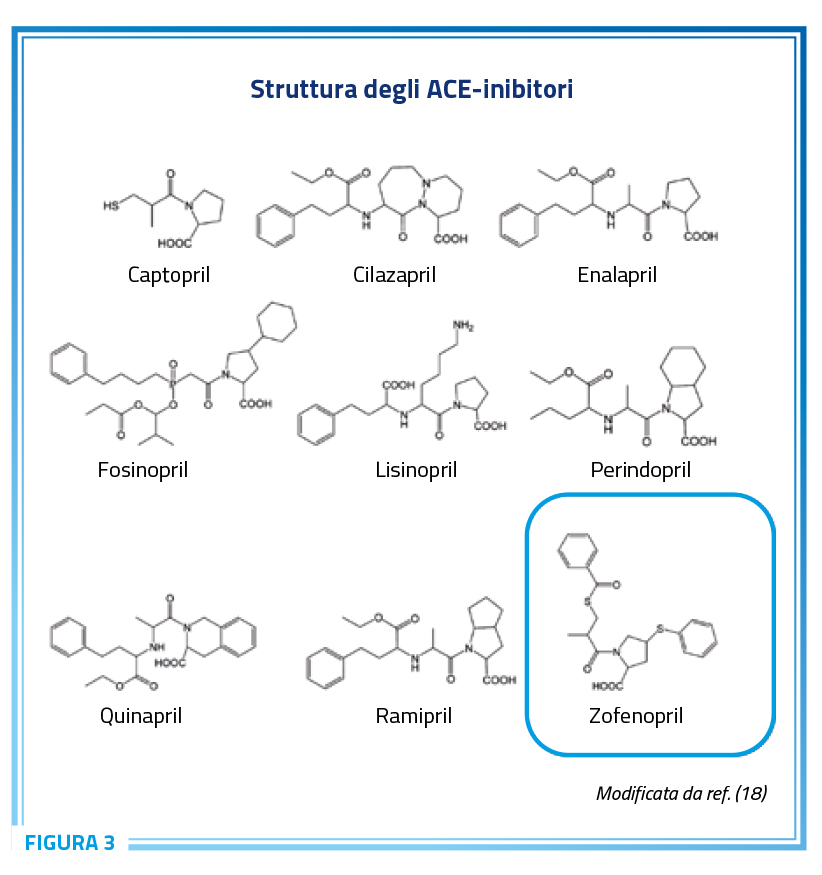
Tra le classi di farmaci raccomandati come strategie di prima scelta nei pazienti ipertesi – nonché nella maggioranza dei pazienti affetti da malattie cardiovascolari – vanno annoverati i farmaci inibitori del SRAA ed in particolare quelli che agiscono su ACE, gli ACE inibitori (ACEi). Storicamente, il primo farmaco ACEi introdotto in commercio per il trattamento dell’ipertensione è stato il captopril, nel 1980, seguito rapidamente da numerosi altri quali enalapril, perindopril, lisinopril, ramipril, quinapril, benazepril, cilazapril, trandolapril, fosinopril, moexipril, imidapril e zofenopril (Figura 3) (17,18).
Tutti differiscono nel profilo farmacologico per struttura, affinità tissutale e capacità di protezione d’organo; le caratteristiche farmacocinetiche e farmacodinamiche, come affinità, potenza, lipofilia e ritenzione tissutale, influenzano la durata e l’intensità dell’effetto preventivo cardiovascolare (18,19). Dal punto di vista strutturale, una delle peculiarità di maggiore interesse è la presenza o meno nella molecola degli ACEi di radicali sulfidrilici, i quali assicurano una serie di proprietà farmacologiche che contribuiscono alla unicità del meccanismo d’azione ed allo specifico profilo di efficacia clinica, tipici di captopril e, fra gli ACEi di terza generazione, zofenopril. Le caratteristiche farmacologiche e la presenza del gruppo –SH consentono a zofenopril di esercitare, oltre all’azione antipertensiva, anche effetti antiossidanti, di migliorare la funzione endoteliale a livello vascolare e di rallentare la progressione della placca aterosclerotica nel soggetto iperteso (20–23).
I meccanismi ipotensivi mediati dall’inibizione di ACE e quelli antiossidanti e anti-aterogeni, mediati dall’H2S, si traducono in una elevata capacità di protezione vasculo-endoteliale e del danno cardiaco; questi aspetti sono di fondamentale rilevanza soprattutto nei pazienti in cui tale processo è più attivo e cioè in coloro che associano la presenza di ipertensione con fattori di rischio concomitanti, soprattutto se di natura metabolica. Zofenopril, infatti, presenta un’efficacia terapeutica, ampiamente dimostrata, nel trattamento di condizioni a rischio complesso come l’ipertensione arteriosa (24–30), ma anche nell’infarto miocardico acuto (31–33), anche quando complicato da scompenso cardiaco (34,35), con un impatto preferenziale nei pazienti con fenotipi caratterizzati da un profilo di rischio dismetabolico e pro-aterogeno, come soggetti dislipidemici, diabetici o più generalmente affetti da sindrome metabolica (14,15,24–36).
Analisi post-hoc dello studio SMILE (che ha arruolato pazienti con infarto miocardico) hanno rivelato che il trattamento di 6 settimane con zofenopril risultava in una riduzione della pressione arteriosa sistolica e diastolica significativamente maggiore nei pazienti con sindrome metabolica rispetto a quelli senza sindrome metabolica. Inoltre, è interessante notare che la riduzione di morbilità e mortalità osservata in queste analisi post-hoc si è dimostrata in gran parte indipendente dalla riduzione della pressione arteriosa, suggerendo che zofenopril possa influenzare la prognosi dei pazienti con sindrome metabolica oltre e al di là del suo effetto emodinamico.
3 Zofenopril: farmacologia e razionale d’uso
3.1 Il ruolo del gruppo sulfidrilico
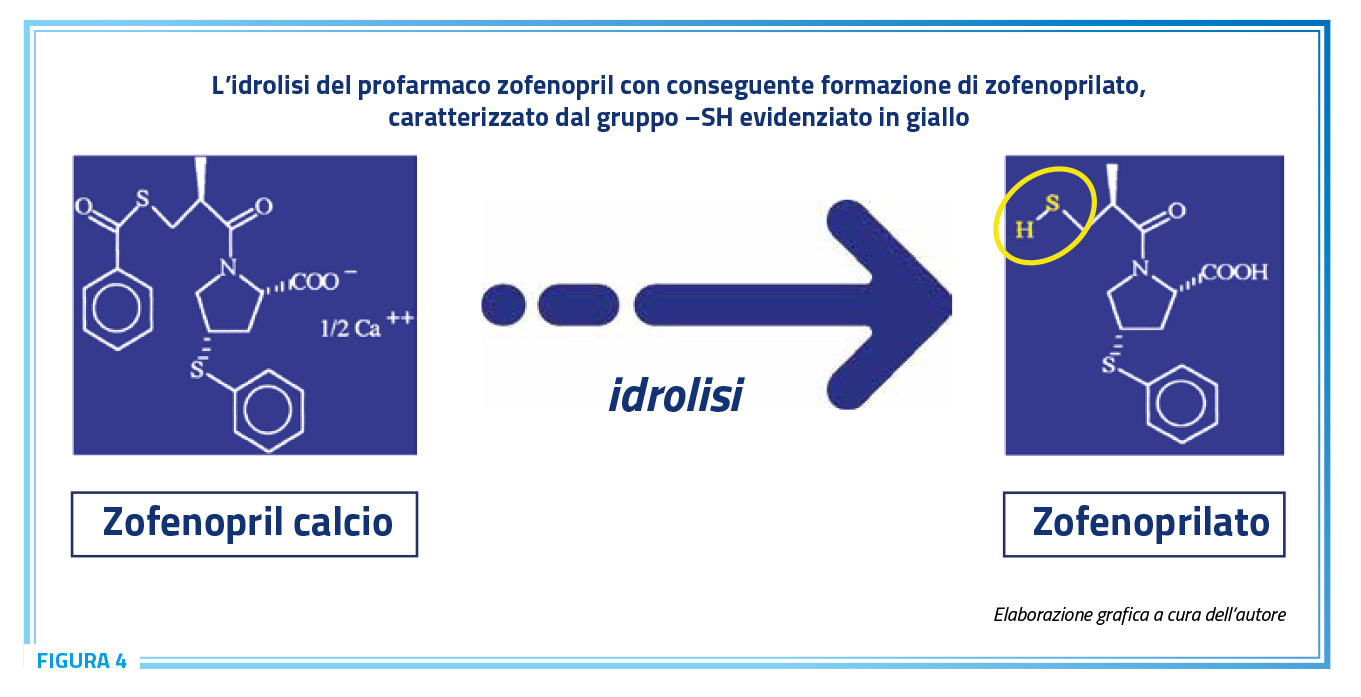
Zofenopril è un profarmaco, la cui forma attiva, denominata zofenoprilato, è un ACEi con una spiccata lipofilia, caratteristica che alla molecola conferisce una penetrazione persistente a livello tissutale ed un prolungato effetto di inibizione dell’enzima di conversione sia a livello circolante che a livello tissutale (20). L’idrolisi di zofenopril a zofenoprilato permette di esporre un gruppo –SH (Figura 4); questo tiolo libero (–SH) ha portato ad ipotizzare che zofenoprilato potesse agire come un donatore di H2S.
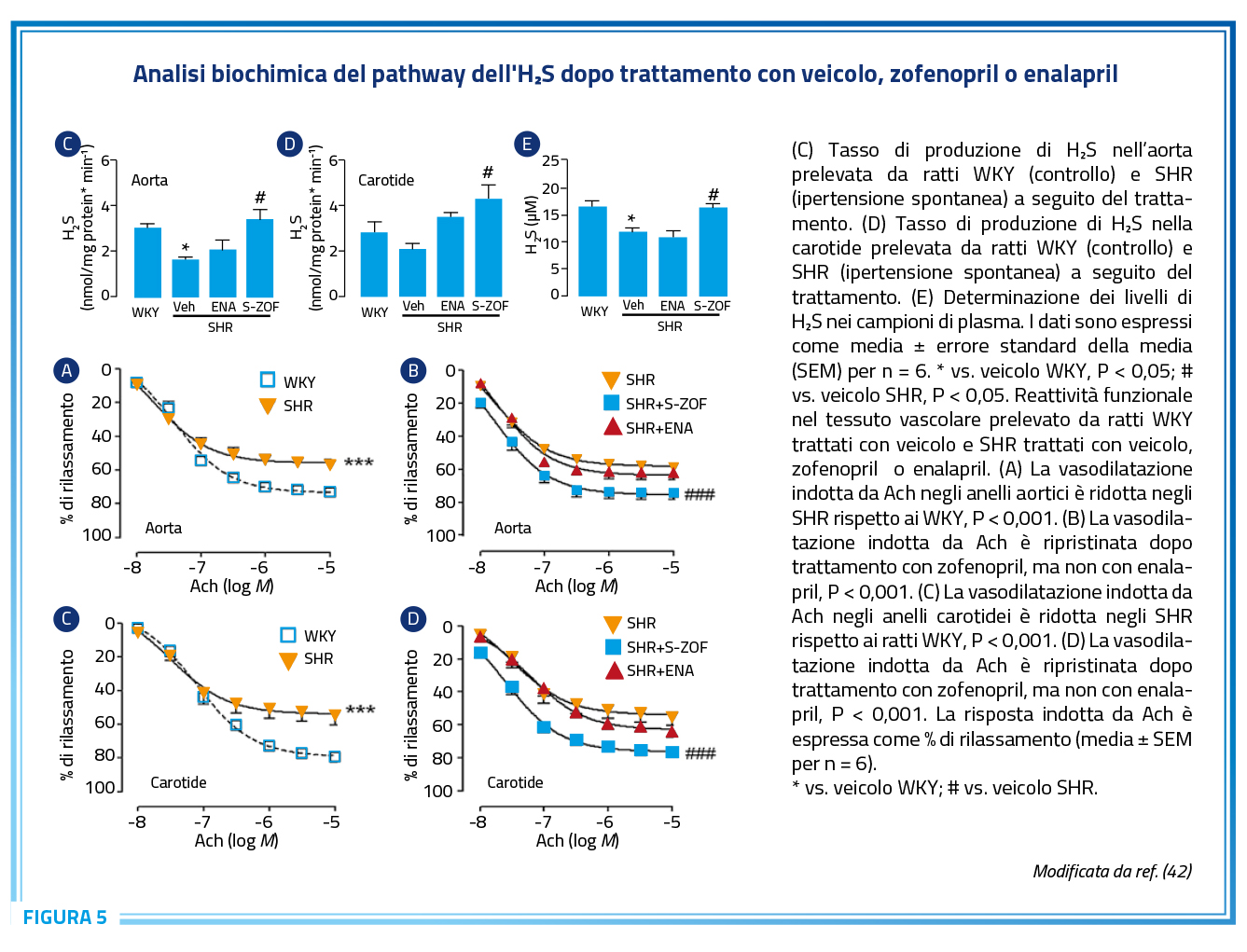
L’idrogeno solforato è considerato il terzo “gasotransmitter”, l’ultimo identificato dopo il monossido di carbonio (CO) e l’ossido nitrico (NO); queste piccole molecole svolgono un ruolo importante nella regolazione della omeostasi cellulare e svolgono un ruolo in vari processi, tra cui l’infiammazione e le malattie cardiovascolari (23,37). L’H2S, recentemente riconosciuto come regolatore fisiologico del sistema vascolare, svolge un ruolo chiave nel controllo della proliferazione, apoptosi e autofagia delle cellule endoteliali dei vasi, oltre a regolare il tono vascolare. Numerose evidenze scientifiche indicano che una ridotta attività del pathway dell’H2S è coinvolta nella patogenesi di diverse malattie vascolari, tra cui ipertensione e aterosclerosi (23,37). Al contrario, la somministrazione di H2S potrebbe rappresentare un’importante strategia preventiva contro la progressione di queste patologie, grazie alla sua capacità di regolare il tono vascolare, inibire l’infiammazione, contrastare lo stress ossidativo e la proliferazione cellulare, oltre a modulare l’apoptosi delle cellule vascolari; questi effetti sono stati dimostrati in esperimenti su modelli animali, cellulari e persino in studi clinici (23). La dimostrazione della capacità di zofenopril di favorire il rilascio di H2S a livello arterioso e cardiaco ha aperto ad una ulteriore area di sviluppo per la interpretazione dell’efficacia cardio e vasculo-protettiva di zofenopril (38–41). In particolare, è stato dimostrato in ratti spontaneamente ipertesi che zofenopril, a differenza di enalapril, è in grado di aumentare i livelli di H2S sia nei tessuti che nel plasma, favorendo la vasodilatazione indotta da L-cisteina e acetilcolina tramite un effetto additivo che non dipende dall’inibizione di ACE; la vasodilatazione dell’endotelio mediata da zofenopril, infatti, eccede significativamente quella di un tipico ACEi come enalapril sia a livello aortico che carotideo (Figura 5) (42). I meccanismi attraverso i quali l’H2S induce vasodilatazione sono complessi e includono la riduzione dello stress ossidativo e dell’infiammazione, la modulazione della funzione immunitaria e dei canali ionici, oltre all’inibizione della deposizione di collagene e del rimodellamento vascolare (23,39–41).
3.1.1 Azione antiossidante, anti-aterogena e vasculo-protettiva
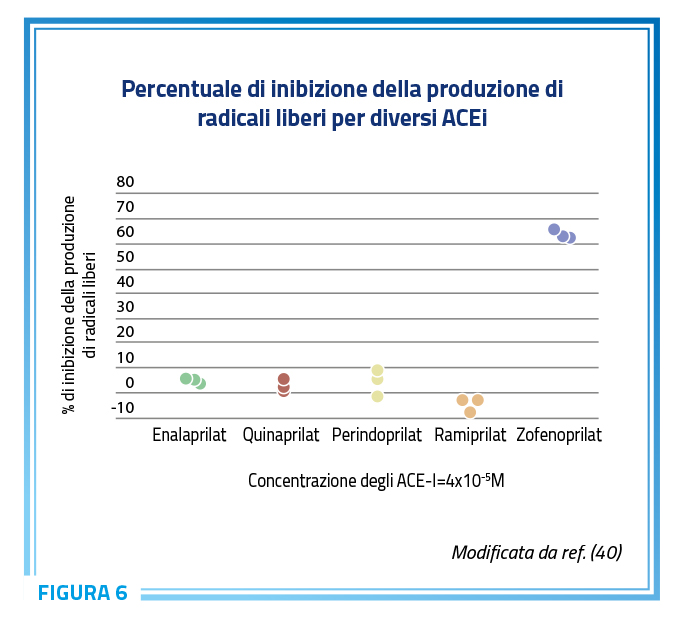
L’aumento dei livelli circolanti e tissutali di H2S assume particolare rilevanza in relazione alla sua attività antiossidante e alle relative ricadute sull’endotelio vascolare. Studi di confronto diretto hanno dimostrato come l’effetto antiossidante di zofenopril ecceda quello osservato per altre molecole non sulfidriliche della stessa classe (Figura 6) (36,39–41).
L’H2S stimola infatti la sintesi di glutatione, contribuendo a limitare la perossidazione lipidica e a potenziare le capacità antiossidanti, con effetti favorevoli sulla protezione cardiovascolare. Zofenoprfil, nello specifico, pur non essendo in grado di agire direttamente sui livelli lipidici plasmatici, è in grado di ridurre lo stato di ossidazione del colesterolo, e contribuisce a rallentare la progressione delle lesioni aterosclerotiche come dimostrato in studi clinici e preclinici (22,36,41,41,43–45).
Uno studio con follow-up a lungo termine (5 anni) ha randomizzato due gruppi di pazienti con nuova diagnosi di ipertensione al trattamento con enalapril o zofenopril. Le misurazioni dello spessore medio-intimale di entrambe le carotidi fino a 5 anni hanno evidenziato, a parità di effetto antipertensivo, una riduzione significativa nel gruppo trattato con zofenopril, ma non nel gruppo trattato con enalapril, supportando la maggior efficacia di zofenopril nel rallentamento della progressione della aterosclerosi; inoltre, tale beneficio è stato accompagnato da un profilo favorevole di rilascio di ossido nitrico e riduzione dello stress ossidativo nel gruppo zofenopril (36).
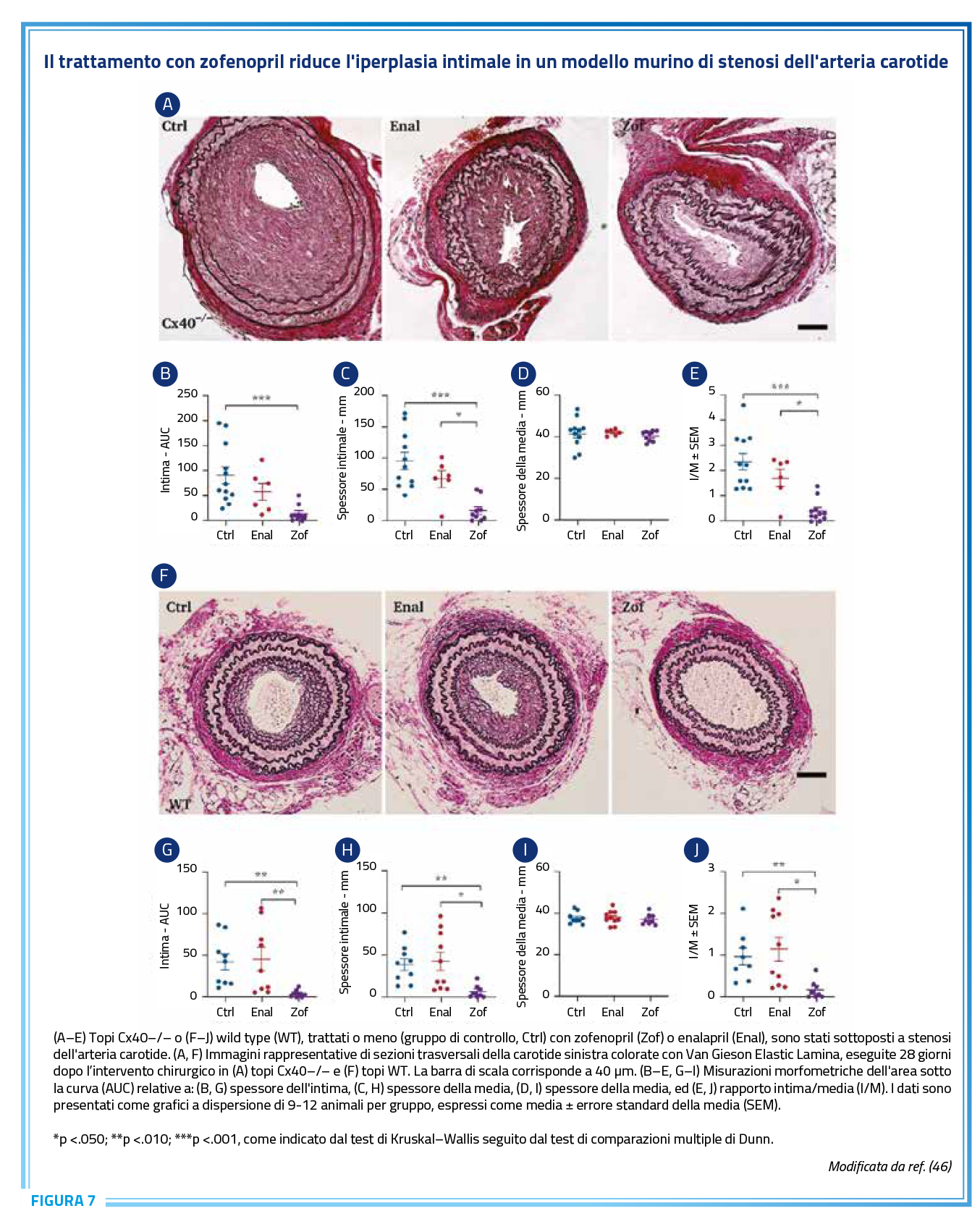
Zofenopril è anche in grado di ridurre la iperplasia vascolare, come mostrato in un modello genetico di stenosi carotidea (Figura 7) (46). La malattia aterosclerotica è infatti in grado di determinare modifiche della struttura della parete arteriosa, che a loro volta condizionano lo sviluppo di complicanze trombotiche tipiche del danno endoteliale. L’effetto protettivo di zofenopril verso l’iperplasia risulta significativamente maggiore quando confrontato con enalapril, contribuendo in maniera significativa al rallentamento di un meccanismo patologico nei pazienti a rischio di malattia aterosclerotica (46).
Il rallentamento della progressione della malattia aterosclerotica rappresenta un passaggio fondamentale e imprescindibile nella protezione dalle malattie cardiovascolari sia in termini di prevenzione primaria (es., pazienti ipertesi) che secondaria (es., pazienti post-infartuali) (2,12). In quest’ottica, la capacità di un farmaco di inibire l’ACE e contemporaneamente determinare un’azione vasculoprotettiva diretta, rappresenta la base per una efficacia globale della quale il controllo della pressione arteriosa e il rallentamento dell’aterosclerosi rappresentano fattori additivi, sinergici e indipendenti. Inoltre, la maggiore affinità di zofenopril per l’ACE cardiaco rispetto ad altri ACEi (47) può condizionare una minore progressione della malattia aterosclerotica di fondo che giustifica la rapidità di comparsa dell’effetto cardioprotettivo osservata nei pazienti dello studio SMILE e nei numerosi modelli sperimentarli nei quali la efficacia antiaterogena di zofenopril è stata valutata (36,39,41,48).
4 Conclusioni
Zofenopril rappresenta un’opzione terapeutica di particolare rilievo nel trattamento dell’ipertensione arteriosa, un fattore di rischio cardine nelle malattie cardiovascolari e metaboliche. Oltre a garantire un’efficacia antipertensiva comparabile ad altri ACE-inibitori, zofenopril si distingue per il suo unico profilo farmacologico legato alla presenza del gruppo sulfidrilico, che risulta nel rilascio di H₂S. Questo meccanismo contribuisce non solo al controllo pressorio in aggiunta all’inibizione dell’ACE, ma anche a significativi effetti antiossidanti e cardioprotettivi, riducendo lo stress ossidativo lipidico, rallentando la progressione dell’aterosclerosi e proteggendo l’endotelio vascolare e cardiaco.
Grazie a queste caratteristiche, supportate da ampie evidenze cliniche e precliniche, zofenopril può offrire benefici particolarmente rilevanti nei pazienti ipertesi con comorbidità metaboliche come dislipidemia, obesità e diabete, contribuendo a ridurre il rischio cardiovascolare globale.
Bibliografia
- World Health Organization. Global report on hypertension: the race against a silent killer [Internet]. Geneve; 2023 Sep [cited 2024 Nov 12]. Available from: https://www.who.int/publications/i/item/9789240081062.
- Mancia G, Kreutz R, Brunström M, Burnier M, Grassi G, Januszewicz A, et al. 2023 ESH Guidelines for the management of arterial hypertension The Task Force for the management of arterial hypertension of the European Society of Hypertension. J Hypertens. 2023 Dec;41(12):1874–2071.
- Dzau VJ, Antman EM, Black HR, Hayes DL, Manson JE, Plutzky J, et al. The Cardiovascular Disease Continuum Validated: Clinical Evidence of Improved Patient Outcomes. Circulation. 2006 Dec 19;114(25):2850–70.
- Werner C, Baumhäkel M, Teo KK, Schmieder R, Mann J, Unger T, et al. RAS blockade with ARB and ACE inhibitors: current perspective on rationale and patient selection. Clinical Research in Cardiology. 2008 Jul 3;97(7):418–31.
- Eckel RH, Grundy SM, Zimmet PZ. The metabolic syndrome. The Lancet. 2005 Apr;365(9468):1415–28.
- Hunt KJ, Resendez RG, Williams K, Haffner SM, Stern MP. National Cholesterol Education Program Versus World Health Organization Metabolic Syndrome in Relation to All-Cause and Cardiovascular Mortality in the San Antonio Heart Study. Circulation. 2004 Sep 7;110(10):1251–7.
- Lakka HM. The Metabolic Syndrome and Total and Cardiovascular Disease Mortality in Middle-aged Men. JAMA. 2002 Dec 4;288(21):2709.
- Isomaa B, Almgren P, Tuomi T, Forsén B, Lahti K, Nissén M, et al. Cardiovascular Morbidity and Mortality Associated With the Metabolic Syndrome. Diabetes Care. 2001 Apr 1;24(4):683–9.
- Hu G. Prevalence of the Metabolic Syndrome and Its Relation to All-Cause and Cardiovascular Mortality in Nondiabetic European Men and Women. Arch Intern Med. 2004 May 24;164(10):1066.
- Ford ES, Giles WH, Dietz WH. Prevalence of the Metabolic Syndrome Among US Adults. JAMA. 2002 Jan 16;287(3):356.
- Lamarche B, Tchernof A, Moorjani S, Cantin B, Dagenais GR, Lupien PJ, et al. Small, Dense Low-Density Lipoprotein Particles as a Predictor of the Risk of Ischemic Heart Disease in Men. Circulation. 1997 Jan 7;95(1):69–75.
- Grundy SM. Hypertriglyceridemia, Atherogenic Dyslipidemia, and the Metabolic Syndrome. Am J Cardiol. 1998 Feb;81(4):18B-25B.
- Onat A, Avcı GŞ, Barlan MM, Uyarel H, Uzunlar B, Sansoy V. Measures of abdominal obesity assessed for visceral adiposity and relation to coronary risk. Int J Obes. 2004 Aug 15;28(8):1018–25.
- Omboni S, Malacco E, Parati G. Zofenopril Plus Hydrochlorothiazide Fixed Combination in the Treatment of Hypertension and Associated Clinical Conditions. Cardiovasc Ther. 2009 Dec 9;27(4):275–88.
- Malacco E, Omboni S. Antihypertensive efficacy of zofenopril plus hydrochlorothiazide fixed combination for treatment in metabolic syndrome. Adv Ther. 2007 Sep;24(5):1006–15.
- Alexander RW. President’s address. Common mechanisms of multiple diseases: why vegetables and exercise are good for you. Trans Am Clin Climatol Assoc. 2010;121:1–20.
- Laurent S. Antihypertensive drugs. Pharmacol Res. 2017 Oct;124:116–25.
- Popović MR, Popović G V., Agbaba DD. The Effects of Anionic, Cationic, and Nonionic Surfactants on Acid–Base Equilibria of ACE Inhibitors. J Chem Eng Data. 2013 Sep 12;58(9):2567–73.
- Piepho RW. Overview of the angiotensin-converting-enzyme inhibitors. American Journal of Health-System Pharmacy. 2000 Oct 1;57(suppl_1):S3–7.
- Borghi C, Bacchelli S, Degli Esposti D, Ambrosioni E. A review of the angiotensin-converting enzyme inhibitor, zofenopril, in the treatment of cardiovascular diseases. Expert Opin Pharmacother. 2004 Sep 25;5(9):1965–77.
- PASINI A, GARBIN U, NAVA M, STRANIERI C, PELLEGRINI M, BOCCIOLETTI V, et al. Effect of Sulfhydryl and non-Sulfhydryl Angiotensin-Converting Enzyme Inhibitors on Endothelial Function in Essential Hypertensive Patients. Am J Hypertens. 2007 Apr;20(4):443–50.
- Evangelista S, Manzini S. Antioxidant and Cardioprotective Properties of the Sulphydryl Angiotensinconverting Enzyme Inhibitor Zofenopril. Journal of International Medical Research. 2005 Feb 1;33(1):42–54.
- Lv B, Chen S, Tang C, Jin H, Du J, Huang Y. Hydrogen sulfide and vascular regulation – An update. J Adv Res. 2021 Jan;27:85–97.
- Nilsson P. Antihypertensive efficacy of zofenopril compared with atenolol in patients with mild to moderate hypertension. Blood Press. 2007 Jan 8;16(sup2):25–30.
- Farsang C. Blood pressure control and response rates with zofenopril compared with amlodipine in hypertensive patients. Blood Press. 2007 Jan 8;16(sup2):19–24.
- Lacourciere Y, Provencher P. Comparative effects of zofenopril and hydrochlorothiazide on office and ambulatory blood pressures in mild to moderate essential hypertension. Br J Clin Pharmacol. 1989 Mar 26;27(3):371–6.
- Mallion J. An evaluation of the initial and long‐term antihypertensive efficacy of zofenopril compared with enalapril in mild to moderate hypertension. Blood Press. 2007 Jan 8;16(sup2):13–8.
- Malacco E, Piazza S, Omboni S. Zofenopril versus Lisinopril in the Treatment of Essential Hypertension in Elderly Patients. Clin Drug Investig. 2005;25(3):175–82.
- Narkiewicz K. Comparison of home and office blood pressure in hypertensive patients treated with zofenopril or losartan. Blood Press. 2007 Jan 8;16(sup2):7–12.
- Leonetti G, Rappelli A, Omboni S, on Behalf of the Study Group. A similar 24‐h blood pressure control is obtained by zofenopril and candesartan in primary hypertensive patients. Blood Press. 2006 Jan 8;15(sup1):18–26.
- Borghi C, Ambrosioni E. Double-blind comparison between zofenopril and lisinopril in patients with acute myocardial infarction: Results of the Survival of Myocardial Infarction Long-term Evaluation-2 (SMILE-2) study. Am Heart J. 2003 Jan;145(1):80–7.
- Borghi C, Bacchelli S, Esposti D, Bignamini A, Magnani B, Ambrosioni E. Effects of the administration of an angiotensin-converting enzyme inhibitor during the acute phase of myocardial infarction in patients with arterial hypertension. Am J Hypertens. 1999 Jul;12(7):665–72.
- Borghi C, Bacchelli S, Esposti DD, Ambrosioni E. Effects of the Early ACE Inhibition in Diabetic Nonthrombolyzed Patients With Anterior Acute Myocardial Infarction. Diabetes Care. 2003 Jun 1;26(6):1862–8.
- KELBAeK H, AGNER E, WROBLEWSKI H, MADSEN P V., MARVING J. Angiotensin converting enzyme inhibition at rest and during exercise in congestive heart failure. Eur Heart J. 1993 May 1;14(5):692–5.
- Binkley PF, Haas GJ, Starling RC, Nunziata E, Hatton PA, Leier C V., et al. Sustained augmentation of parasympathetic tone with angiotensin-converting enzyme inhibition in patients with congestive heart failure. J Am Coll Cardiol. 1993 Mar;21(3):655–61.
- Napoli C, Bruzzese G, Ignarro LJ, Crimi E, de Nigris F, Williams-Ignarro S, et al. Long-term treatment with sulfhydryl angiotensin-converting enzyme inhibition reduces carotid intima-media thickening and improves the nitric oxide/oxidative stress pathways in newly diagnosed patients with mild to moderate primary hypertension. Am Heart J. 2008 Dec;156(6):1154.e1-1154.e8.
- Hendriks KD, Maassen H, van Dijk PR, Henning RH, van Goor H, Hillebrands JL. Gasotransmitters in health and disease: a mitochondria-centered view. Curr Opin Pharmacol. 2019 Apr;45:87–93.
- Meng G, Xiao Y, Ma Y, Tang X, Xie L, Liu J, et al. Hydrogen Sulfide Regulates Krüppel‐Like Factor 5 Transcription Activity via Specificity Protein 1 S‐Sulfhydration at Cys664 to Prevent Myocardial Hypertrophy. J Am Heart Assoc. 2016 Sep;5(9).
- Napoli C, Sica V, de Nigris F, Pignalosa O, Condorelli M, Ignarro LJ, et al. Sulfhydryl angiotensin-converting enzyme inhibition induces sustained reduction of systemic oxidative stress and improves the nitric oxide pathway in patients with essential hypertension. Am Heart J. 2004 Jul;148(1):172.
- Chopra M, Beswick H, Clapperton M, Dargie HJ, Smith WE, McMurray J. Antioxidant Effects of Angiotensin-Converting Enzyme (ACE) Inhibitors: Free Radical and Oxidant Scavenging are Sulfhydryl Dependent, but Lipid Peroxidation is Inhibited by Both Sulfhydryl- and Nonsulfhydryl-Containing ACE Inhibitors. J Cardiovasc Pharmacol. 1992 Mar;19(3):330–40.
- Napoli C, Cicala C, D’Armiento FP, Roviezzo F, Somma P, de Nigris F, et al. Beneficial effects of ACE-inhibition with zofenopril on plaque formation and low-density lipoprotein oxidation in watanabe heritable hyperlipidemic rabbits. General Pharmacology: The Vascular System. 1999 Dec;33(6):467–77.
- Bucci M, Vellecco V, Cantalupo A, Brancaleone V, Zhou Z, Evangelista S, et al. Hydrogen sulfide accounts for the peripheral vascular effects of zofenopril independently of ACE inhibition. Cardiovasc Res. 2014 Apr 1;102(1):138–47.
- Lacourciere Y, Gagne C. Influence of Zofenopril and Low Doses of Hydrochlorothiazide on Plasma Lipoproteins in Patients With Mild to Moderate Essential Hypertension [Internet]. 1989. Available from: https://academic.oup.com/ajh/article/2/11_Pt_1/861/172434
- Napoli C, Sica V, De Nigris F, Pignalosa O, Condorelli M, Ignarro LJ, et al. Sulfhydryl angiotensin-converting enzyme inhibition induces sustained reduction of systemic oxidative stress and improves the nitric oxide pathway in patients with essential hypertension. Am Heart J. 2004 Jul;148(1):172.
- Napoli C, Bruzzese G, Ignarro LJ, Crimi E, de Nigris F, Williams-Ignarro S, et al. Long-term treatment with sulfhydryl angiotensin-converting enzyme inhibition reduces carotid intima-media thickening and improves the nitric oxide/oxidative stress pathways in newly diagnosed patients with mild to moderate primary hypertension. Am Heart J. 2008 Dec;156(6):1154.e1-1154.e8.
- Macabrey D, Deslarzes-Dubuis C, Longchamp A, Lambelet M, Ozaki CK, Corpataux JM, et al. Hydrogen Sulphide Release via the Angiotensin Converting Enzyme Inhibitor Zofenopril Prevents Intimal Hyperplasia in Human Vein Segments and in a Mouse Model of Carotid Artery Stenosis. European Journal of Vascular and Endovascular Surgery. 2022 Feb;63(2):336–46.
- Cushman D, Wang F, Fung W, Grover G, Harvey C, Scalese R, et al. Comparisons in vitro, ex vivo, and in vivo of the actions of seven structurally diverse inhibitors of angiotensin converting enzyme (ACE). Br J Clin Pharmacol. 1989 Jan 26;28(S2).
- Borghi C. Effects of early treatment with zofenopril in patients with myocardial infarction and metabolic syndrome: the SMILE Study. Vasc Health Risk Manag. 2008 Jun;Volume 4:665–71.
1 Introduzione
Le malattie cardiovascolari rappresentano la prima causa di morte nel mondo occidentale come conseguenza della interazione tra un numero crescente di fattori di rischio in grado di promuovere la malattia aterosclerotica e le sue complicanze. Tra i diversi fattori di rischio cardiovascolare, l’ipertensione arteriosa ha un ruolo centrale con una diretta responsabilità su una rilevante quota (circa 11 milioni di decessi/anno) della mortalità e morbilità nella popolazione mondiale (1,2). Inoltre, la presenza di alterazioni di tipo metabolico quali dislipidemie, obesità, diabete e complessivamente sindrome metabolica è particolarmente comune nei pazienti con ipertensione arteriosa e condiziona in maniera significativa la salute e la prognosi clinica dei pazienti affetti da ipertensione e malattie cardiovascolari conclamate (Figura 1) (3,4).
2 Il paziente iperteso dismetabolico: caratteristiche, necessità cliniche e il ruolo di zofenopril
La sindrome metabolica è una condizione caratterizzata dalla presenza di diversi fattori di rischio cardiovascolare quali l’obesità addominale, la dislipidemia aterogena, la resistenza insulinica o la ridotta tolleranza agli idrati di carbonio e l’aumento dei livelli pressori (2,5). I pazienti con sindrome metabolica presentano un rischio di eventi cardiovascolari fatali e non fatali aumentato di 2-3 volte rispetto ai soggetti normali, rischio che viene addirittura quintuplicato in presenza di diabete mellito (6–9). Nei pazienti con sindrome metabolica non associata a diabete, il più importante determinante del rischio cardiovascolare è l’ipertensione arteriosa, seguita in ordine di rilevanza dalla dislipidemia, dalla alterata glicemia a digiuno e dall’obesità (8,10). Per quanto concerne la dislipidemia, numerose evidenze dimostrano che elevate concentrazioni di colesterolo LDL rappresentano il fattore scatenante l’aterogenesi e favoriscono lo sviluppo dell’aterosclerosi. Tuttavia, elevati livelli di LDL si associano spesso ad altre anomalie lipoproteiche, come un lieve aumento dei trigliceridi e una riduzione del colesterolo HDL. Queste tre alterazioni sono, di fatto, strettamente correlate sul piano metabolico; ciascuna di esse può contribuire al rischio aterogeno, ma è complesso distinguere il loro peso relativo nel processo di aterogenesi. Per questo motivo, la combinazione di trigliceridi lievemente aumentati, elevati livelli di LDL e bassi livelli di HDL è stata riunita sotto il termine “fenotipo lipoproteico aterogenico”. In questo contesto, la dislipidemia aterogena, nota anche come “triade lipidica”, è definita dalla concomitanza di bassi livelli di HDL-C (<40 mg/dL negli uomini o <50 mg/dL nelle donne), livelli elevati di LDL-C (≥100 mg/dL) e trigliceridi aumentati (≥150 mg/dL) (11–13).
La sindrome metabolica complicata da obesità e sovrappeso rappresenta un fenotipo assai comune nel mondo dei pazienti a rischio cardiovascolare ed è caratterizzata dalla presenza di insulino-resistenza con conseguente iperinsulinemia ed attivazione del sistema SRAA a livello vascolare (14,15). Tale attivazione condiziona un’espressione esagerata e dose dipendente dei recettori della angiotensina II che contribuisce allo sviluppo di complicanze cardiovascolari ed al progressivo peggioramento del profilo metabolico e dell’incremento del peso corporeo (Figura 2) (16).
Nel paziente iperteso, la presenza di sindrome metabolica ha un impatto non trascurabile sulla definizione delle strategie preventive e terapeutiche più adeguate a tenere sotto controllo sia gli aspetti di rischio cardiovascolare che lo scarso controllo del profilo glucidico e lipidico; è quindi evidente come nella gestione di questo paziente si debbano prendere in considerazione le varie condizioni cardiovascolari e metaboliche e le loro rispettive interazioni, impostando un trattamento antipertensivo che sia rispettoso del profilo lipidico e glucidico del paziente e che tenga conto della difficoltà nel portare a target la pressione arteriosa in questi pazienti (2).
Tra le classi di farmaci raccomandati come strategie di prima scelta nei pazienti ipertesi – nonché nella maggioranza dei pazienti affetti da malattie cardiovascolari – vanno annoverati i farmaci inibitori del SRAA ed in particolare quelli che agiscono su ACE, gli ACE inibitori (ACEi). Storicamente, il primo farmaco ACEi introdotto in commercio per il trattamento dell’ipertensione è stato il captopril, nel 1980, seguito rapidamente da numerosi altri quali enalapril, perindopril, lisinopril, ramipril, quinapril, benazepril, cilazapril, trandolapril, fosinopril, moexipril, imidapril e zofenopril (Figura 3) (17,18).
Tutti differiscono nel profilo farmacologico per struttura, affinità tissutale e capacità di protezione d’organo; le caratteristiche farmacocinetiche e farmacodinamiche, come affinità, potenza, lipofilia e ritenzione tissutale, influenzano la durata e l’intensità dell’effetto preventivo cardiovascolare (18,19). Dal punto di vista strutturale, una delle peculiarità di maggiore interesse è la presenza o meno nella molecola degli ACEi di radicali sulfidrilici, i quali assicurano una serie di proprietà farmacologiche che contribuiscono alla unicità del meccanismo d’azione ed allo specifico profilo di efficacia clinica, tipici di captopril e, fra gli ACEi di terza generazione, zofenopril. Le caratteristiche farmacologiche e la presenza del gruppo –SH consentono a zofenopril di esercitare, oltre all’azione antipertensiva, anche effetti antiossidanti, di migliorare la funzione endoteliale a livello vascolare e di rallentare la progressione della placca aterosclerotica nel soggetto iperteso (20–23).
I meccanismi ipotensivi mediati dall’inibizione di ACE e quelli antiossidanti e anti-aterogeni, mediati dall’H2S, si traducono in una elevata capacità di protezione vasculo-endoteliale e del danno cardiaco; questi aspetti sono di fondamentale rilevanza soprattutto nei pazienti in cui tale processo è più attivo e cioè in coloro che associano la presenza di ipertensione con fattori di rischio concomitanti, soprattutto se di natura metabolica. Zofenopril, infatti, presenta un’efficacia terapeutica, ampiamente dimostrata, nel trattamento di condizioni a rischio complesso come l’ipertensione arteriosa (24–30), ma anche nell’infarto miocardico acuto (31–33), anche quando complicato da scompenso cardiaco (34,35), con un impatto preferenziale nei pazienti con fenotipi caratterizzati da un profilo di rischio dismetabolico e pro-aterogeno, come soggetti dislipidemici, diabetici o più generalmente affetti da sindrome metabolica (14,15,24–36).
Analisi post-hoc dello studio SMILE (che ha arruolato pazienti con infarto miocardico) hanno rivelato che il trattamento di 6 settimane con zofenopril risultava in una riduzione della pressione arteriosa sistolica e diastolica significativamente maggiore nei pazienti con sindrome metabolica rispetto a quelli senza sindrome metabolica. Inoltre, è interessante notare che la riduzione di morbilità e mortalità osservata in queste analisi post-hoc si è dimostrata in gran parte indipendente dalla riduzione della pressione arteriosa, suggerendo che zofenopril possa influenzare la prognosi dei pazienti con sindrome metabolica oltre e al di là del suo effetto emodinamico.
3 Zofenopril: farmacologia e razionale d’uso
3.1 Il ruolo del gruppo sulfidrilico
Zofenopril è un profarmaco, la cui forma attiva, denominata zofenoprilato, è un ACEi con una spiccata lipofilia, caratteristica che alla molecola conferisce una penetrazione persistente a livello tissutale ed un prolungato effetto di inibizione dell’enzima di conversione sia a livello circolante che a livello tissutale (20). L’idrolisi di zofenopril a zofenoprilato permette di esporre un gruppo –SH (Figura 4); questo tiolo libero (–SH) ha portato ad ipotizzare che zofenoprilato potesse agire come un donatore di H2S.
L’idrogeno solforato è considerato il terzo “gasotransmitter”, l’ultimo identificato dopo il monossido di carbonio (CO) e l’ossido nitrico (NO); queste piccole molecole svolgono un ruolo importante nella regolazione della omeostasi cellulare e svolgono un ruolo in vari processi, tra cui l’infiammazione e le malattie cardiovascolari (23,37). L’H2S, recentemente riconosciuto come regolatore fisiologico del sistema vascolare, svolge un ruolo chiave nel controllo della proliferazione, apoptosi e autofagia delle cellule endoteliali dei vasi, oltre a regolare il tono vascolare. Numerose evidenze scientifiche indicano che una ridotta attività del pathway dell’H2S è coinvolta nella patogenesi di diverse malattie vascolari, tra cui ipertensione e aterosclerosi (23,37). Al contrario, la somministrazione di H2S potrebbe rappresentare un’importante strategia preventiva contro la progressione di queste patologie, grazie alla sua capacità di regolare il tono vascolare, inibire l’infiammazione, contrastare lo stress ossidativo e la proliferazione cellulare, oltre a modulare l’apoptosi delle cellule vascolari; questi effetti sono stati dimostrati in esperimenti su modelli animali, cellulari e persino in studi clinici (23). La dimostrazione della capacità di zofenopril di favorire il rilascio di H2S a livello arterioso e cardiaco ha aperto ad una ulteriore area di sviluppo per la interpretazione dell’efficacia cardio e vasculo-protettiva di zofenopril (38–41). In particolare, è stato dimostrato in ratti spontaneamente ipertesi che zofenopril, a differenza di enalapril, è in grado di aumentare i livelli di H2S sia nei tessuti che nel plasma, favorendo la vasodilatazione indotta da L-cisteina e acetilcolina tramite un effetto additivo che non dipende dall’inibizione di ACE; la vasodilatazione dell’endotelio mediata da zofenopril, infatti, eccede significativamente quella di un tipico ACEi come enalapril sia a livello aortico che carotideo (Figura 5) (42). I meccanismi attraverso i quali l’H2S induce vasodilatazione sono complessi e includono la riduzione dello stress ossidativo e dell’infiammazione, la modulazione della funzione immunitaria e dei canali ionici, oltre all’inibizione della deposizione di collagene e del rimodellamento vascolare (23,39–41).
3.1.1 Azione antiossidante, anti-aterogena e vasculo-protettiva
L’aumento dei livelli circolanti e tissutali di H2S assume particolare rilevanza in relazione alla sua attività antiossidante e alle relative ricadute sull’endotelio vascolare. Studi di confronto diretto hanno dimostrato come l’effetto antiossidante di zofenopril ecceda quello osservato per altre molecole non sulfidriliche della stessa classe (Figura 6) (36,39–41).
L’H2S stimola infatti la sintesi di glutatione, contribuendo a limitare la perossidazione lipidica e a potenziare le capacità antiossidanti, con effetti favorevoli sulla protezione cardiovascolare. Zofenoprfil, nello specifico, pur non essendo in grado di agire direttamente sui livelli lipidici plasmatici, è in grado di ridurre lo stato di ossidazione del colesterolo, e contribuisce a rallentare la progressione delle lesioni aterosclerotiche come dimostrato in studi clinici e preclinici (22,36,41,41,43–45).
Uno studio con follow-up a lungo termine (5 anni) ha randomizzato due gruppi di pazienti con nuova diagnosi di ipertensione al trattamento con enalapril o zofenopril. Le misurazioni dello spessore medio-intimale di entrambe le carotidi fino a 5 anni hanno evidenziato, a parità di effetto antipertensivo, una riduzione significativa nel gruppo trattato con zofenopril, ma non nel gruppo trattato con enalapril, supportando la maggior efficacia di zofenopril nel rallentamento della progressione della aterosclerosi; inoltre, tale beneficio è stato accompagnato da un profilo favorevole di rilascio di ossido nitrico e riduzione dello stress ossidativo nel gruppo zofenopril (36).
Zofenopril è anche in grado di ridurre la iperplasia vascolare, come mostrato in un modello genetico di stenosi carotidea (Figura 7) (46). La malattia aterosclerotica è infatti in grado di determinare modifiche della struttura della parete arteriosa, che a loro volta condizionano lo sviluppo di complicanze trombotiche tipiche del danno endoteliale. L’effetto protettivo di zofenopril verso l’iperplasia risulta significativamente maggiore quando confrontato con enalapril, contribuendo in maniera significativa al rallentamento di un meccanismo patologico nei pazienti a rischio di malattia aterosclerotica (46).
Il rallentamento della progressione della malattia aterosclerotica rappresenta un passaggio fondamentale e imprescindibile nella protezione dalle malattie cardiovascolari sia in termini di prevenzione primaria (es., pazienti ipertesi) che secondaria (es., pazienti post-infartuali) (2,12). In quest’ottica, la capacità di un farmaco di inibire l’ACE e contemporaneamente determinare un’azione vasculoprotettiva diretta, rappresenta la base per una efficacia globale della quale il controllo della pressione arteriosa e il rallentamento dell’aterosclerosi rappresentano fattori additivi, sinergici e indipendenti. Inoltre, la maggiore affinità di zofenopril per l’ACE cardiaco rispetto ad altri ACEi (47) può condizionare una minore progressione della malattia aterosclerotica di fondo che giustifica la rapidità di comparsa dell’effetto cardioprotettivo osservata nei pazienti dello studio SMILE e nei numerosi modelli sperimentarli nei quali la efficacia antiaterogena di zofenopril è stata valutata (36,39,41,48).
4 Conclusioni
Zofenopril rappresenta un’opzione terapeutica di particolare rilievo nel trattamento dell’ipertensione arteriosa, un fattore di rischio cardine nelle malattie cardiovascolari e metaboliche. Oltre a garantire un’efficacia antipertensiva comparabile ad altri ACE-inibitori, zofenopril si distingue per il suo unico profilo farmacologico legato alla presenza del gruppo sulfidrilico, che risulta nel rilascio di H₂S. Questo meccanismo contribuisce non solo al controllo pressorio in aggiunta all’inibizione dell’ACE, ma anche a significativi effetti antiossidanti e cardioprotettivi, riducendo lo stress ossidativo lipidico, rallentando la progressione dell’aterosclerosi e proteggendo l’endotelio vascolare e cardiaco.
Grazie a queste caratteristiche, supportate da ampie evidenze cliniche e precliniche, zofenopril può offrire benefici particolarmente rilevanti nei pazienti ipertesi con comorbidità metaboliche come dislipidemia, obesità e diabete, contribuendo a ridurre il rischio cardiovascolare globale.
Bibliografia
- World Health Organization. Global report on hypertension: the race against a silent killer [Internet]. Geneve; 2023 Sep [cited 2024 Nov 12]. Available from: https://www.who.int/publications/i/item/9789240081062.
- Mancia G, Kreutz R, Brunström M, Burnier M, Grassi G, Januszewicz A, et al. 2023 ESH Guidelines for the management of arterial hypertension The Task Force for the management of arterial hypertension of the European Society of Hypertension. J Hypertens. 2023 Dec;41(12):1874–2071.
- Dzau VJ, Antman EM, Black HR, Hayes DL, Manson JE, Plutzky J, et al. The Cardiovascular Disease Continuum Validated: Clinical Evidence of Improved Patient Outcomes. Circulation. 2006 Dec 19;114(25):2850–70.
- Werner C, Baumhäkel M, Teo KK, Schmieder R, Mann J, Unger T, et al. RAS blockade with ARB and ACE inhibitors: current perspective on rationale and patient selection. Clinical Research in Cardiology. 2008 Jul 3;97(7):418–31.
- Eckel RH, Grundy SM, Zimmet PZ. The metabolic syndrome. The Lancet. 2005 Apr;365(9468):1415–28.
- Hunt KJ, Resendez RG, Williams K, Haffner SM, Stern MP. National Cholesterol Education Program Versus World Health Organization Metabolic Syndrome in Relation to All-Cause and Cardiovascular Mortality in the San Antonio Heart Study. Circulation. 2004 Sep 7;110(10):1251–7.
- Lakka HM. The Metabolic Syndrome and Total and Cardiovascular Disease Mortality in Middle-aged Men. JAMA. 2002 Dec 4;288(21):2709.
- Isomaa B, Almgren P, Tuomi T, Forsén B, Lahti K, Nissén M, et al. Cardiovascular Morbidity and Mortality Associated With the Metabolic Syndrome. Diabetes Care. 2001 Apr 1;24(4):683–9.
- Hu G. Prevalence of the Metabolic Syndrome and Its Relation to All-Cause and Cardiovascular Mortality in Nondiabetic European Men and Women. Arch Intern Med. 2004 May 24;164(10):1066.
- Ford ES, Giles WH, Dietz WH. Prevalence of the Metabolic Syndrome Among US Adults. JAMA. 2002 Jan 16;287(3):356.
- Lamarche B, Tchernof A, Moorjani S, Cantin B, Dagenais GR, Lupien PJ, et al. Small, Dense Low-Density Lipoprotein Particles as a Predictor of the Risk of Ischemic Heart Disease in Men. Circulation. 1997 Jan 7;95(1):69–75.
- Grundy SM. Hypertriglyceridemia, Atherogenic Dyslipidemia, and the Metabolic Syndrome. Am J Cardiol. 1998 Feb;81(4):18B-25B.
- Onat A, Avcı GŞ, Barlan MM, Uyarel H, Uzunlar B, Sansoy V. Measures of abdominal obesity assessed for visceral adiposity and relation to coronary risk. Int J Obes. 2004 Aug 15;28(8):1018–25.
- Omboni S, Malacco E, Parati G. Zofenopril Plus Hydrochlorothiazide Fixed Combination in the Treatment of Hypertension and Associated Clinical Conditions. Cardiovasc Ther. 2009 Dec 9;27(4):275–88.
- Malacco E, Omboni S. Antihypertensive efficacy of zofenopril plus hydrochlorothiazide fixed combination for treatment in metabolic syndrome. Adv Ther. 2007 Sep;24(5):1006–15.
- Alexander RW. President’s address. Common mechanisms of multiple diseases: why vegetables and exercise are good for you. Trans Am Clin Climatol Assoc. 2010;121:1–20.
- Laurent S. Antihypertensive drugs. Pharmacol Res. 2017 Oct;124:116–25.
- Popović MR, Popović G V., Agbaba DD. The Effects of Anionic, Cationic, and Nonionic Surfactants on Acid–Base Equilibria of ACE Inhibitors. J Chem Eng Data. 2013 Sep 12;58(9):2567–73.
- Piepho RW. Overview of the angiotensin-converting-enzyme inhibitors. American Journal of Health-System Pharmacy. 2000 Oct 1;57(suppl_1):S3–7.
- Borghi C, Bacchelli S, Degli Esposti D, Ambrosioni E. A review of the angiotensin-converting enzyme inhibitor, zofenopril, in the treatment of cardiovascular diseases. Expert Opin Pharmacother. 2004 Sep 25;5(9):1965–77.
- PASINI A, GARBIN U, NAVA M, STRANIERI C, PELLEGRINI M, BOCCIOLETTI V, et al. Effect of Sulfhydryl and non-Sulfhydryl Angiotensin-Converting Enzyme Inhibitors on Endothelial Function in Essential Hypertensive Patients. Am J Hypertens. 2007 Apr;20(4):443–50.
- Evangelista S, Manzini S. Antioxidant and Cardioprotective Properties of the Sulphydryl Angiotensinconverting Enzyme Inhibitor Zofenopril. Journal of International Medical Research. 2005 Feb 1;33(1):42–54.
- Lv B, Chen S, Tang C, Jin H, Du J, Huang Y. Hydrogen sulfide and vascular regulation – An update. J Adv Res. 2021 Jan;27:85–97.
- Nilsson P. Antihypertensive efficacy of zofenopril compared with atenolol in patients with mild to moderate hypertension. Blood Press. 2007 Jan 8;16(sup2):25–30.
- Farsang C. Blood pressure control and response rates with zofenopril compared with amlodipine in hypertensive patients. Blood Press. 2007 Jan 8;16(sup2):19–24.
- Lacourciere Y, Provencher P. Comparative effects of zofenopril and hydrochlorothiazide on office and ambulatory blood pressures in mild to moderate essential hypertension. Br J Clin Pharmacol. 1989 Mar 26;27(3):371–6.
- Mallion J. An evaluation of the initial and long‐term antihypertensive efficacy of zofenopril compared with enalapril in mild to moderate hypertension. Blood Press. 2007 Jan 8;16(sup2):13–8.
- Malacco E, Piazza S, Omboni S. Zofenopril versus Lisinopril in the Treatment of Essential Hypertension in Elderly Patients. Clin Drug Investig. 2005;25(3):175–82.
- Narkiewicz K. Comparison of home and office blood pressure in hypertensive patients treated with zofenopril or losartan. Blood Press. 2007 Jan 8;16(sup2):7–12.
- Leonetti G, Rappelli A, Omboni S, on Behalf of the Study Group. A similar 24‐h blood pressure control is obtained by zofenopril and candesartan in primary hypertensive patients. Blood Press. 2006 Jan 8;15(sup1):18–26.
- Borghi C, Ambrosioni E. Double-blind comparison between zofenopril and lisinopril in patients with acute myocardial infarction: Results of the Survival of Myocardial Infarction Long-term Evaluation-2 (SMILE-2) study. Am Heart J. 2003 Jan;145(1):80–7.
- Borghi C, Bacchelli S, Esposti D, Bignamini A, Magnani B, Ambrosioni E. Effects of the administration of an angiotensin-converting enzyme inhibitor during the acute phase of myocardial infarction in patients with arterial hypertension. Am J Hypertens. 1999 Jul;12(7):665–72.
- Borghi C, Bacchelli S, Esposti DD, Ambrosioni E. Effects of the Early ACE Inhibition in Diabetic Nonthrombolyzed Patients With Anterior Acute Myocardial Infarction. Diabetes Care. 2003 Jun 1;26(6):1862–8.
- KELBAeK H, AGNER E, WROBLEWSKI H, MADSEN P V., MARVING J. Angiotensin converting enzyme inhibition at rest and during exercise in congestive heart failure. Eur Heart J. 1993 May 1;14(5):692–5.
- Binkley PF, Haas GJ, Starling RC, Nunziata E, Hatton PA, Leier C V., et al. Sustained augmentation of parasympathetic tone with angiotensin-converting enzyme inhibition in patients with congestive heart failure. J Am Coll Cardiol. 1993 Mar;21(3):655–61.
- Napoli C, Bruzzese G, Ignarro LJ, Crimi E, de Nigris F, Williams-Ignarro S, et al. Long-term treatment with sulfhydryl angiotensin-converting enzyme inhibition reduces carotid intima-media thickening and improves the nitric oxide/oxidative stress pathways in newly diagnosed patients with mild to moderate primary hypertension. Am Heart J. 2008 Dec;156(6):1154.e1-1154.e8.
- Hendriks KD, Maassen H, van Dijk PR, Henning RH, van Goor H, Hillebrands JL. Gasotransmitters in health and disease: a mitochondria-centered view. Curr Opin Pharmacol. 2019 Apr;45:87–93.
- Meng G, Xiao Y, Ma Y, Tang X, Xie L, Liu J, et al. Hydrogen Sulfide Regulates Krüppel‐Like Factor 5 Transcription Activity via Specificity Protein 1 S‐Sulfhydration at Cys664 to Prevent Myocardial Hypertrophy. J Am Heart Assoc. 2016 Sep;5(9).
- Napoli C, Sica V, de Nigris F, Pignalosa O, Condorelli M, Ignarro LJ, et al. Sulfhydryl angiotensin-converting enzyme inhibition induces sustained reduction of systemic oxidative stress and improves the nitric oxide pathway in patients with essential hypertension. Am Heart J. 2004 Jul;148(1):172.
- Chopra M, Beswick H, Clapperton M, Dargie HJ, Smith WE, McMurray J. Antioxidant Effects of Angiotensin-Converting Enzyme (ACE) Inhibitors: Free Radical and Oxidant Scavenging are Sulfhydryl Dependent, but Lipid Peroxidation is Inhibited by Both Sulfhydryl- and Nonsulfhydryl-Containing ACE Inhibitors. J Cardiovasc Pharmacol. 1992 Mar;19(3):330–40.
- Napoli C, Cicala C, D’Armiento FP, Roviezzo F, Somma P, de Nigris F, et al. Beneficial effects of ACE-inhibition with zofenopril on plaque formation and low-density lipoprotein oxidation in watanabe heritable hyperlipidemic rabbits. General Pharmacology: The Vascular System. 1999 Dec;33(6):467–77.
- Bucci M, Vellecco V, Cantalupo A, Brancaleone V, Zhou Z, Evangelista S, et al. Hydrogen sulfide accounts for the peripheral vascular effects of zofenopril independently of ACE inhibition. Cardiovasc Res. 2014 Apr 1;102(1):138–47.
- Lacourciere Y, Gagne C. Influence of Zofenopril and Low Doses of Hydrochlorothiazide on Plasma Lipoproteins in Patients With Mild to Moderate Essential Hypertension [Internet]. 1989. Available from: https://academic.oup.com/ajh/article/2/11_Pt_1/861/172434
- Napoli C, Sica V, De Nigris F, Pignalosa O, Condorelli M, Ignarro LJ, et al. Sulfhydryl angiotensin-converting enzyme inhibition induces sustained reduction of systemic oxidative stress and improves the nitric oxide pathway in patients with essential hypertension. Am Heart J. 2004 Jul;148(1):172.
- Napoli C, Bruzzese G, Ignarro LJ, Crimi E, de Nigris F, Williams-Ignarro S, et al. Long-term treatment with sulfhydryl angiotensin-converting enzyme inhibition reduces carotid intima-media thickening and improves the nitric oxide/oxidative stress pathways in newly diagnosed patients with mild to moderate primary hypertension. Am Heart J. 2008 Dec;156(6):1154.e1-1154.e8.
- Macabrey D, Deslarzes-Dubuis C, Longchamp A, Lambelet M, Ozaki CK, Corpataux JM, et al. Hydrogen Sulphide Release via the Angiotensin Converting Enzyme Inhibitor Zofenopril Prevents Intimal Hyperplasia in Human Vein Segments and in a Mouse Model of Carotid Artery Stenosis. European Journal of Vascular and Endovascular Surgery. 2022 Feb;63(2):336–46.
- Cushman D, Wang F, Fung W, Grover G, Harvey C, Scalese R, et al. Comparisons in vitro, ex vivo, and in vivo of the actions of seven structurally diverse inhibitors of angiotensin converting enzyme (ACE). Br J Clin Pharmacol. 1989 Jan 26;28(S2).
- Borghi C. Effects of early treatment with zofenopril in patients with myocardial infarction and metabolic syndrome: the SMILE Study. Vasc Health Risk Manag. 2008 Jun;Volume 4:665–71.
Related papers
Lo scenario della medicina attuale è caratterizzato da elementi di complessità generale inimmaginabili due decenni fa ed in grado di rendere molto più difficile la pratica clinica giornaliera. In particolare, la coesistenza di multiple condizioni passibili di un trattamento farmacologico nello stesso soggetto condiziona in maniera forzata alcune delle scelte terapeutiche spingendo alla ricerca di [more info]
Premessa Nell’ultimo decennio l’orizzonte della terapia ipolipemizzante si è arricchita di formidabili strumenti terapeutici quali ezitimibe, inibitori della proteina PCSK9 (PCSK9i) e acido bempedoico. Gli studi su queste molecole hanno permesso non solo di dimostrarne l’efficacia, ma hanno fornito importanti informazioni sull’importanza dell’abbassamento delle LDL nella riduzione del rischio cardiovascolare (CV) e costituiscono la base [more info]
Colesterolemia subottimale come fattore di rischio per le malattie cardiovascolari Il miglioramento delle abitudini alimentari e l’ottimizzazione dei livelli di colesterolo LDL nel sangue – fattore causale e cumulativo - sembrano essere strumenti efficaci per ridurre il rischio di malattie cardiovascolari su base aterosclerotica, che ancora oggi rappresentano una delle principali cause di morte e [more info]