Abstract
L’obesità è una malattia cronica multifattoriale caratterizzata da eccessivo accumulo di adipe spesso a distribuzione viscerale, che porta a numerose conseguenze cardio-metaboliche, tra cui l’aumento dei valori di pressione arteriosa sistemica. Considerare l’obesità non solo come fattore di rischio, ma come elemento centrale all’origine di numerose malattie metaboliche, cardiovascolari e renali, permette di superare l’approccio settoriale delle patologie legate all’obesità. Una visione “adipocentrica” trova il proprio fulcro nel trattamento del sovrappeso/obesità viscerale e nella gestione integrata del paziente, al fine di evitare complicanze cliniche e ridurre morbilità e mortalità obesità-correlate. Insieme alle terapie farmacologiche per l’ipertensione arteriosa, nel panorama terapeutico per la riduzione del peso corporeo, accanto all’orlistat e all’associazione bupropione/naltrexone, si sono aggiunti recentemente gli agonisti del recettore del peptide-1 simile al glucagone (GLP1-RA), come liraglutide e semaglutide. Questi farmaci, inizialmente considerati solo per il trattamento del diabete mellito di tipo 2 (DMT2), sono attualmente utilizzati in molti pazienti in sovrappeso con adiposità viscerale o obesi, mostrando numerosi effetti positivi anche in assenza di DMT2. Anche gli inibitori del co-trasportatore sodio-glucosio di tipo 2 (SGLT2-i) stanno rivoluzionando la gestione del DMT2 e dell’obesità, nonché la protezione cardio-renale anche in assenza di DMT2. Entrambe queste classi di farmaci si integrano in maniera ottimale con le varie tipologie di anti-ipertensivi. Sulla base dei recenti progressi della ricerca di base e clinica sull’adiposità e sulla base delle nuove terapie disponibili, questa rassegna intende contribuire a un nuovo approccio clinico concettuale, con approfondimenti fisiopatologici e terapeutici, considerando l’ipertensione arteriosa essenziale come una complicanza spesso direttamente correlata all’eccesso di adipe e agli associati pattern alimentari.
Parole chiave: Obesità, sovrappeso, adiposità viscerale, adipocentricità, ipertensione, agonisti recettore GLP-1, inibitori SGLT-2, cardiometabolico, eventi cardiovascolari.
Introduzione
Il termine “adipocentricità” viene coniato per identificare un denominatore comune, nonché primum movens, di condizioni cardio-metaboliche altamente prevalenti, rappresentato dall’obesità, soprattutto di tipo viscerale. L’obesità è una condizione patologica cronica multifattoriale che si contraddistingue per l’eccesso di tessuto adiposo. L’Organizzazione Mondiale della Sanità (OMS) la definisce sulla base di un indice di massa corporea (body mass index, BMI) uguale o superiore a 30 kg/m2 (1). Dalla metà degli anni ‘70 ai giorni nostri, l’incidenza mondiale di sovrappeso (BMI ≥ 25 kg/m2) e obesità è quasi triplicata. Circa il 36% degli adulti a livello globale (1,9 miliardi di individui) risulta in sovrappeso, mentre oltre il 13% (650 milioni di individui) risulta obesa (2). Dalle stime elaborate dall’OMS, entro il 2025 il 18% degli uomini e il 21% delle donne sarà obeso, mentre il 40% della popolazione mondiale sarà in sovrappeso (3). Nel caso specifico dell’Italia, almeno una persona su dieci è obesa e complessivamente il 45% degli individui con età > 18 anni è in sovrappeso (4). In un recente studio veniva evidenziato come quasi quattro milioni di morti all’anno a livello globale siano correlati direttamente all’obesità e alle sue complicanze cardiovascolari (5). In particolare, l’obesità rappresenta il fattore più comune e frequente per lo sviluppo dell’ipertensione arteriosa essenziale (IAE). Si stima che almeno un 75% dei casi di ipertensione arteriosa possa essere attribuibile al fenotipo sovrappeso/obesità soprattutto quando coesiste una predisposizione genetica (6). Numerosi fattori genetici, ambientali-sociali ed anche comportamentali hanno portato contemporaneamente non solo alla nota “epidemia di obesità”, ma anche all’aumentata prevalenza dell’IAE, più che duplicata dal 1990 al 2019, arrivando a colpire 626 milioni di donne e 652 milioni di uomini nel 2019 (7). Si stima che l’ipertensione affligga il 33% degli adulti di età compresa tra 30 e 79 anni in tutto il mondo (stima standardizzata per età) (8). A livello globale, la prevalenza dell’ipertensione è leggermente superiore nel sesso maschile (34%) rispetto a quello femminile (32%). Il numero di adulti con ipertensione è raddoppiato, passando da 650 milioni nel 1990 a 1,3 miliardi nel 2019 (9). La prevalenza di ipertensione arteriosa è sensibilmente maggiore nei pazienti in sovrappeso o obesi rispetto ai pazienti normopeso, a causa dell’alterazione di diversi meccanismi e circuiti neuroumorali e metabolici, in particolare la disregolazione del sistema nervoso simpatico (SNS), del sistema renina-angiotensina-aldosterone (SRAA) e del sistema dei peptidi natriuretici cardiaci (SPNC) che, associati a predisposizione genetica, a fattori ambientali e ad abitudini di vita, contribuiscono all’aumento dei valori pressori in tali individui.
Le principali localizzazioni del tessuto adiposo sono quella sottocutanea e quella viscerale (10). L’obesità definita “centrale” o viscerale si distingue per accumulo di adipe in eccesso a livello intraddominale, mediastinico, epicardico, nelle regioni del collo e nella lingua, con infiltrazioni intraparenchimali come quella cardiaca e renale. È un tessuto adiposo diffuso che accompagna i vasi sanguigni e circonda e infiltra organi e muscoli scheletrici. Questo genere di obesità è quella maggiormente associata ad ipertensione arteriosa (sia diurna che notturna), ad aritmie, a dislipidemia, a steatosi epatica, a sindrome metabolica, ad insulino-resistenza, a prediabete e DMT2, e infine ad un aumento di eventi cardiovascolari (sopratutto ictus e scompenso cardiaco ma anche cardiopatia ischemica) (11–15). Il rischio di scompenso cardiaco a frazione di eiezione preservata, di aritmie quali fibrillazione atriale e aritmie ventricolari, di patologie a carico dell’apparato respiratorio e di mortalità per tutte le cause risulta nettamente aumentato negli obesi (16). L’obesità rappresenta un fattore di rischio cardiovascolare indipendente (17) e circa il 60% dei decessi per cause cardiovascolari sono registrate in soggetti obesi (5). Il danno diffuso ai piccoli vasi del microcircolo (arteriolosclerosi) ed ai grandi vasi (arteriosclerosi), caratteristico dell’aumento cronico della pressione arteriosa che accompagna l’obesità viscerale e la presenza di accelerata aterosclerosi determinante placche “instabili” prone a complicanze quali trombosi e trombo-embolie arteriose, sono alla base delle note e più comuni patologie cardiovascolari di questi pazienti.
Da quanto sopra riportato, consegue l’importanza di riconoscere la natura “adipocentrica” dei comuni fattori di rischio metabolici e cardiovascolari citati. Da notare come anche solo un lieve sovrappeso, quando associato ad “obesità viscerale”, possa comportare conseguenze identiche a quelle riscontrabili nell’obesità conclamata. Vi è consapevolezza dalla fine degli anni ’80 della “sindrome metabolica”, incentrata proprio sull’obesità centrale e sulle associate alterazioni metaboliche e cardiovascolari, e nel 2009 è stato pubblicato un documento di consenso internazionale sull’argomento (18). Questa ampia rassegna “concettuale” si focalizza sul ruolo dell’eccesso di adiposità, specie viscerale, nel determinare lo sviluppo dell’IAE e il suo ulteriore ruolo nello sviluppo delle complicanze cardiovascolari. Si approfondirà anche sulle nuove opportunità terapeutiche nel trattamento dell’eccesso di adipe, condizione spesso sottovalutata in ambito clinico, dove per troppi anni ci si è solamente concentrati sulle conseguenze della stessa, spesso senza nemmeno realizzare che erano appunto conseguenze di una comune condizione sottovalutata anche dal punto di vista fisiopatologico.
Fisiopatologia adipocentrica dell’ipertensione arteriosa
Obesità con pressione arteriosa normale-alta e con ipertensione arteriosa
È stato documentato che oltre all’eccessivo introito calorico, nel paziente obeso iperteso vi sia un eccessivo introito di sale con la dieta, fino ad una media di oltre 10 grammi al giorno, ovvero più del doppio della quantità raccomandata dall’OMS (19,20). Obesità, quindi, è spesso sinonimo anche di dieta inappropriatamente ricca di sale. L’eccesso di adipe si accompagna quindi non solo ad un introito alimentare eccessivo rispetto ai consumi energetici, ma anche alla preferenza di cibi spesso ricchi in sodio e poveri in potassio, altro fattore che influenza la pressione arteriosa riducendola quando è abbondante nella dieta.
L’eccessivo aumento di tessuto adiposo, specie se viscerale, ha molte conseguenze biologiche, tra cui un aumento dei livelli di leptina circolante, che nel paziente obeso ha una minore efficacia a livello ipotalamico nella regolazione di fame e sazietà, mentre si pensa venga mantenuta piena attività di stimolo a livello del SNS e a livello renale (21). Di conseguenza, si assiste ad una cronica iper-attivazione del SNS (22) che contribuisce, assieme alla frequente sedentarietà, all’aumento della frequenza cardiaca e, a livello renale, all’iperfiltrazione glomerulare accoppiata ad un eccessivo riassorbimento tubulare di sodio (23). L’adipe in eccesso favorisce l’aumento dei livelli circolanti di aldosterone tramite adipochine, tra cui l’angiotensinogeno, precursore delle angiotensine, e tramite derivati lipidici legati all’eccesso circolante di lipoproteine a densità molto bassa (VLDL) e i loro remnants ricchi di trigliceridi (24,25). Ne risulta che il paziente obesoiperteso ha spesso un quadro di relativo iperaldosteronismo secondario (in assenza cioè di soppressione della renina), che favorisce l’ulteriore incremento del riassorbimento di sodio a livello del tubulo distale, in un contesto caratterizzato da disregolazione del SRAA. Infatti, nel soggetto obeso iperteso, nonostante una dieta caratterizzata da eccessivo introito di sale, non si assiste alla soppressione dell’attività reninica né dell’attività mineralcorticoide con valori plasmatici “inappropriatamente normali” di renina, di attività reninica e di aldosterone (19,26). In questa tipologia di pazienti è stato anche documentato il fenomeno di “escape” della secrezione di aldosterone dall’attività farmacologica di ACE-inibitori e antagonisti del recettore AT1 dell’angiotensina II (sartani), in relazione fisiopatologica con l’eccesso di adipe (27). Per valutare rapidamente l’inibizione del SRAA e correlarla all’efficacia della terapia con ACE-inibitori o sartani, è stato proposto il rapporto renina plasmatica/aldosterone plasmatico (Renin-to-Aldosterone Ratio, RAR). Tale indice risulta essere il reciproco di quello usato nello screening dell’iperaldosteronismo primitivo (Aldosterone-to-Renin Ratio, ARR). Valori maggiori di RAR si associano a miglior controllo pressorio nelle 24 ore ed in particolare a maggior controllo della pressione arteriosa notturna documentata al monitoraggio ambulatoriale della pressione arteriosa (ABPM) (28). La presenza di RAR elevato è correlato a buona efficacia della terapia con ACE-inibitori o sartani. Il meccanismo d’azione di questi farmaci attraverso l’antagonismo dell’angiotensina-II determina infatti un aumento di renina per riduzione del feedback negativo dell’angiotensina-II sulla secrezione della stessa e una riduzione della secrezione di aldosterone dipendente da una minore produzione di angiotensina II o da blocco del recettore AT1. Un basso RAR, al contrario, può essere dovuto all’assunzione di dosaggi inadeguati di tali farmaci, o può smascherare un’inadeguata aderenza alla terapia, principale causa di ipertensione (pseudo)resistente. Quando si assiste al fenomeno definito “escape” della secrezione di aldosterone è indicato l’utilizzo di un antagonismo dell’angiotensina-II più efficace, ricorrendo in particolare a dosi piene di ACE-inibitori o sartani per garantire una adeguata copertura delle 24 ore, o ad antagonisti dell’aldosterone, come canrenone ed eplerenone, farmaci di scelta nelle vere ipertensioni resistenti, cioè in caso di pazienti non adeguatamente controllati nonostante una triplice terapia con ACE-inibitore o sartano + diuretico tiazidico o tiazidico-simile + calcio antagonista a dosaggi adeguati (11). Evidenze recenti su pazienti obesi, mostrano come il finerenone (un antagonista non steroideo del recettore mineralcorticoide) rallenti la progressione del danno renale e cardiovascolare in pazienti con nefropatia diabetica (29). Sebbene siano stati ipotizzati vari meccanismi, il finerenone agisce principalmente antagonizzando il riassorbimento distale del sodio e riducendo quindi la pressione arteriosa, con conseguente riduzione del rischio di ospedalizzazione per scompenso cardiaco, senza tuttavia ridurre in modo significativo la mortalità per tutte le cause. Nell’analisi combinata del FIDELITY si è evidenziato come il finerenone riduca gli eventi cardio-renali nei pazienti con malattia renale diabetica (30). Tutti i pazienti arruolati assumevano una dose massima tollerata di ACE-inibitori o sartani. Tuttavia, la pressione arteriosa sistolica (PAS) media al basale era di 136,7 ± 14,2 mmHg, mentre dopo 4 mesi dall’inizio dello studio la PAS si era ridotta di 3,2 mmHg rispetto al basale nel gruppo finerenone, mentre era aumentata di 0,5 mmHg nel gruppo placebo, indicando come il finerenone abbia avuto un effetto rilevante sulla riduzione della PAS (-3,7 mmHg vs. placebo).
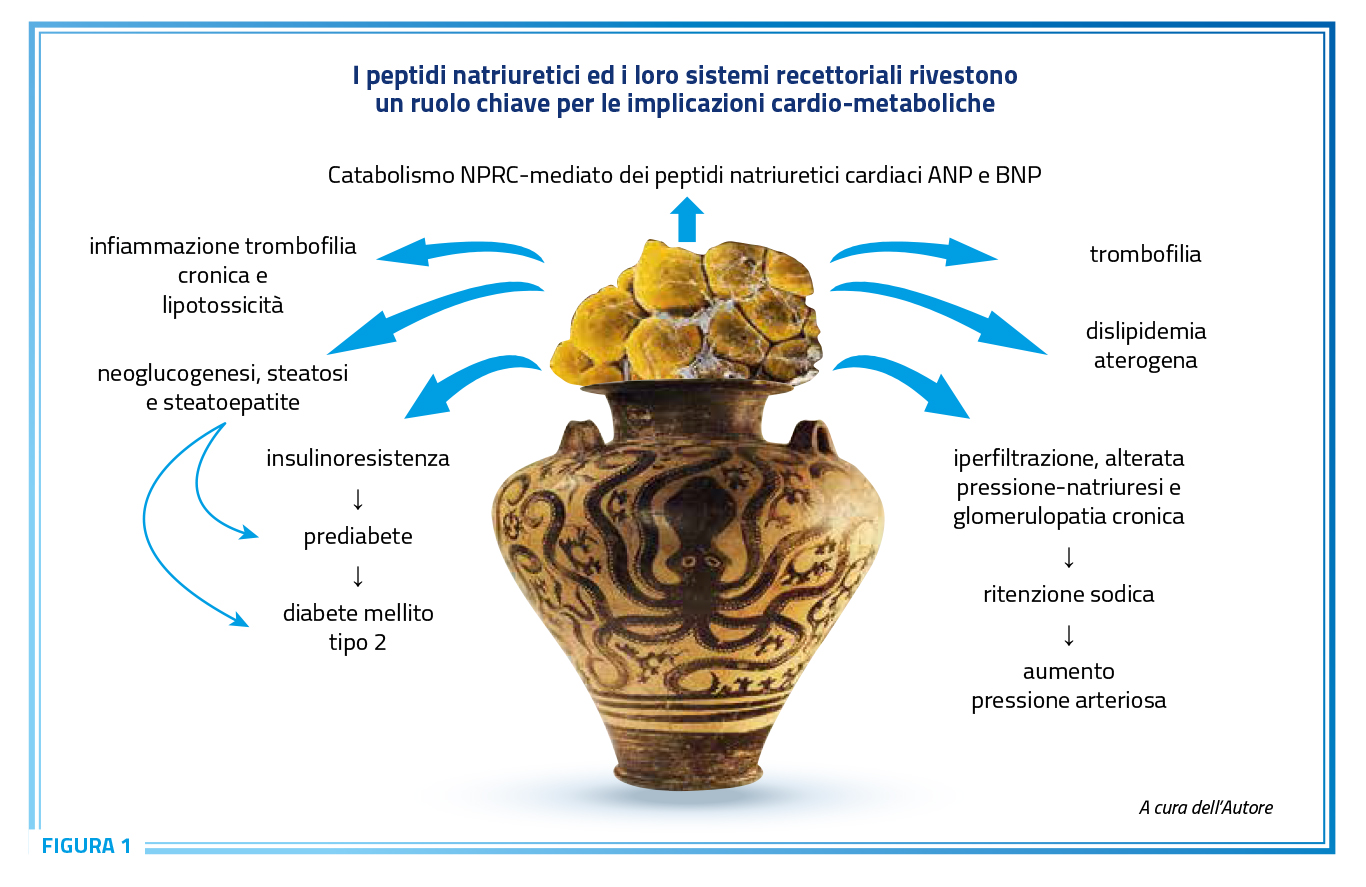
Ulteriore fondamentale meccanismo fisiopatologico caratteristico del paziente obeso è la disregolazione del SPNC, per alterato metabolismo e ridotta azione dei peptidi natriuretici cardiaci (ANP e BNP), che agiscono legandosi al recettore NPRA (generando GMP-ciclico come secondo messaggero), recettore espresso in molti tipi cellulari e organi, tra cui rene, surrene, organo adiposo, cuore e muscolo liscio vasale (31,32). Il ruolo di questi peptidi è quello di inibire e antagonizzare gli effetti del SRAA, in primis a livello renale, determinando aumento della perfusione e natriuresi. Agiscono inoltre inibendo il riassorbimento di sodio a livello del tubulo prossimale similmente agli inibitori del co-trasportatore SGLT2, ma hanno anche azione inibitoria diretta sul riassorbimento del sodio a livello del tubulo distale. Nel distretto vascolare producono una vasodilatazione sia sul versante arterioso che venoso (31). Nei pazienti obesi, l’aumentata clearance di questi peptidi fa sì che i loro livelli plasmatici risultino ridotti rispetto ai pazienti sovrappeso e normopeso, indipendentemente dal sesso (32,33) (Figura 1). Una spiegazione di questo dato sta nell’inferiore rapporto tra recettore NPRA e recettore di clearance dei peptidi natriuretici (NPRC) nel tessuto adiposo di pazienti obesi ipertesi confrontato con il tessuto adiposo di pazienti ipertesi normopeso (34).
Nell’ipertensione obesità-correlata, tali peptidi ed i loro sistemi recettoriali sembrano rivestire un ruolo chiave anche per le implicazioni metaboliche. Infatti, insulina e glucosio determinano uno spiccato aumento dell’espressione di NPRC negli adipociti umani, con conseguente ridotta attività biologica dei peptidi natriuretici, tra le quali spicca la grande efficacia nell’indurre lipolisi e natriuresi (35). Ne consegue che a causa dell’eccessivo apporto calorico con l’alimentazione, specie se a base di cibi o bevande determinanti picchi glicemici e insulinemici, viene favorito l’accumulo di trigliceridi negli adipociti che diventano più ipertrofici e insulino-resistenti, mentre viene ridotto il “browning” dell’adipocita da parte dei peptidi natriuretici, ovvero la trans-differenziazione tra tessuto adiposo bianco e tessuto adiposo beige e bruno, ricco di mitocondri e di “uncoupling protein” (UCP) che facilita la dissipazione di energia sotto forma di calore (36). È stato dimostrato come in pazienti obesi ipertesi trattati con dieta fortemente ipocalorica vi sia uno spiccato aumento di efficacia biologica e clinica di un’infusione di ANP (37). D’altro canto, sia la natriuresi che la diuresi con la riduzione della pressione arteriosa indotta dal digiuno sono almeno in parte il risultato di una spiccata soppressione di NPRC nel tessuto adiposo. Infatti, il digiuno sopprime in maniera tessuto-specifica e gene-specifica l’espressione del gene NPRC nel tessuto adiposo, con conseguente incremento dell’attività biologica dell’ANP. Il drastico decremento dei livelli dell’RNA messaggero di NPRC veniva osservato nel tessuto adiposo bruno e bianco, mentre l’espressione di NPRA nel tessuto adiposo rimaneva costante o tendeva ad aumentare con il digiuno (38). Invece, a livello della corteccia renale, i livelli di RNA messaggero di NPRC e NPRA non sembrano condizionati dal digiuno (39). Pazienti nati con deficit omozigote per il gene codificante NPRC sono generalmente di alta statura, sottopeso e con pressione arteriosa bassa, a conferma del ruolo cardio-metabolico chiave rivestito dai peptidi natriuretici e dal loro metabolismo (40).
Inoltre, a testimonianza dell’importante ruolo rivestito dall’obesità nel ridurre i livelli circolanti di peptidi natriuretici, la Heart Failure Association della Società Europea di Cardiologia (ESC) indica, in un documento di consenso del 2023, di utilizzare una riduzione almeno del 40% del cut-off dei valori di peptidi natriuretici circolanti per fare diagnosi di scompenso cardiaco in pazienti con BMI oltre i 40 kg/m2. Viene invece suggerita una riduzione del 25% per valori di BMI compresi tra 30 e 35 kg/m2 e una riduzione del 30% per valori di BMI compresi tra 35 e 40 kg/m2 (41), sebbene tale approccio non sia stato attualmente ancora validato (42). L’insieme dei meccanismi fisiopatologici sopra descritti è sufficiente anche a spiegare la tendenza alla ritenzione idrosalina nei pazienti obesi, specie di sesso femminile e soprattutto se in menopausa, in cui il comune sintomo riferito come “sensazione di gonfiore” ha quindi anche una reale base fisiopatologica e clinica. Per quanto questa tipologia di pazienti richieda quasi costantemente una terapia diuretica per ottenere un adeguato controllo dei valori pressori, la persistenza di una dieta ricca di sodio e povera di potassio conduce ad aumento della pressione arteriosa e tendenza all’ipokaliemia, che talvolta può presentarsi anche in assenza di terapia diuretica, a causa dell’esaltato riassorbimento tubulare distale di sodio che si associa invariabilmente ad aumentata escrezione di potassio.
Sintesi fisiopatologica dell’obesità nell’adulto e delle complicanze cardio-metaboliche correlate e associate ad aumentata pressione arteriosa
La forma più frequente di obesità è quella definibile come “alimentare-poligenica” (43) dove, ad una predisposizione genetica si somma la componente ambientale e socio-familiare. L’accumulo di tessuto adiposo risulta sempre causato da un bilancio energetico positivo tra “entrate” (calorie introdotte con cibi e bevande) e “uscite” (consumo energetico per metabolismo e attività fisica). Il tessuto adiposo in tale contesto agisce anche come organo endocrino poiché in grado di secernere ormoni e adipochine (quali leptina e adiponectina) come pure proteine e peptidi del SRAA e sequestrare i peptidi natriuretici cardiaci degradandoli (10). Da non sottovalutare è anche la localizzazione del tessuto adiposo. Gli individui con depositi principalmente sottocutanei hanno in genere adipociti più piccoli e ridotte alterazioni metaboliche sistemiche. Alcuni individui hanno infatti elevata capacità di immagazzinare l’eccesso di calorie sotto forma di trigliceridi nell’adipe sottocutaneo, con minori conseguenze metaboliche, e sono spesso definiti obesi “metabolicamente sani”, anche se ciò è di fatto un ossimoro (44,45). Un recente studio ha infatti dimostrato come questi pazienti mostrino in realtà precoce danno cardiaco caratterizzato da aumentato tessuto interstiziale/fibrosi e alterazione della funzione diastolica. Ciò aumenta il rischio di scompenso cardiaco a frazione di eiezione preservata che è tipico del paziente obeso (46).
Il tessuto adiposo viscerale è inoltre un marcatore indipendente di morbilità e mortalità (47). Questo si presenta non solo a livello intra-addominale (mesenterico) ma anche a livello renale (retroperitoneale), del muscolo scheletrico e del muscolo cardiaco (mediastinico). È l’adipe che avvolge i vasi sanguigni e che circonda e infiltra vari organi e muscoli coinvolgendo anche collo e testa non solo l’addome. Gli adipociti localizzati a livello viscerale risultano spesso ipertrofici e probabilmente caratterizzati da una maggior insulino-resistenza. L’ipertrofia con aumento dell’insulino-resistenza e la sofferenza cellulare conducono alla morte di molti di questi adipociti, con richiamo di macrofagi, determinando l’instaurarsi di processi flogistici e fibrotici innescati dalla secrezione di citochine pro-infiammatorie, quali tumor necrosis factor-alfa (TNF-a) e interleuchina-6 (IL-6) (48), con successivo aumento della proteina C reattiva in circolo e quadro di infiammazione cronica di basso grado.
È particolarmente in voga attribuire peculiare importanza al grasso viscerale pericardiaco e perivascolare (49), anche se complessivamente è proprio l’intera quota di adipe viscerale, che caratteristicamente circonda e infiltra i vari organi, a risultare patologico, mentre è al momento praticamente impossibile attribuire un ruolo specifico ad un peculiare deposito viscerale piuttosto che ad un altro, anche per la presenza di dati contrastanti in letteratura. Ad esempio, un recente studio sul tessuto adiposo perivascolare ha mostrato un effetto vasodilatatorio mediato da ossilipine (50). A livello epatico, l’iperinsulinemia e l’insulino-resistenza contribuiscono alla produzione e all’accumulo di trigliceridi anche negli epatociti, determinando steatosi epatica, lipotossicità e steato-epatite non alcolica, caratterizzate comunque da molteplici meccanismi patogenetici (51). Questi quadri epatici sono conosciuti come “non-alcoholic fatty liver disease” (NAFLD) (15) e “non-alcoholic steato-hepatitis” (NASH) e rappresentano un’espressione di danno d’organo della sindrome metabolica che espone indipendentemente ad una maggiore mortalità anche per eventi cardiovascolari (52). Un recente “Consensus Statement” multi-societario la ridefinisce come “metabolic dysfunction-associated steatotic liver disease” (MASLD), associando tale condizione ad almeno uno dei cinque fattori di rischio cardio-metabolici (53). La crescente consapevolezza dell’interrelazione fisiopatologica tra fattori di rischio metabolici come obesità e DMT2, le malattie renali croniche e le malattie cardiovascolari ha portato alla concettualizzazione da parte dell’American Heart Association della sindrome cardiovascolare-nefro-metabolica. La malattia renale cronica (CKD) rappresenta un importante amplificatore del rischio cardiovascolare. I tratti distintivi della CKD, albuminuria e/o ridotta velocità di filtrazione glomerulare (GFR), sono associati a progressivo aumento del rischio di eventi vascolari aterosclerotici, scompenso cardiaco e morte cardiovascolare. Di conseguenza, le cause di morte più comuni negli individui affetti da DMT2 e CKD sono lo scompenso cardiaco e la malattia cardiovascolare aterosclerotica (ASCVD), e solo circa il 10% dei pazienti con CKD sopravvive fino all’insufficienza renale. La CKD provoca anche anemia e disturbi del metabolismo osseo e minerale che aggravano la patologia cardiovascolare. La minore capacità di trasporto dell’ossigeno aumenta la richiesta del miocardio e può peggiorare lo scompenso cardiaco (54).
L’insieme di questi fattori fisiopatologici e delle loro conseguenze cliniche sono alla base del maggior rischio da parte degli obesi di sviluppare problematiche cardiovascolari specie quando coesista un aumento della pressione arteriosa.
Obesità con pre-diabete o diabete mellito di tipo 2: come considerare già iperteso un paziente con la pressione alta-normale e come amplificare i danni da ipertensione arteriosa
Una delle principali complicanze legate all’eccesso di tessuto adiposo è un alterato metabolismo glucidico che in genere progredisce fino al DMT2 conclamato. Il paziente obeso ha un rischio aumentato di 6,7 volte di sviluppare intolleranza glucidica e di 4,9 volte di sviluppare DMT2, ma il rischio reale è probabilmente molto più elevato (55). Nonostante la forte predisposizione genetica poligenica al DMT2, predisposizione spesso associata alla facilità di sviluppare insulino-resistenza, circa il 70-80% dei pazienti non svilupperebbe mai un DMT2 in assenza di sovrappeso e obesità.
L’eccessivo introito calorico, specie in presenza di carente attività fisica, determina diminuzione della sensibilità all’insulina anche tramite la produzione di citochine pro-infiammatorie (TNF-a e IL-6) e riduzione della produzione di adiponectina, adipochina notoriamente ad azione “protettiva” antidiabetica, anti-aterogena e antinfiammatoria. L’eccesso di tessuto adiposo “infiammato” che contribuisce all’insulino-resistenza e al DMT2 rappresenta una “adiposopatia”, vale a dire una condizione di “adipe patologico” (56).
La complessità molecolare dei meccanismi post-recettoriali documentati alla base dell’insulino-resistenza, può essere globalmente “semplificata” e interpretata in modo più “logico” facendo riferimento al continuo eccessivo introito calorico in un contesto di insufficiente consumo, che conduce molti tessuti, tra cui soprattutto quello muscolare scheletrico infarcito di glicogeno e acidi grassi, a mettere in atto dei meccanismi che si oppongono all’entrata di ulteriore glucosio (la probabile vera “logica” cellulare nella genesi dell’insulino-resistenza), perché l’accumulo intracellulare di un eccesso di “combustibile” che non viene utilizzato può risultare nociva per le cellule stesse. Quindi l’insulino-resistenza può essere interpretata anche come un meccanismo di difesa cellulare dall’accumulo di zuccheri e grassi intracellulari.
Oltre ai meccanismi fisiopatologici, per l’instaurarsi della clinica e degli eventi cardiovascolari quello che conta è sempre e comunque il bilancio energetico. Infatti, nel noto studio clinico “Look Ahead”, i pazienti diabetici obesi nel lungo termine ottenevano solo una modica perdita media di peso con le modifiche intensive dello stile di vita, modico calo di peso che non è risultato sufficiente a ridurre l’incidenza di eventi cardiovascolari (end-point primario composito di ricovero per angina, infarto, ictus e morte cardiovascolare) (57). Un’analisi post-hoc dello stesso studio ha tuttavia dimostrato come nella minoranza dei casi in cui si perdeva oltre il 10% del proprio peso corporeo si raggiungesse una significativa riduzione dell’end-point primario (58), documentando come sia necessaria una consistente perdita dell’eccesso di energia immagazzinata negli adipociti sotto forma di trigliceridi per ottenere dei benefici cardiovascolari.
È ben noto, inoltre, come il DMT2 nel paziente sovrappeso/obeso sia preceduto da una fase di “pre-diabete”, che si manifesta in genere con una sindrome metabolica, durante la quale risultano accelerati danno vascolare, aterogenesi e complicanze dell’aterosclerosi, con un netto aumento di incidenza e prevalenza di eventi cardiovascolari in quanto spesso associata anche a pressione arteriosa alta-normale o ad ipertensione conclamata (59). Quindi una pressione arteriosa più elevata è una caratteristica quasi sempre presente nell’eccesso di peso associato a disglicemia. Il pre-diabete, o il DMT2, amplificano nettamente il danno al microcircolo (renale, retinico, cerebrale e cardiaco) che è noto essere alla base del danno cronico negli organi bersaglio dell’ipertensione arteriosa. Ecco perché anche una pressione alta-normale è considerabile già come fosse un’ipertensione arteriosa e può richiedere un intervento farmacologico in condizioni di alterato metabolismo glucidico.
Obesità con dislipidemia: una comune condizione che accompagna valori elevati di pressione arteriosa
In una cospicua percentuale di pazienti obesi, si riscontrano anche aumentati livelli di “remnants” delle VLDL, con aumentato colesterolo aterogeno totale in circolo, complessivamente noto come colesterolo non-HDL. Questo è spiegato sia dall’aumentata sintesi di VLDL che dal loro rallentato catabolismo negli obesi. Gli elevati livelli plasmatici di trigliceridi, tipici dei pazienti obesi, i bassi livelli circolanti di colesterolo HDL e l’aumento della concentrazione del numero di particelle LDL, in genere del tipo più aterogeno e cioè “piccole e dense”, caratterizzano la “triade” della comune dislipidemia aterogena associata al sovrappeso e all’obesità comunemente riscontrata anche nei pazienti ipertesi (60). Siccome gran parte del tessuto adiposo viscerale è drenato da vene confluenti nella vena porta, l’elevato turnover dei trigliceridi con iperlipolisi negli adipociti ipertrofici espone il fegato a maggiori concentrazioni di acidi grassi liberi e glicerolo. Ciò contribuisce ad una alterazione del metabolismo epatico, con aumento della produzione di VLDL ricche in trigliceridi e della produzione di glucosio/glicogeno a livello epatico con associata steatosi epatica. Questo meccanismo contribuisce al collegamento tra adiposità viscerale, steatosi epatica e intolleranza glucidica. Data la comune associazione con una pressione alta-normale o ipertensione arteriosa nel contesto disglicemia/dislipidemia, è ben comprensibile il milieu cronico che facilita il danno macro e microvascolare arterioso, con aumentata incidenza e prevalenza di eventi cardiovascolari in tale contesto dismetabolico chiaramente “adipocentrico”.
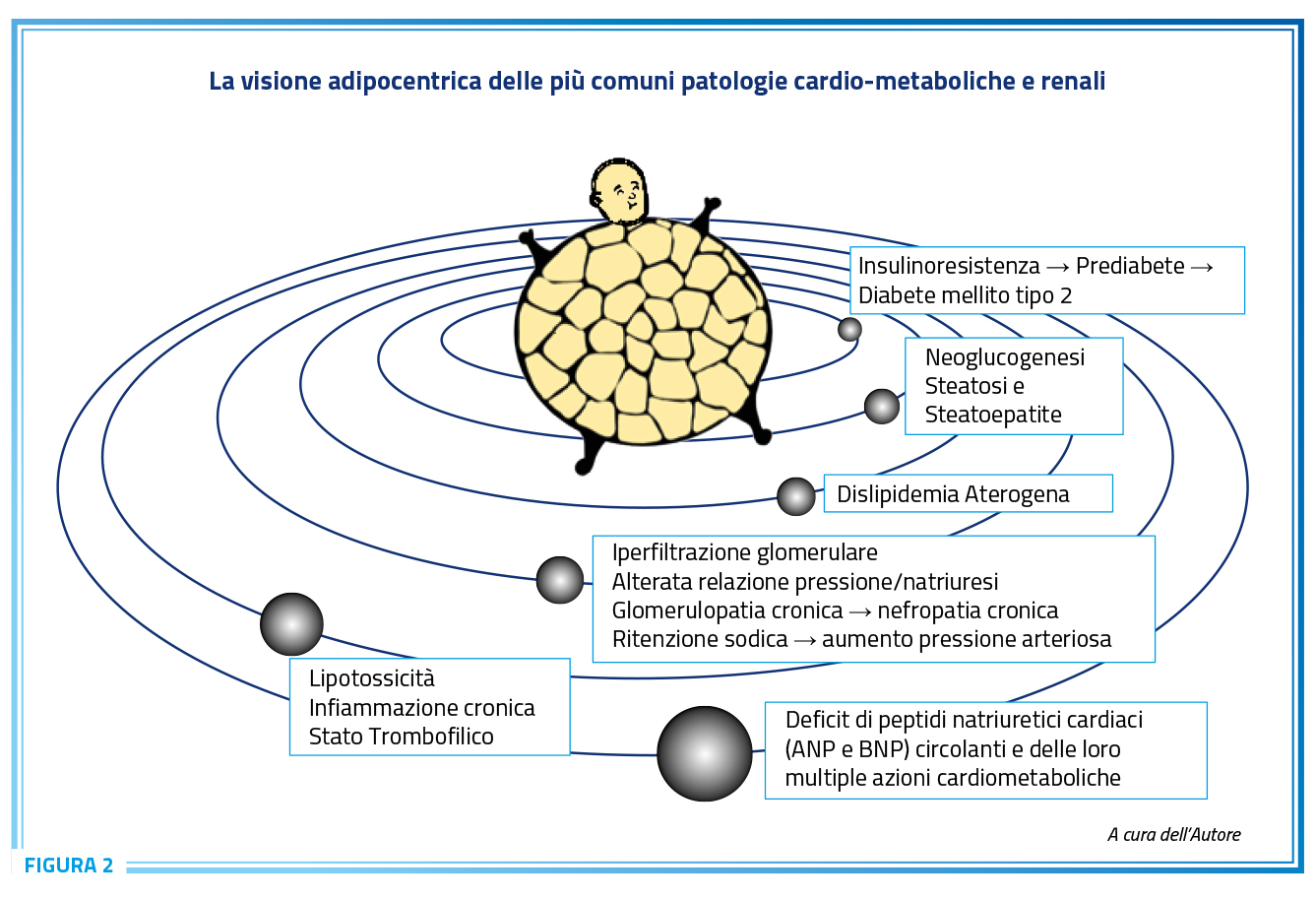
La Figura 2 riassume graficamente quanto finora esposto e le complicanze legate all’eccesso di adipe.
Effetti cardio-metabolici del calo ponderale che portano a riduzione della pressione arteriosa e a positive conseguenze cliniche
Il calo ponderale riduce l’insulino-resistenza, completamente reversibile nelle fasi iniziali, prevenendo anche la progressione verso il DMT2 o facendolo addirittura regredire qualora già presente, comportando anche una riduzione della pressione arteriosa sistolica di circa 1 mmHg per ogni kg di peso corporeo perso (61). Nei trial THOP I e II seguiti da follow-up a lungo termine, la riduzione di peso con la riduzione di pressione arteriosa comportavano una riduzione della mortalità (62). In questi studi clinici, individui di età compresa tra i 30 e i 54 anni con una pressione arteriosa elevata e normale sono stati randomizzati per calo ponderale, cure abituali o altri interventi per 18 mesi (TOHP I) o 3-4 anni (TOHP II), con un follow-up medio di 23 anni sulla mortalità, uno dei più grandi studi randomizzati per l’indagine degli effetti della riduzione di peso sui livelli di pressione arteriosa a lungo termine. Nel gruppo di riduzione del peso con un’intensa educazione, il peso perso dopo 6 mesi era di 4,4 kg, dopo 18 mesi di 2 kg e dopo 3 anni di soli 0,2 kg, sottolineando la difficoltà di mantenere i risultati positivi. Il 50% dei soggetti riprende il peso iniziale dopo un periodo medio di 3 anni e questo provoca un aumento della pressione arteriosa (63).
L’entità di tali riduzioni di pressione arteriosa sono rilevanti se si pensa come una riduzione anche di “soli” 2 mmHg di PAS nel medio-lungo termine si accompagni ad una riduzione del 10% della mortalità per ictus e del 7% della mortalità per cardiopatia ischemica (64). Le più recenti linee guida della Società Europea dell’Ipertensione Arteriosa (ESH) sottolineano infatti l’importanza del calo ponderale come fondamentale strategia terapeutica per ottenere una riduzione della pressione arteriosa (11). La perdita di peso nel paziente obeso migliora anche il grado di apnee ostruttive del sonno (OSA), che correlano con ipertensione resistente al trattamento e con aumentato rischio di ictus. Il calo ponderale inoltre determina diminuzione dei lipidi circolanti, soprattutto del colesterolo non-HDL e dei trigliceridi, con parallelo aumento del colesterolo HDL, soprattutto quando il calo ponderale si associa ad aumentata attività fisica. A livello renale ne deriva una riduzione dell’iperfiltrazione glomerulare, riduzione dell’albuminuria e rallentamento della perdita di funzionalità renale (65). Ne beneficiano anche la steatosi e i markers di danno epatico. In sintesi, una riduzione dell’eccesso di adipe soprattutto “mangiando meno e meglio” anche grazie a un moderno aiuto farmacologico ha quindi un netto beneficio metabolico e cardiovascolare come dimostrato dallo studio SELECT descritto di seguito.
La nuova concezione adipocentrica nell’approccio terapeutico farmacologico all’ipertensione arteriosa nel paziente obeso
Il paziente con sovrappeso viscerale o obesità affetto da ipertensione arteriosa è da anni oggetto di speciale interesse clinico in quanto spesso, per ottenere un adeguato controllo pressorio, necessita di una terapia antipertensiva in duplice o più spesso triplice associazione, che garantisca un’adeguata copertura delle 24 ore e che contenga un diuretico oltre a un antagonista del SRAA (11,66). Tali associazioni vedono come farmaci di prima scelta gli ACE-inibitori o i sartani, preferibilmente a dosaggio “massimale”, ovvero generalmente quello somministrato negli studi clinici di outcome cardiovascolare o renale (67). Ad esempio, nello studio DROP (68) condotto su obesi ipertesi con DMT2 e microalbuminuria, i dosaggi di valsartan più efficaci per il controllo pressorio e per la riduzione della microalbuminuria erano pari a ben 640 mg al giorno, ovvero il doppio del dosaggio massimo commercializzato in Italia. Nello studio VAL-HEFT, in cui sono stati arruolati molti pazienti obesi ipertesi, il valsartan veniva utilizzato nello scompenso cardiaco con ridotta frazione di eiezione al dosaggio di 160 mg due volte al giorno nonostante la pressione arteriosa fosse “bassa-normale” data la tipologia di scompenso (69–71). L’irbesartan ha ottenuto ottimi risultati dosaggio-dipendenti in termini di nefroprotezione in pazienti diabetici con microalbuminuria che erano in genere ipertesi. Lo studio IRMA-2 condotto su 590 pazienti ipertesi con DMT2 ha dimostrato come irbesartan prevenga e rallenti la progressione alla nefropatia conclamata. L’end-point primario era rappresentato dal tempo di insorgenza della nefropatia diabetica, definita da albuminuria persistente in campioni notturni, con un tasso di escrezione urinaria di albumina superiore a 200 µg al minuto e superiore di almeno il 30% rispetto al livello di base. Dieci dei 194 pazienti del gruppo “irbesartan 300mg” (5,2%) e 19 dei 195 pazienti del gruppo “irbesartan 150 mg” (9,7%) hanno raggiunto l’end-point primario, rispetto a 30 dei 201 pazienti del gruppo placebo (14,9%) (72). Lo studio IDNT, condotto su 1715 ipertesi in sovrappeso od obesi con DMT2, proteinuria e nefropatia in stadio avanzato, ha dimostrato come irbesartan al dosaggio di 300 mg al giorno, paragonato ad amlodipina e altri trattamenti, proteggesse maggiormente dal rischio di incremento dei valori di creatininemia fino all’insufficienza renale terminale o di morte (73). Riguardo gli ACE-inibitori, nello studio REIN in pazienti nefropatici cronici, ma non diabetici, è stato dimostrato come l’effetto protettivo renale del ramipril fosse significativo solo nei soggetti obesi, sia per la progressione del danno renale sia per la proteinuria, mentre tale effetto era praticamente assente nelle persone con BMI normale (74). Negli obesi risulta spesso necessaria l’associazione con diuretici tiazidici o tiazidico-simili, utilizzabili fino a valori di filtrato glomerulare stimato (eGFR) di circa 30 ml/min/1,73m2, o diuretici dell’ansa (furosemide o torasemide, quest’ultima da preferire per la più lunga emivita e per il miglior profilo di biodisponibilità) per valori di eGFR<30 ml/min/1,73m2. Se da un lato il diuretico serve a eliminare l’eccesso di sale introdotto con l’alimentazione dagli obesi, dall’altro lato il sartano o ACE-inibitore serve a moderare la conseguente stimolazione del SRAA dovuta all’utilizzo del diuretico (66). Infatti, nella maggior parte degli obesi, l’associazione con un diuretico è indispensabile per ottenere un adeguato controllo dei valori pressori nelle 24 ore, proprio a causa dell’elevato introito sodico che caratterizza la dieta di questi pazienti, introito elevato spesso misconosciuto sia dai clinici che dai pazienti stessi. I pazienti obesi sono anche quelli in cui spesso nemmeno una duplice terapia di associazione diuretico-antagonista SRAA permette di raggiungere un ottimale controllo pressorio, per cui spesso vengono associati anche i calcio-antagonisti diidropiridinici. Va ricordato come l’amlodipina blocchi principalmente i canali del calcio di “tipo L”, presenti soprattutto sull’arteriola afferente glomerulare e che quindi potrebbe favorire l’iperfiltrazione glomerulare se usata, impropriamente quanto comunemente, in monoterapia nei pazienti obesi ipertesi. Il noto e frequente effetto collaterale conseguente all’utilizzo di amlodipina, rappresentato dall’insorgenza di edemi declivi generalmente perimalleolari, in caso di monoterapia in pazienti obesi, già di per sé gravati da possibili problematiche di stasi flebo-linfatica agli arti inferiori oltre alla tendenza alla ritenzione idrosalina, può facilmente comportare l’insorgenza di edemi anche “colonnari” fino alle ginocchia. L’azione vasodilatatoria diretta dell’amlodipina dovrebbe infatti essere sempre controbilanciata da un antagonista del SRAA, vale a dire un sartano o un ACE-inibitore, financo un antagonista dell’aldosterone, altrimenti, in alcuni pazienti, per l’efficace vasodilatazione arteriolare glomerulare afferente è possibile osservare anche un effetto “diuretico” da amlodipina con comparsa di nicturia, specie se il farmaco viene assunto la sera prima di coricarsi, con possibile riduzione dell’aderenza terapeutica. La lercanidipina, apparentemente agendo in modo più bilanciato sui canali del calcio sia di “tipo L” che di “tipo T” che sono più abbondanti a livello post glomerulare nell’arteriola efferente, eserciterebbe una dilatazione più equilibrata delle arteriole glomerulari afferente ed efferente, non favorendo quindi l’iperfiltrazione glomerulare dell’obeso, e può pertanto rappresentare una valida alternativa all’amlodipina dando anche minori edemi declivi a parità di riduzione pressoria tramite meccanismi analoghi (75–78).
Le più recenti linee guida promulgate dalla ESH confermano la necessità di un utilizzo estensivo di duplici o triplici combinazioni fisse contenenti un diuretico, per ottenere un adeguato controllo pressorio delle 24 ore nei pazienti obesi, e allo stesso tempo aumentare l’aderenza terapeutica (11), come ampiamente descritto in una nostra revisione sull’argomento, che tiene conto anche indispensabilmente delle differenti caratteristiche fenotipiche dei pazienti ipertesi (66). In Italia sono disponibili triplici associazioni precostituite che includono, oltre a un sartano (olmesartan o valsartan) o un ACE-inibitore (perindopril o ramipril), anche un diuretico (indapamide o idroclorotiazide) e un calcio-antagonista diidropiridinico (amlodipina), associazioni che aumentano nettamente l’aderenza alla terapia farmacologica e quindi il controllo pressorio delle 24 ore.
Da notare come nello studio ACCOMPLISH79,80, come del resto in moltissimi altri studi sul trattamento farmacologico dell’ipertensione arteriosa, circa il 50% dei pazienti avesse un BMI >30 kg/m2, mentre la quasi totalità del resto del campione fosse sovrappeso. È molto importante evidenziare come da una sotto-analisi di tale studio sia emerso che negli obesi l’associazione ACE inibitore/diuretico (benazepril- idroclorotiazide) si associasse a un miglior outcome combinato di morte cardiovascolare, infarto e ictus rispetto all’outcome globale dello studio, dove invece l’associazione ACE-inibitore e calcio-antagonista prevaleva (81). In un ulteriore studio, condotto con un’associazione fissa di ACE-inibitore/calcio-antagonista (perindopril-amlodipina) si osservava come i fattori principali che ostacolavano l’efficacia della terapia sul calo pressorio fossero proprio BMI e circonferenza vita, due noti indici di adiposità, diffusa e centrale rispettivamente (82). Appare quindi chiaro come molti studi clinici siano stati condotti proprio in pazienti con sovrappeso o obesità, con le inevitabili conseguenze “adipocentriche” come l’ipertensione arteriosa e che proprio in questi pazienti vi siano specifiche scelte terapeutiche da fare con specifici risultati ottenibili.
Un’altra classe farmacologica utilizzabile nel paziente obeso è quella rappresentata dai beta-bloccanti, in particolare i bloccanti selettivi (o super-selettivi) del recettore beta-1 adrenergico, come il bisoprololo e il nebivololo, da preferire al metoprololo tartrato (poiché meno selettivo e dotato di durata d’azione di circa 8 ore, per cui si dovrebbe assumere almeno tre volte al giorno), per mantenere la frequenza cardiaca < 70 bpm, specie negli obesi sedentari. Questa classe farmacologica contribuisce anche a ridurre la secrezione di renina da stimolo (ad esempio in ortostatismo) adrenergico beta-1 sulle cellule renina-secernenti dell’arteriola glomerulare afferente, senza peraltro determinare mai ipotensione ortostatica, al contrario dell’alfa-1 antagonista adrenergico doxazosina, che non ha indicazioni specifiche in questi pazienti ed è un farmaco di quarta-quinta scelta, oppure dell’alfa-2 agonista centrale clonidina (disponibile anche in formulazione transdermica), che risulta addirittura controindicata negli obesi, in quanto causerebbe anche rallentamento psico-motorio favorendo ulteriore incremento ponderale. Eppure tali due farmaci sono inconcepibilmente tuttora prescritti in grande eccesso dai medici italiani. È importante ricordare come nell’obeso iperteso sia spesso necessario ricorrere all’utilizzo di antagonisti del recettore dei mineralcorticoidi (MRA), anche a basse dosi (canrenone 12,5-25 mg) per ottenere un completo controllo dei valori pressori nelle 24 ore. Ciò è dovuto alla persistente quanto inappropriata secrezione di aldosterone che caratterizza l’obeso iperteso, nonostante l’utilizzo di ACE-inibitori o sartani, specie se sottodosati (come ad esempio ramipril a soli 2,5/5 mg al giorno). Nei pazienti obesi, ricordiamo infatti il fenomeno dell’escape della secrezione di aldosterone dall’inibizione esercitata da ACE-inibitori e antagonisti dell’angiotensina II (27,28).
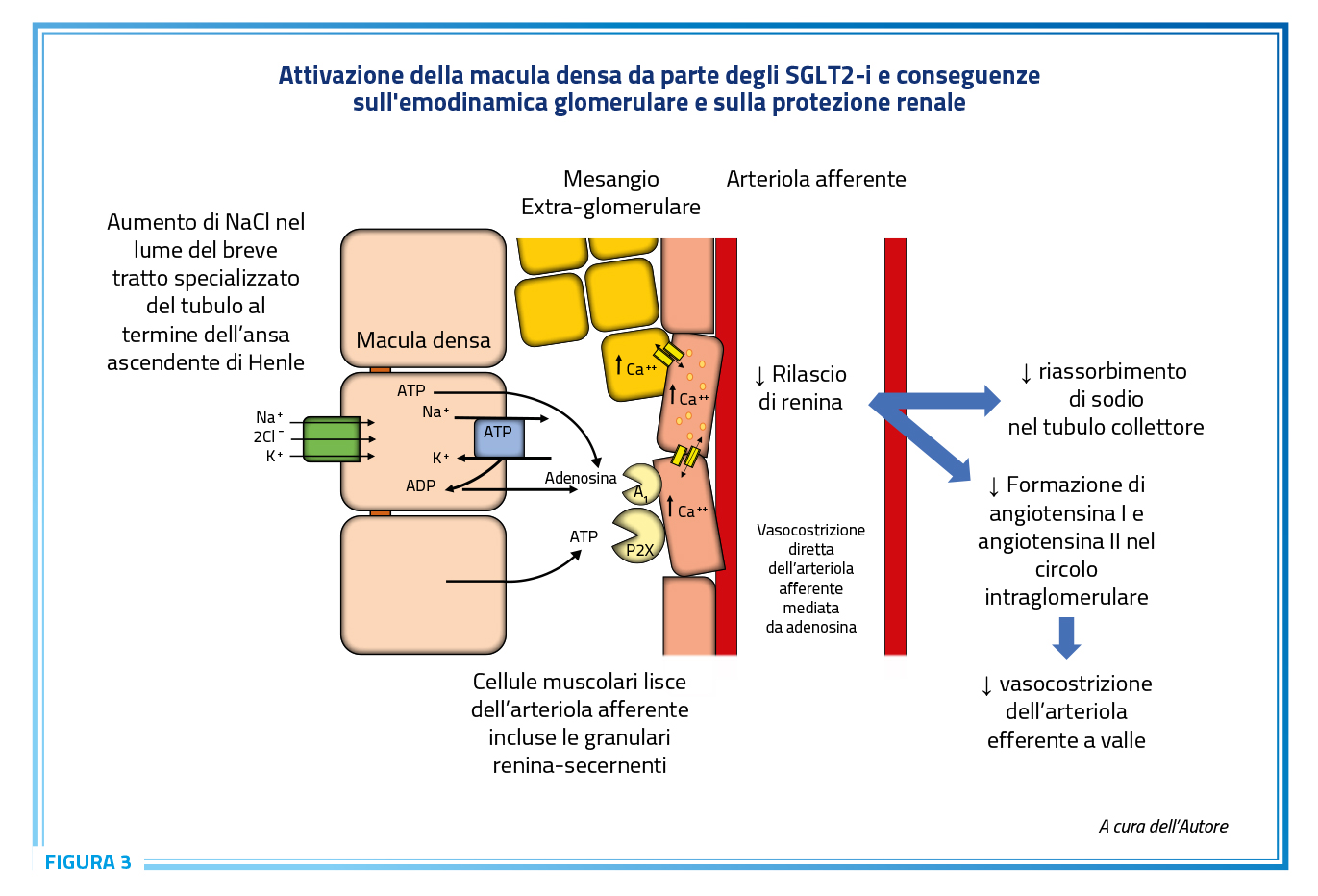
In associazione alle classi di farmaci anti-ipertensivi raccomandati, gli SGLT2-i (gliflozine) rappresentano una nuova opportunità per il paziente iperteso specie se affetto da scompenso cardiaco, indipendentemente dalla frazione di eiezione, e da CKD, a prescindere dalla presenza o meno di DMT2. Le gliflozine hanno il loro sito di azione nel tubulo prossimale renale e, per il fatto che inibiscono sia il riassorbimento di glucosio che di sodio, abbiamo proposto il termine di diuretici “ibridi” o “doppi” anche perché, al contrario delle altre classi di diuretici disponibili, non stimolano, ma anzi inibiscono, il SRAA. Agendo a livello del tubulo contorto prossimale del nefrone, favoriscono la natriuresi e la glicosuria, con una ulteriore componente di diuresi osmotica (83) (Figura 3). Infatti, nella fase iniziale “acuta” di terapia, la riduzione di volume e pressione è tale che può prevalere uno stimolo temporaneo sull’attività del SRAA (84), la cui secrezione e attività sono regolate a multipli livelli, includendo il sistema nervoso autonomo attivato dai recettori di volume e pressione. L’inibizione del co-trasportatore SGLT2 conduce a minore riassorbimento di glucosio e cloruro di sodio a livello prossimale. Il “sensore” della macula densa, ovvero il co-trasportatore Na-K-2Cl analogo a quello presente nella parte terminale ascendente “spessa” dell’ansa di Henle di cui la macula densa è la diretta continuità, percepisce un maggior quantitativo di sodio (ma soprattutto di cloro), interpretandolo come un’iperfiltrazione glomerulare, o comunque come un’abbondanza in introito alimentare e contenuto corporeo totale di sale. Ne consegue un maggior rilascio paracrino dei nucleotidi ATP/ADP che rapidamente vengono enzimaticamente convertiti nel nucleoside adenosina a livello interstiziale del polo vascolare del glomerulo dello stesso nefrone, con conseguente stimolo dei recettori di tipo 1 dell’adenosina e successiva vasocostrizione dell’arteriola afferente assieme a una inibizione del rilascio di renina. Questo comporta protezione dall’iperfiltrazione ma anche una minore produzione locale di angiotensina I dal lume dell’arteriola afferente in poi, con conseguente minori concentrazioni a livello dell’arteriola efferente di angiotensina II, che viene rapidamente prodotta dal locale ACE presente in tutto l’endotelio glomerulare. Ne risulta pertanto, oltre che una riduzione in cronico dell’attività sistemica del SRAA anche una minore vasocostrizione dell’arteriola efferente. Il termine diuretico “ibrido” da noi coniato è correlabile proprio alla capacità di questi farmaci di vasocostringere l’arteriola afferente e ridurre l’attività del SRAA “intra-renale” mimando quindi l’azione di un ACE-inibitore, ma senza avere gli effetti di stimolo sulla secrezione di renina, comportandosi quindi anche in modo opposto ai diuretici dell’ansa, che inibiscono anche il “sensore” della macula densa, o di quelli tiazidici che agiscono sul tubulo contorto distale, i quali appunto stimolano l’attività del SRAA (83).
È proprio questa caratteristica degli SGLT2-i che determina la loro efficacia nel ridurre la pressione arteriosa sia a livello sistemico che a livello glomerulare, limitando lo stimolo secretivo reninico a livello del nefrone e di conseguenza la stimolazione dei recettori AT1 dell’angiotensina II sull’arteriola efferente, stimolazione che non viene mai completamente inibita nemmeno con l’utilizzo di sartani o ACE- inibitori. Infatti, tali classi di farmaci non riescono mai a contrastare completamente l’azione locale intra-renale concentrazione-dipendente dell’angiotensina II, che può essere prodotta a partire dall’angiotensina I anche per vie alternative all’ACE. Inoltre, sia sartani che ACE inibitori aumentano i livelli di renina dall’arteriola afferente in giù, ostacolando l’inibizione della sua secrezione tramite il feedback negativo angiotensina II-dipendente. Inoltre, nei pazienti obesi l’escape dagli effetti di ACE-inibitori o sartani sul controllo della secrezione di aldosterone si ha probabilmente anche per la contemporanea esaltata attività reninica (27).
Gli SGLT2-i aumentano transitoriamente l’attività della renina plasmatica in modo acuto attraverso la diuresi osmotica e la maggiore eliminazione di sodio. Nei pazienti con DMT2 è infatti stato osservato un aumento dell’escrezione urinaria di sodio durante la fase iniziale del trattamento con canagliflozin ed empagliflozin. Il SGLT2 e lo scambiatore idrogeno-sodio 3 (NHE3) sono entrambi co-localizzati nel tubulo prossimale del rene e sono up-regolati in risposta all’iperglicemia cronica. Entrambi i trasportatori sono collegati dalla multi-proteina associata alla membrana 17 (MAP17). L’inibizione indiretta di NHE3 attraverso l’interruzione del complesso MAP17 è probabilmente un modo importante per ottenere una maggiore natriuresi con l’inibizione di SGLT2. Nel complesso, i dati sperimentali suggeriscono che NHE3 è un importante determinante della natriuresi mediata dagli SGLT2-i. Di conseguenza, tali farmaci riducono il contenuto totale di sodio corporeo e il sovraccarico di volume (85,86). Gli effetti antipertensivi riscontrati nello studio EMPA-REG OUTCOME e nel programma CANVAS sono probabilmente dovuti alla natriuresi indotta dagli SGLT2-i. In particolare, è stato dimostrato come dapagliflozin riduca il volume plasmatico in modo simile ai diuretici tiazidici, ma con un effetto diuretico più duraturo rispetto ad altri diuretici. La riduzione “acuta” del volume plasmatico è accompagnata da un aumento dell’ematocrito, che è stato osservato nei pazienti trattati con SGLT2-i. Allo stesso modo, i pazienti trattati con empagliflozin hanno mostrato un ematocrito superiore di circa il 5% rispetto ai pazienti trattati con placebo. Modelli matematici hanno indicato che gli SGLT2-i possono determinare soprattutto una clearance del fluido interstiziale con minori modifiche del volume intravascolare mediante diuresi osmotica. Nell’ultimo decennio, l’accumulo di sodio nei tessuti ha ricevuto una crescente attenzione come marcatore di stati di espansione del volume. Le concentrazioni di sodio cutanee e muscolari sono positivamente correlate al rischio di malattie cardiovascolari e alla pressione arteriosa nella malattia renale cronica. È interessante notare come il trattamento cronico con dapagliflozin riduca significativamente le concentrazioni di sodio cutanee nei pazienti con DMT2. Questi dati supportano l’ipotesi che gli SGLT2-i diminuiscano la concentrazione di sodio nel fluido interstiziale e quindi riducano il rischio di malattie cardiovascolari. Studi clinici hanno dimostrato come canagliflozin aumenti il volume delle urine nei pazienti con DMT2 durante i primi giorni di trattamento. In pazienti giapponesi con DMT2, empagliflozin aumentava inizialmente il volume delle urine. Osservazioni simili sono state riscontrate anche in pazienti affetti da DMT2 trattati con dapagliflozin. Nel complesso, i dati indicano costantemente come il trattamento con SGLT2-i determini una natriuresi associata a glicosuria. Tuttavia, gli effetti diuretici più evidenti sembrano essere transitori in base ai dati disponibili nei pazienti con DMT2 (84).
Tuttavia, la durata della natriuresi e della riduzione del volume rimane un’area controversa, poiché ci sono poche prove a lungo termine che la natriuresi persista dopo le prime settimane di trattamento, probabilmente a causa di un aumento compensatorio del riassorbimento di sodio nel nefrone distale. Inoltre, l’obesità severa può associarsi a stimolazione della secrezione di aldosterone attraverso vari meccanismi, portando a livelli inappropriatamente normali o alti nei pazienti obesi con ipertensione essenziale, nonostante il trattamento e la dieta ricca di sale (28). Questa azione farmacologica degli SGLT2-i è simile all’azione dei peptidi natriuretici sull’assorbimento di sodio a livello del tubulo prossimale, di cui appunto ne simulano i benefici fisiopatologici inclusa la capacità di inibire direttamente il SRAA agendo a vari livelli. A seguito dell’inibizione del co-trasportatore SGLT2 si hanno quindi notevoli benefici in termini di cardio e nefro-protezione, benefici che hanno determinato una vera rivoluzione nella gestione delle malattie cardiovascolari e renali, a prescindere dal diabete mellito (87,88). Per quanto siano stati ipotizzati dozzine di diversi meccanismi per l’azione benefica degli SGLT2-i sulla base di studi in vitro o sperimentali, rimane molto solida la fisiopatologia basata sull’asse sodio/volume/pressione arteriosa con i benefici clinici confermati da decenni di studi. In aggiunta, questa classe di farmaci permette all’organismo di perdere circa 70 grammi di glucosio al giorno (280 kcal), facilitando così il calo ponderale nel paziente sovrappeso/obeso. I maggiori rappresentanti di questa classe, di cui riporteremo i dati sulla pressione arteriosa, sono empagliflozin, dapagliflozin, canagliflozin, sotagliflozin ed ertugliflozin.
Il dapagliflozin ha dimostrato di facilitare un calo ponderale medio fino a un massimo del 6,4% e di ridurre la pressione arteriosa, dimostrando un ruolo significativo in termini di protezione cardiovascolare, con associata riduzione delle ospedalizzazioni per scompenso cardiaco, in pazienti con scompenso a frazione di eiezione ridotta (studio DAPA-HF) (89). Nello studio DELIVER sono stati evidenziati benefici significativi anche nei pazienti con scompenso cardiaco a frazione di eiezione preservata dimostrando l’unicità dei risultati ottenuti da questa classe di farmaci (90). Dapagliflozin inoltre riduce il decadimento negli anni della funzionalità renale fino al 28% in pazienti diabetici con nefropatia diabetica. L’età media dei pazienti arruolati nello studio era di 72 ± 10 anni e il 44% erano di sesso femminile. Valori di PAS <120 mmHg erano associati a maggiori eventi di scompenso cardiaco e mortalità (molto probabilmente non come causa-effetto), mentre il rischio di amputazione e ictus aumentava con una PAS più elevata. Dapagliflozin ha ridotto la PAS di 1,8 (95% CI: 1,1- 2,5) mmHg rispetto al placebo a 1 mese (91). Nello studio DAPA-CKD si è dimostrato come l’utilizzo di dapagliflozin in pazienti con malattia renale cronica indipendentemente dalla presenza di DMT2, riducesse significativamente il rischio di declino della velocità di filtrazione glomerulare del 50% rispetto al placebo, riducendo il rischio di progressione del danno renale e di morte per cause renali o per cause cardiovascolari (92).
Lo studio DIAMOND ha valutato gli effetti di dapagliflozin nella CKD proteinurica non diabetica per 6 settimane e ha mostrato una riduzione della pressione arteriosa sistolica e diastolica di 3,6/-1,4 mmHg. Nello studio DAPA-CKD, dapagliflozin ha ridotto la pressione arteriosa nei pazienti con nefropatia IgA di 3,5/-2,2mmHg in 2,1 anni. L’effetto è apparso meno pronunciato nei pazienti con glomerulosclerosi focale segmentale (FSGS) (93).
L’empagliflozin, nello studio EMPEROR REDUCED (94), ha dimostrato un minor rischio di morte cardiovascolare o ospedalizzazione per scompenso cardiaco, indipendentemente dalla presenza o meno di DMT2. Inoltre, il tasso di riduzione del filtrato glomerulare era inferiore nei pazienti che assumevano empagliflozin, indipendentemente dal grado di severità della malattia renale cronica di partenza (misurato come eGFR o come albuminuria) studiando pazienti con un filtrato stimato fino a 20 ml/min/1,73m2.
Lo studio EMPEROR PRESERVED ha dimostrato una riduzione del rischio combinato di morte cardiovascolare o ospedalizzazione per scompenso cardiaco in pazienti con scompenso cardiaco a frazione di eiezione preservata, indipendentemente dalla presenza o meno di DMT2, confermando l’effetto di classe degli SGLT2-i nel modificare significativamente il management dello scompenso cardiaco a frazione di eiezione preservata (95). Molti pazienti con HFpEF sono risultati ipertesi e si è assistito ad una riduzione della pressione arteriosa sistolica nel gruppo trattato con empagliflozin. Inoltre, è emerso come i pazienti con PAS > 130 mmHg avessero un tasso di incidenza di scompenso cardiaco aumentato di 8,58 rispetto ad un tasso di incidenza di 8,26 presente nei pazienti con PAS di 110-130 mmHg.
Nello studio EMPA-REG OUTCOME si riscontravano i seguenti risultati significativi: riduzione della mortalità cardiovascolare, riduzione della mortalità per tutte le cause, riduzione dell’ospedalizzazione per scompenso cardiaco e riduzione del rischio cardiovascolare, nei pazienti trattati con empagliflozin in associazione allo standard di terapia, indipendentemente dalla presenza o meno di scompenso cardiaco, e indipendentemente dalla frazione di eiezione (96). In questo studio su 4.687 pazienti trattati con empagliflozin e 2.333 pazienti trattati con placebo per 3 anni di follow up, partendo da livelli di pressione arteriosa medi di 135/76 mmHg si è assistito ad una riduzione media di 4 mmHg nei pazienti trattati con empagliflozin (97).
Lo studio EMPA-TROPISM ha dimostrato come empagliflozin riduca l’adiposità, specialmente quella viscerale, la fibrosi interstiziale miocardica, in particolare quella perivascolare, la rigidità aortica ed i livelli circolanti di markers infiammatori in pazienti non diabetici con scompenso cardiaco a frazione di eiezione ridotta (98).
Nello studio EMPA- KIDNEY si sono evidenziati minor progressione del danno renale cronico e minori ospedalizzazioni con empagliflozin, confermando l’efficacia di classe degli inibitori di SGLT2 nella protezione dal danno renale cronico. In questo studio su 3.304 pazienti i valori medi di pressione arteriosa dei partecipanti al baseline erano di 136/78 mmHg e si verificò una riduzione media di 2,6 mmHg per la PAS e 0,5 mmHg per la pressione diastolica (PAD) (99).
Il canagliflozin nello studio CANVAS, condotto su pazienti con DMT2 e malattie cardiovascolari o elevato rischio cardiovascolare, ha evidenziato una riduzione degli eventi cardiovascolari rispetto al placebo, ma un maggior rischio di amputazione a livello metatarsale o a livello delle dita dei piedi (100). Successivamente, si è chiarito come tale rischio fosse aumentato solo in soggetti con determinate caratteristiche associate, quali precedenti anamnestici per amputazione, malattie vascolari periferiche e neuropatia (101). In termini di riduzione della pressione arteriosa si assisteva ad una netta riduzione sia della PAS (− 3,93 mmHg) che della PAD (− 1,39 mmHg) (102).
Lo studio CREDENCE ha invece arruolato pazienti diabetici con malattia renale cronica (eGFR tra 30 e 90 ml/min/1,73m2 e albuminuria), dimostrando una riduzione degli eventi renali e cardiovascolari con l’utilizzo di canagliflozin. Nei pazienti con DMT2 e CKD dello studio CREDENCE, circa tre quarti dei pazienti avevano una PAS >130 mmHg al basale, e un quinto dei pazienti riceveva più di quattro principi attivi per la riduzione della pressione arteriosa: si tratta quindi di uno degli studi sugli inibitori SGLT2 con il più alto carico di ipertensione. In questo studio, canagliflozin ha ridotto la pressione arteriosa di 3,5/1,0 mmHg, con effetti costanti indipendentemente dalla funzione renale, dalla pressione arteriosa al basale e dal numero di farmaci per la riduzione della pressione arteriosa. I partecipanti randomizzati a canagliflozin avevano il 45% di probabilità in più di registrare una riduzione della pressione arteriosa sistolica superiore a 5 mmHg entro la terza settimana. Canagliflozin ha anche ridotto l’assunzione di nuovi farmaci per la riduzione della pressione arteriosa nel corso del tempo (cioè i nuovi farmaci per la pressione arteriosa sono stati assunti più frequentemente nel braccio placebo), sollevando la possibilità che il vero effetto di riduzione della pressione arteriosa possa essere ancora maggiore di 3,5 mmHg (103). Un’analisi secondaria del lavoro ha dimostrato come i pazienti trattati con 100 mg di canagliflozin e con filtrato renale stimato compreso tra 45 e 60 ml/min/1,73m2 avessero avuto i maggiori benefici in termini di outcome renale (104). L’utilizzo di canagliflozin ha determinato un calo inziale dei valori di filtrato glomerulare stimato, con una successiva stabilizzazione, come era da attendersi sulla base del meccanismo di azione principale di questa classe di farmaci (103). Infatti, è stata riscontrata anche una significativa riduzione della pressione arteriosa sistolica, riducendo la necessità di ulteriori farmaci antipertensivi, dimostrando come gli inibitori di SGLT2 possiedano molteplici meccanismi organo-protettivi (104). In conclusione, le gliflozine hanno dimostrato complessivamente effetti metabolici, cardiovascolari e renali molto positivi incentrati sull’eliminazione di più sodio, glucosio e acqua per via urinaria senza attivazione del SRAA. Sicuramente hanno già un ruolo sia primario che integrativo nella terapia in molti pazienti obesi ipertesi sia con DMT2 sia senza e con scompenso cardiaco e/o nefropatia cronica. Una rimodulazione di altri farmaci per il trattamento dell’ipertensione e delle comorbidità associate è pertanto spesso necessario usando gli inibitori di SGLT2. Per limitare alcuni effetti collaterali prevedibili, i pazienti devono essere adeguatamente istruiti a mantenere un’adeguata idratazione e un’accurata igiene genitale quotidiana.
Nuove terapie adipocentriche focalizzate sulla riduzione dell’eccesso di adipe con conseguente riduzione della pressione arteriosa
Come riportato anche dalle più recenti linee guida europee per la gestione dell’ipertensione arteriosa, nel paziente obeso iperteso, oltre alla necessaria terapia farmacologica antipertensiva, si dovrebbe ricorrere anche ad una terapia farmacologica che consenta di ottenere un significativo calo ponderale, poiché al calo ponderale seguirà inevitabilmente un calo pressorio, con agevolazione in termini di adeguato controllo pressorio delle 24 ore e possibilità di ridurre il carico della terapia antipertensiva (11).
Nella nostra rassegna, a tal proposito, presentiamo un approccio terapeutico, supportato da crescenti evidenze, fondato sull’integrazione precoce di terapie anti-ipertensive e terapie anti obesità mirate alla protezione cardiorenale e alla prevenzione degli eventi cardiovascolari.
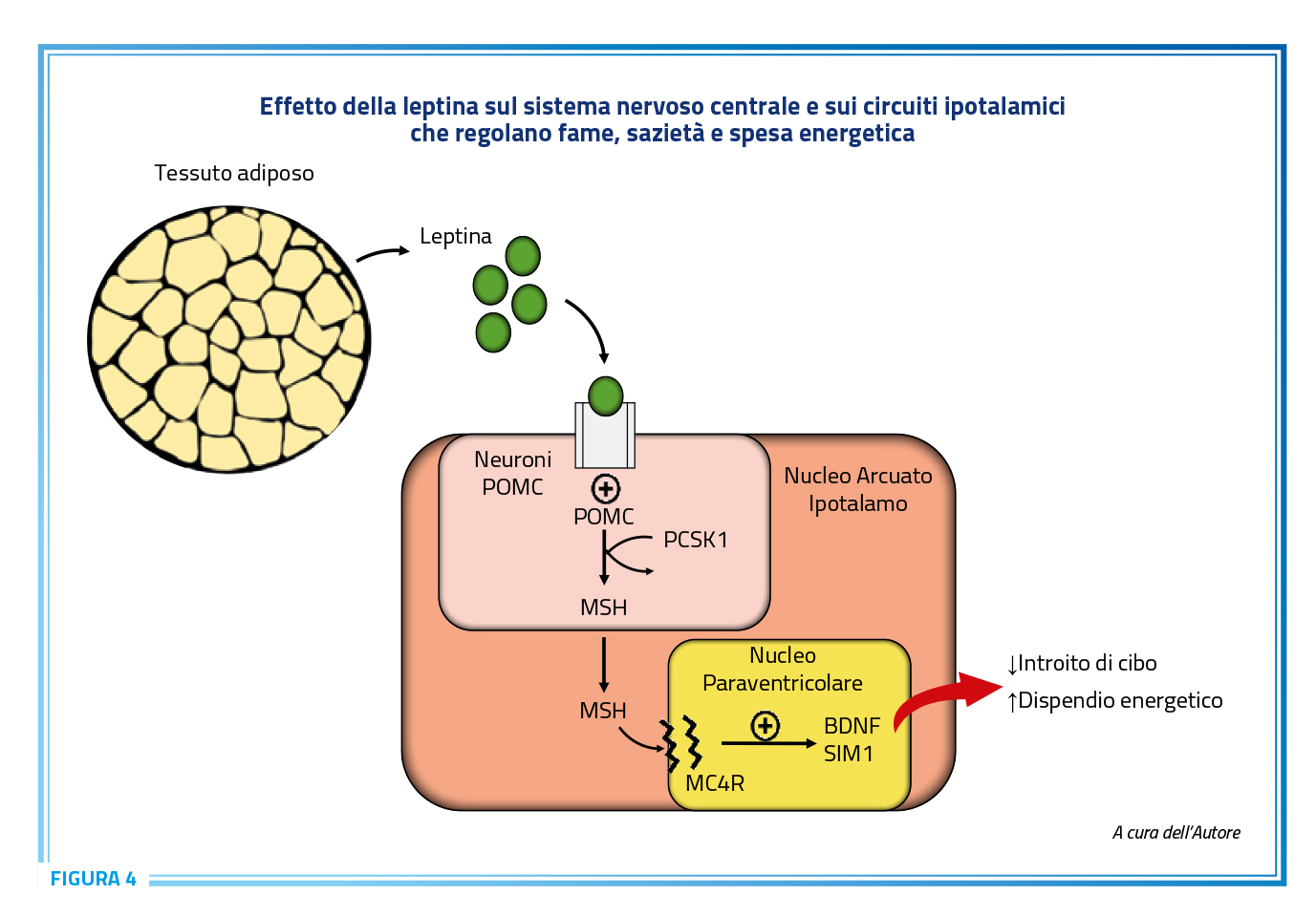
Il GLP-1 è un ormone secreto a livello intestinale con effetti molteplici sull’organismo sebbene di breve emivita (105). L’azione principale più rilevante nella pratica clinica si esplica però a livello cerebrale. Questa molecola, infatti, raggiunge i neuroni ipotalamici degli organi circumventricolari, inclusi i neuroni del nucleo arcuato e del nucleo del tratto solitario. Grazie agli effetti inibitori centrali ipotalamici sull’appetito (106), il GLP-1 riduce la sensazione di fame stimolando sia il senso di ripienezza che quello di sazietà, agendo direttamente sui neuroni secernenti proopiomelanocortina (POMC) nel nucleo arcuato, aumentando la secrezione di melanocortina (MSH) e l’espressione del suo recettore MC4R a livello del nucleo paraventricolare (107) simulando quindi gli effetti della leptina (Figura 4).
Gli analoghi del GLP-1 (classificati come GLP-1 receptor agonists, GLP-1 RA) grazie al prolungamento dell’emivita e della durata di azione non solo hanno una persistente azione contrale ma esercitano inoltre effetti “ancillari”, quali un’azione diretta sulle cellule beta e alfa pancreatiche con facilitazione della secrezione di insulina e diminuzione della secrezione di glucagone, una ridotta motilità e svuotamento gastrico (anche per azione diretta sul nervo vago e sul plesso mioenterico) ed un aumento del metabolismo del tessuto muscolare scheletrico (105). Inducendo un minor introito di cibo e calorie, facilitano indirettamente anche la natriuresi per un miglioramento dell’efficacia del sistema dei peptidi natriuretici, grazie alla ridotta espressione del loro recettore di clearance (NPRC) che è insulino/glucosio-dipendente negli adipociti (35) e, nonostante l’obesità si associ a livelli inferiori di peptidi natriuretici circolanti per loro ipercatabolismo periferico, si osserva una riduzione dei livelli di NT-proBNP circolante conseguente a riduzione dello stress di parete ventricolare (108).
Le principali molecole con dimostrata efficacia clinica appartenenti alla classe degli agonisti del recettore del GLP-1 sono: liraglutide, dulaglutide, semaglutide (sottocute e orale) e la più recente tirzepatide che è in realtà un “dual agonist” (o twincretin) agendo anche come analogo del GIP (vedi sotto).
La liraglutide sebbene richieda iniezioni sottocutanee giornaliere, rappresenta il primo long-acting di dimostrata efficacia clinica all’interno di questa classe farmacologica, approvata per uso in mono- somministrazione quotidiana sottocutanea e con outcome favorevole negli studi clinici condotti. Lo studio LEADER, uno studio landmarking condotto su pazienti con DMT2, ha dimostrato infatti una minor mortalità per cause cardiovascolari, in particolare per infarto miocardico acuto (IMA) (109). Veniva inoltre dimostrata la riduzione del tessuto adiposo viscerale e del grasso ectopico (110) sebbene la riduzione del peso corporeo sia risultata contenuta (107). L’aumento progressivo della dose permette al paziente di ridurre gli effetti avversi transitori di tipo gastrointestinale, come dispepsia e nausea. Con la perdita di peso conseguente al ridotto introito calorico, si riduce l’insulino-resistenza e migliorano anche tutti gli altri fattori di rischio cardiovascolare di natura adipocentrica con riduzione della pressione arteriosa (111). Sono state riscontrate differenze medie significative tra gruppo liraglutide e gruppo placebo per quanto riguarda cambiamento dal basale a 36 mesi: la PAS era di 1,2 mmHg (95% CI, 1,9-0,5) più bassa nel gruppo liraglutide, mentre la PAD era più alta di 0,6 mmHg (95%CI, da 0,2 a 1,0) nel gruppo liraglutide (109,112). Purtroppo, non vi sono dati riguardo l’accuratezza di queste misurazioni pressorie.
La semaglutide in somministrazione sottocutanea ha il vantaggio di avere un’emivita maggiore, permettendo quindi di essere somministrata settimanalmente anziché quotidianamente. È sempre necessario iniziare con la dose più bassa, da aumentare gradualmente, al fine di ridurre i principali e transitori effetti collaterali gastrointestinali precedentemente citati. Lo studio di outcome cardiovascolare SUSTAIN 6 ha dimostrato, somministrando una dose massima di 1 mg, una riduzione del 26% del rischio globale di morte per cause cardiovascolari, IMA non fatale o stroke non fatale in pazienti con DMT2. Inoltre, veniva confermata una riduzione significativa del peso corporeo, anche una riduzione del 36% del rischio di insorgenza o aggravamento di nefropatia, con conseguente significativo beneficio metabolico e cardiovascolare (113). In questo studio venne osservata una riduzione media di PAS di 1,3 mmHg nei pazienti trattati con semaglutide al dosaggiodi 0,5 mg ed una riduzione pressoria di 2,6 mmHg nei pazienti che assumevano semaglutide al dosaggio di 1 mg. Va ricordato che in studi clinici su pazienti diabetici anche con lungo follow-up, come il LOOK AHEAD, non si otteneva un calo ponderale medio sufficiente e non veniva raggiunto l’obiettivo di riduzione di incidenza degli eventi cardiovascolari (end-point primario composito di ricovero per angina, infarto, ictus e morte cardiovascolare) (57). Al contrario, un’analisi post-hoc dimostrava che solo nella minoranza di pazienti che perdevano oltre il 10% del proprio peso corporeo si raggiungeva una significativa riduzione dell’end-point primario (58). Il recente studio SELECT ha invece reclutato 17604 pazienti ad alto rischio cardiovascolare con aterosclerosi (coronarica nell’82%) in sovrappeso od obesi (71%) non diabetici dimostrando come la semaglutide per via sottocutanea settimanale al dosaggio elevato di 2,4 mg, confrontato con il placebo, abbia ridotto il peso corporeo del 9,4% e, indipendentemente dal BMI di partenza, con un follow-up medio di circa 40 mesi abbia ridotto del 20% l’endpoint composto da morte cardiovascolare e infarto o ictus non fatale (114). In termini di riduzione della pressione arteriosa, si evidenziava come la PAS scendesse di ben 3,8 mmHg nel gruppo di pazienti trattati con semaglutide rispetto ai 0,5mmHg nel gruppo dei pazienti trattati con placebo (114).
La semaglutide ha inoltre la possibilità di poter anche essere somministrata per via orale una volta al giorno, grazie allo sviluppo di una particolare tecnologia che prevede la co-formulazione con un potenziatore dell’assorbimento: il salcaprozato di sodio [Sodio N-(8-(2-hydroxybenzil-Amino) caprylato] (SNAC), che determina a stomaco vuoto un “buffering” locale sulla mucosa gastrica, aumentando localmente il pH e riducendo l’efficacia degli enzimi che potrebbero degradare la semaglutide orale, facilitandone l’assorbimento. Lo SNAC permette anche un aumento della permeabilità della membrana gastrica e promuove la monomerizzazione della semaglutide. Questa formulazione è stata premiata nell’anno 2020 come “Outstanding Contribution in Human Health” dall’Agenzia Europea del Farmaco (EMA). La semaglutide orale esercita un discreto effetto sul calo ponderale, con una riduzione media di 2,3 kg per la posologia da 14 mg rispetto al placebo, e benefici sul controllo della glicemia. Nello studio PIONEER 6 (115) che aveva come obiettivo primario l’outcome cardiovascolare, è stata dimostrata la non inferiorità rispetto al placebo, ma non una sua superiorità, per cui è attualmente in corso un ulteriore studio (SOUL) su 9.642 soggetti che ha come end-point primario l’outcome cardiovascolare. Nello studio PIONEER 6 il peso corporeo si riduceva di 4,2 kg utilizzando semaglutide orale rispetto alla riduzione di 0,8 kg utilizzando il placebo. Studi real-life con la formulazione orale hanno mostrato come si assista già nelle prime settimane ad un miglioramento della composizione corporea con riduzione significativa della massa grassa, del VAT (tessuto adiposo viscerale). Contemporaneamente veniva preservata la massa magra e la massa muscolare, risultante in un benefico aumento del rapporto massa muscolare/tessuto adiposo viscerale (116). In una nota analisi post-hoc che ha analizzato i dati dello studio PIOONER 6 in pazienti con DMT2, si è evidenziato un effetto della semaglutide orale nella riduzione della pressione arteriosa. La semaglutide orale ha dimostrato di ridurre significativamente i valori di PAS di ben 12,5 mmHg ma non si è evidenziata invece una significativa riduzione in termini di PAD (117). Inoltre, nello studio condotto da Yanai et al. veniva dimostrata una riduzione significativa del peso corporeo di 1,2 kg dopo 3 mesi di trattamento con semagutide orale e di 2,4 kg dopo 6 mesi di trattamento. Si osservò inoltre una riduzione notevole della PAS di 6,2 mmHg dopo sei mesi di trattamento (118).
Sono stati identificati studi controllati randomizzati (RCT) che confrontavano semaglutide sottocutanea o orale con placebo o altri agenti anti-iperglicemici in pazienti con T2D.
In una recente review sistematica e metanalisi dove sono stati analizzati ventinove RCT con un totale di 26985 partecipanti, la variazione dalla PAS di semaglutide rispetto al placebo o ad altri farmaci è stata di -2,31 mmHg (95% CI: da -3,11 a -1,51), mentre quella della PAD è stata di 0,09 mmHg (95% CI: da -0,16 a 0,33). La riduzione della PAS è stata simile per la somministrazione sottocutanea e orale di semaglutide, con -2,36 mmHg con la formulazione sottocutanea e -2,50 con la formulazione orale. Dunque, nei pazienti diabetici, la PAS è diminuita significativamente nel gruppo semaglutide rispetto al placebo o sottoposti ad altri farmaci (119).
Un recente studio ha analizzato l’efficacia della semaglutide orale associata all’utilizzo di dapagliflozin. La terapia di combinazione ha dimostrato, oltre che una netta riduzione in termini di emoglobina glicata, anche una riduzione media della PAS di 5,1 mmHg e riduzione della PAD di 3,1 mmHg rispetto al gruppo trattato con il solo dapagliflozin (120).
La dulaglutide ha un’omologia di circa il 90% con il GLP-1 umano nativo, è resistente alla degradazione da parte dell’enzima dipeptidil peptidasi 4 (DPP-4) e le sue grandi dimensioni ne rallentano l’assorbimento e ne riducono la clearance a livello renale. Queste caratteristiche permettono di avere una formulazione solubile e un’emivita di 4,7 giorni, per cui viene generalmente somministrata sottocute una volta alla settimana. Lo studio a lungo termine sugli esiti cardiovascolari (REWIND) ha reclutato una popolazione di pazienti con DMT2 differente rispetto a quella dei precedenti studi di outcome cardiovascolare con analoghi del GLP-1. Infatti, solo il 31,5% dei partecipanti aveva una storia di patologia cardiovascolare nota al momento del reclutamento, con la maggioranza che presentava solo fattori di rischio cardiovascolari o danno vascolare subclinico ed era quindi in prevenzione primaria. I partecipanti assegnati al trattamento con dulaglutide mostravano nel follow-up livelli più bassi di HbA1c, peso corporeo, BMI, pressione arteriosa e colesterolo totale ed LDL. Nello specifico la terapia con dulaglutide utilizzato per 5,4 anni riduceva l’emoglobina glicata di 0,6%, il peso corporeo di 1,5 kg e la PAS di 1,7 mmHg (in pazienti con pressione basale media di 137 mmHg). Il trattamento con dulaglutide ha dimostrato per tutta la durata del follow-up un controllo glicemico migliore e più bassi livelli di alcuni fattori di rischio cardiovascolare rispetto al placebo. Si osservava un possibile maggior effetto sull’ictus rispetto all’infarto miocardico non fatale ed è stato confermato l’effetto nefroprotettivo. Gli eventi avversi riportati a livello gastrointestinale sono stati nausea, diarrea e vomito. Questi eventi erano generalmente di intensità lieve o moderata, mostravano un picco durante le prime 2 settimane di trattamento e diminuivano rapidamente nelle seguenti 4 settimane. Per quanto concerne l’effetto di dulaglutide sul calo ponderale, lo studio REWIND ha evidenziato però un calo del peso corporeo medio di soli 1,6 kg rispetto al gruppo placebo nei pazienti che assumevano dulaglutide alla dose di 1,5 mg (121).
La tirzepatide è una molecola innovativa che viene definita “twincretin” o meglio “doppio agonista”, poiché si lega sia al recettore del GLP-1 che a quello del “gastric inibitory polipeptide”, oggi noto soprattutto come “glucose-dependent insulinotropic polypeptide” (GIP), con maggiore affinità per quest’ultimo recettore, e la sua duplice azione provoca un effetto additivo, generando anche un aumento significativo della risposta insulinica alla glicemia. La tirzepatide viene somministrata sottocute una volta alla settimana, data la sua emivita di cinque giorni (122). Nello studio SURPASS 3 la pressione basale media dei partecipanti era di 131 mmHg e venne ridotta a 120 mmHg nei pazienti che erano riusciti ad ottenere una riduzione di peso maggiore del 15% (123). Negli studi SURMOUNT questa molecola ha dimostrato una importantissima azione in termini di riduzione dell’emoglobina glicata con un associato effetto sul calo ponderale. Inoltre, i fattori di rischio cardiometabolico misurati al basale nella popolazione dello studio, come la pressione sanguigna e i lipidi, erano relativamente normali, attenuando forse il potenziale di miglioramento, sebbene siano stati osservati cambiamenti significativi in queste variabili. Nello specifico, nello studio SURMOUNT 1 i pazienti che assumevano tirzepatide beneficiavano di una riduzione media della pressione arteriosa di 7,2 mmHg rispetto alla riduzione pressoria di 1 mmHg riscontrata nei pazienti appartenenti al gruppo placebo (124). Lo studio SURPASS-CVOT (125) di fase 3 randomizzato in doppio cieco ha il fine di valutare gli outcomes cardiovascolari di tirzepatide, valutando la non inferiorità e la superiorità di questo farmaco rispetto alla dulaglutide. I risultati di questo studio sono attesi per il prossimo anno. Le aspettative per questa nuova molecola sono molto alte e l’opinione scientifica mondiale parla già di un farmaco rivoluzionario dal punto di vista metabolico, soprattutto per l’efficacia nell’indurre la perdita di peso (122). Oltre ai farmaci sopra descritti, in futuro si avranno a disposizione nuove armi farmacologiche rappresentate dai nuovi analoghi del GLP1 in corso di studio come i promettenti survodutide a pemvirutide.
La survodutide ha attualmente in corso uno studio clinico di fase 2 in pazienti con sovrappeso/obesità e DMT2. Dati preliminari mostrano che, alla dose massima di 4,8 mg, questo farmaco può permettere una perdita di peso del 20% a 46 settimane. Allo stesso tempo tale farmaco è in corso di studio per il trattamento della NAFLD (126).
Pemvirutide non ha effetto sui livelli di glucosio ed attualmente è in studio per il trattamento dell’obesità e della NASH. Nello studio clinico di fase 2 MOMENTUM, a 24 settimane dall’inizio del trattamento si assisteva ad una perdita di peso del 10,7% grazie all’assunzione di pemvirutide 2,4 mg (dose maggiore). La PAS scendeva di 5,5 mmHg e la PAD di 1,8 mmHg nel gruppo di pazienti trattati con il dosaggio di 2,4 mg (127).
Altre opzioni farmacologiche per la riduzione del peso corporeo ma che possono indurre aumento dei valori pressori
L’associazione bupropione/naltrexone è costituita da un inibitore del reuptake della noradrenalina e della dopamina, utilizzato con efficacia per il trattamento della depressione e per la cessazione dell’abitudine tabagica (bupropione) (128) e un antagonista del recettore degli oppioidi (naltrexone) usato per trattare la dipendenza da alcol ed oppiacei. L’attività del sistema incentrato sulla POMC è potentemente stimolata dai livelli di dopamina e norepinefrina (129). La combinazione di entrambi i principi attivi determinerebbe da una parte una stimolazione dell’ipotalamo da parte della dopamina (i cui livelli sono incrementati dal meccanismo inibente del bupropione) a produrre più POMC, che tramite il suo derivato MSH e l’attivazione del recettore MC4R, riduce l’appetito e aumenta la sazietà, mentre dall’altra parte il naltrexone ridurrebbe gli effetti della beta-endorfina, sia bloccando i recettori mu degli oppioidi, che inibiscono la secrezione di POMC, sia diminuendo anche il desiderio della ricerca di cibo e il conseguente piacere nel consumarlo (129). Tale combinazione, approvata nel 2014 da EMA e FDA, trova indicazione in aggiunta a una dieta ipocalorica e all’attività fisica, per la gestione del peso in pazienti adulti con BMI iniziale maggiore o uguale a 30 kg/m², oppure per BMI compreso tra 27 e 29,9 kg/m² in presenza di almeno una comorbilità correlata al peso, quale prediabete o DMT2, qualora gli agonisti del recettore del GLP-1 non vengano tollerati, in quanto non ci sono dati certi in termini di sicurezza cardiovascolare: infatti il bupropione in particolare può aumentare la pressione arteriosa e la frequenza del battito cardiaco. Nello studio di fase 3 con bupropione/naltrexone si è osservato una minima variazione della pressione arteriosa rispetto al placebo e un aumento di 1 bpm della frequenza cardiaca, probabilmente a causa dell’aumento di norepinefrina determinata proprio dal bupropione. Dopo 56 settimane di trattamento, con la perdita di peso, i livelli di pressione arteriosa sembrerebbero ridursi rispetto al basale. Al dosaggio massimo determina una riduzione del 4-6% del peso corporeo in più rispetto al placebo (131). Tale combinazione è anche gravata da effetti collaterali comuni quali nausea, cefalea e costipazione (130). In conclusione, questa associazione non ha un’indicazione primaria nell’obeso iperteso o con pressione alta-normale, ma qualora vi sia un’efficace terapia antipertensiva di combinazione può essere presa in considerazione per gli altri vantaggi che offre la perdita di peso.
Conclusioni
L’obesità rappresenta spesso il fulcro dell’aumento dei valori di pressione arteriosa (dalla alta-normale all’ipertensione arteriosa conclamata) e delle varie problematiche cardio-metaboliche associate, confermando la visione “adipocentrica” di tali affezioni (132,133).
L’obiettivo della presente revisione concettuale è stressare un concetto semplice quanto basato su ampie evidenze: il sovrappeso-obesità viscerale svolge un ruolo cruciale nel determinare una vasta gamma di fattori di rischio cardiovascolare e nel predire la morbilità e mortalità cardiovascolare. Pertanto auspichiamo un salto di qualità nella gestione di tali affezioni, passando da una pratica che possiamo definire come “medicina delle conseguenze”, basata sul trattamento della singola condizione associata all’obesità che tuttavia viene attesa per poter essere gestita, ad una “medicina preventiva proattiva”, basata su un precoce intervento non-farmacologico sullo stile di vita, incentrato su una dieta ipocalorica e un’adeguata attività fisica, cui vada altrettanto precocemente affiancato un approccio farmacologico basato sulle nuove classi farmacologiche disponibili (GLP-1RA e SGLT2-i) che si sono dimostrate efficaci e sicure nel ridurre l’adiposità viscerale e di conseguenza tutti i fattori di rischio che vi orbitano attorno (134). L’approccio dietetico isolato, per quanto valido e indispensabile, tende spesso a fallire prima o poi nella maggior parte dei pazienti, mentre l’utilizzo in combinazione con un GLP-1RA consente di migliorare l’aderenza e la persistenza, e quindi l’efficacia a lungo termine, del regime dietetico. Una linea guida promossa da molteplici società scientifiche italiane, tra cui l’Associazione Medici Endocrinologi (AME) e la Società Italiana dell’Obesità (SIO), inserita tra le linee guida dell’Istituto Superiore di Sanità (ISS) 2023, è stata recentemente pubblicata e si rimanda ad essa per una sintesi esaustiva sul cambiamento dello stile di vita, sulla terapia dietetica, su quella chirurgica e su ulteriori approcci al sovrappeso e all’obesità resistenti al trattamento comportamentale nella popolazione adulta con comorbilità metaboliche (135). La necessità di ricorrere alle nuove terapie farmacologiche anti-obesità, in particolare per il trattamento dell’adiposità viscerale metabolicamente rilevante, è chiara ormai a tutti ed è pertanto auspicabile una rivisitazione delle norme sulla prescrivibilità e sulla durata dei brevetti delle nuove terapie basate sul potenziamento di messaggi ormonali endogeni, al fine di ottenere quanto prima dei “generici” a basso costo per estenderne l’utilizzo alla maggior parte dei pazienti affetti da sovrappeso-obesità con comorbilità cardio-metaboliche. Le spese per i farmaci sono comunque anche adesso probabilmente più convenienti dati i risparmi sanitari legati alla prevenzione cardiovascolare e alla riduzione dei costi della “medicina delle conseguenze” (136).
Un innovativo approccio “adipocentrico” al trattamento dell’ipertensione arteriosa prevede la scelta di una terapia polifarmacologica che miri al raggiungimento dei target pressori adeguati anche tramite la riduzione dell’eccesso di adipe viscerale. Tale approccio è espresso graficamente con una rivisitazione della storica figura di Irvine Page, nell’ottica adipocentrica della problematica cardio-metabolica, con possibili nuove combinazioni terapeutiche spendibili nel paziente obeso-iperteso.
I GLP-1RA e gli inibitori di SGLT2, facilitando le modifiche dello stile di vita e integrandosi in maniera sicura ed efficace con gli altri farmaci per la prevenzione cardiovascolare, incluse anche le necessarie terapie ipocolesterolemizzanti, possono rappresentare un contributo senza precedenti al miglioramento della salute di un’ampia porzione della popolazione.
Bibliografia
- Obesity and overweight. Accessed September 17, 2023. https://www.who.int/news-room/fact- sheets/detail/obesity-and-overweight
- Bentham J, Di Cesare M, Bilano V, et al. Worldwide trends in body-mass index, underweight, overweight, and obesity from 1975 to 2016: a pooled analysis of 2416 population-based measurement studies in 128·9 million children, adolescents, and adults. Lancet. 2017;390(10113):2627-2642. doi:10.1016/S0140-6736(17)32129-3
- Obesità: da amplificatore di rischio a malattia cronica. Accessed November 28, 2022. https://www.siprec.it/siprec-flipbook/DOCUMENTO-SIPREC-2022/
- Obesità – sovrappeso – Dati epidemiologici in Italia. Accessed September 17, 2023. https://www.epicentro.iss.it/obesita/epidemiologia-italia
- A A, MH F, MB R, et al. Health Effects of Overweight and Obesity in 195 Countries over 25 Years. N Engl J Med. 2017;377(1):13-27. doi:10.1056/NEJMOA1614362
- Sarzani R, Castellano M, Cuspidi C, et al. L’ipertensione arteriosa nel paziente obeso. Raccomandazioni congiunte 2014 della Società Italiana dell’Ipertensione Arteriosa (SIIA) e della Società Italiana dell’Obesità (SIO). Ipertensione e Prevenzione Cardiovascolare. 2014;21(2):50-96. doi:10.1713/1549.16891
- Zhou B, Carrillo-Larco RM, Danaei G, et al. Worldwide trends in hypertension prevalence and progress in treatment and control from 1990 to 2019: a pooled analysis of 1201 population- representative studies with 104 million participants. Lancet. 2021;398(10304):957-980. doi:10.1016/S0140-6736(21)01330-1
- Noncommunicable diseases: Risk factors. Accessed January 3, 2024. https://www.who.int/data/gho/data/themes/topics/topic-details/GHO/ncd-risk-factors
- Global report on hypertension: the race against a silent killer. Accessed January 3, 2024. https://www.who.int/publications/i/item/9789240081062
- Cypess AM. Reassessing Human Adipose Tissue. New England Journal of Medicine. 2022;386(8):768-779. doi:10.1056/NEJMRA2032804/SUPPL_FILE/ NEJMRA2032804_DISCLOSURES.PDF
- Mancia G, Kreutz R, Brunström M, et al. 2023 ESH Guidelines for the management of arterial hypertension The Task Force for the management of arterial hypertension of the European Society of Hypertension Endorsed by the European Renal Association (ERA) and the International Society of Hypertension (ISH). J Hypertens. Published online June 21, 2023. doi:10.1097/HJH.0000000000003480
- Yeghiazarians Y, Jneid H, Tietjens JR, et al. Obstructive Sleep Apnea and Cardiovascular Disease: A Scientific Statement From the American Heart Association. Circulation. 2021;144(3):E56-E67. doi:10.1161/CIR.0000000000000988
- Ahmed B, Sultana R, Greene MW. Adipose tissue and insulin resistance in obese. Biomed Pharmacother. 2021;137. doi:10.1016/J.BIOPHA.2021.111315
- Elsayed NA, Aleppo G, Aroda VR, et al. 8. Obesity and Weight Management for the Prevention and Treatment of Type 2 Diabetes: Standards of Care in Diabetes-2023. Diabetes Care. 2023;46(Suppl 1):S128-S139. doi:10.2337/DC23-S008
- Marchesini G, Day CP, Dufour JF, et al. EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. J Hepatol. 2016;64(6):1388-1402. doi:10.1016/J.JHEP.2015.11.004
- Powell-Wiley TM, Poirier P, Burke LE, et al. Obesity and Cardiovascular Disease: A Scientific Statement From the American Heart Association. Circulation. 2021;143(21):E984-E1010. doi:10.1161/CIR.0000000000000973
- Wormser D, Kaptoge S, Di Angelantonio E, et al. Separate and combined associations of body- mass index and abdominal adiposity with cardiovascular disease: collaborative analysis of 58 prospective studies. Lancet. 2011;377(9771):1085-1095. doi:10.1016/S0140-6736(11)60105- 0
- Alberti KGMM, Eckel RH, Grundy SM, et al. Harmonizing the metabolic syndrome: a joint interim statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Circulation. 2009;120(16):1640-1645. doi:10.1161/CIRCULATIONAHA.109.192644
- Galletti F, Agabiti-Rosei E, Bernini G, et al. Excess dietary sodium and inadequate potassium intake by hypertensive patients in Italy: results of the MINISAL-SIIA study program. J Hypertens. 2014;32(1):48-56. doi:10.1097/HJH.0000000000000010
- WHO and FAO. Diet, Nutrition, and the Prevention of Chronic Diseases (Report of a joint WHO and FAO Expert Consulation). WHO Technical Report Series. 2003;916:1-160. Accessed January 3, https://apps.who.int/iris/bitstream/handle/10665/42665/WHO_TRS_916.pdf?sequence=1
- Bell BB, Rahmouni K. Leptin as a Mediator of Obesity-Induced Hypertension. Curr Obes Rep. 2016;5(4):397-404. doi:10.1007/S13679-016-0231-X
- Grassi G, Dell’Oro R, Facchini A, Trevano FQ, Bolla GB, Mancia G. Effect of central and peripheral body fat distribution on sympathetic and baroreflex function in obese normotensives. J Hypertens. 2004;22(12):2363-2369. doi:10.1097/00004872-200412000- 00019
- Hall JE, Brands MW, Henegar JR. Mechanisms of hypertension and kidney disease in obesity. Ann N Y Acad Sci. 1999;892:91-107. doi:10.1111/J.1749-6632.1999.TB07788.X
- Borghi F, Sevá-Pessôa B, Grassi-Kassisse DM. The adipose tissue and the involvement of the renin-angiotensin-aldosterone system in cardiometabolic syndrome. Cell Tissue Res. 2016;366(3):543-548. doi:10.1007/S00441-016-2515-6
- Marcus Y, Shefer G, Stern N. Adipose tissue renin-angiotensin-aldosterone system (RAAS) and progression of insulin resistance. Mol Cell Endocrinol. 2013;378(1-2):1-14. doi:10.1016/J.MCE.2012.06.021
- Sarzani R, Salvi F, Dessì-Fulgheri P, Rappelli A. Renin-angiotensin system, natriuretic peptides, obesity, metabolic syndrome, and hypertension: an integrated view in humans. J Hypertens. 2008;26(5):831-843. doi:10.1097/HJH.0B013E3282F624A0
- Sarzani R, Guerra F, Mancinelli L, Buglioni A, Franchi E, Dess-Fulgheri P. Plasma aldosterone is increased in class 2 and 3 obese essential hypertensive patients despite drug treatment. Am J Hypertens. 2012;25(7):818-826. doi:10.1038/AJH.2012.47
- Spannella F, Giulietti F, Balietti P, et al. Plasma renin activity to plasma aldosterone concentration ratio correlates with night-time and pulse pressures in essential hypertensive patients treated with angiotensin-converting enzyme inhibitors/AT1 blockers. J Hypertens. 2017;35(11):2315-2322. doi:10.1097/HJH.0000000000001438
- Rossing P, Filippatos G, Agarwal R, et al. Finerenone in Predominantly Advanced CKD and Type 2 Diabetes With or Without Sodium-Glucose Cotransporter-2 Inhibitor Therapy. Kidney Int Rep. 2021;7(1):36-45. doi:10.1016/J.EKIR.2021.10.008
- Agarwal R, Filippatos G, Pitt B, et al. Cardiovascular and kidney outcomes with finerenone in patients with type 2 diabetes and chronic kidney disease: the FIDELITY pooled analysis. Eur Heart J. 2022;43(6):474-484A. doi:10.1093/EURHEARTJ/EHAB777
- Sarzani R, Spannella F, Giulietti F, Balietti P, Cocci G, Bordicchia M. Cardiac Natriuretic Peptides, Hypertension and Cardiovascular Risk. High Blood Press Cardiovasc Prev. 2017;24(2):115-126. doi:10.1007/S40292-017-0196-1
- Sarzani R, Allevi M, Di Pentima C, Schiavi P, Spannella F, Giulietti F. Role of Cardiac Natriuretic Peptides in Heart Structure and Function. Int J Mol Sci. 2022;23(22). doi:10.3390/IJMS232214415
- Wang TJ, Larson MG, Levy D, et al. Impact of obesity on plasma natriuretic peptide levels. Circulation. 2004;109(5):594-600. doi:10.1161/01.CIR.0000112582.16683.EA
- Dessì-Fulgheri P, Sarzani R, Tamburrini P, et al. Plasma atrial natriuretic peptide and natriuretic peptide receptor gene expression in adipose tissue of normotensive and hypertensive obese patients. J Hypertens. 1997;15(12):1695-1698. doi:10.1097/00004872-199715120- 00074
- Bordicchia M, Ceresiani M, Pavani M, et al. Insulin/glucose induces natriuretic peptide clearance receptor in human adipocytes: a metabolic link with the cardiac natriuretic pathway. Am J Physiol Regul Integr Comp Physiol. 2016;311(1):R104-R114. doi:10.1152/AJPREGU.00499.2015
- Bordicchia M, Liu D, Amri EZ, et al. Cardiac natriuretic peptides act via p38 MAPK to induce the brown fat thermogenic program in mouse and human adipocytes. J Clin Invest. 2012;122(3):1022-1036. doi:10.1172/JCI59701
- Dessì-Fulgheri P, Sarzani R, Serenelli M, et al. Low calorie diet enhances renal, hemodynamic, and humoral effects of exogenous atrial natriuretic peptide in obese hypertensives. Hypertension. 1999;33(2):658-662. doi:10.1161/01.HYP.33.2.658
- Sarzani R, Paci VM, Zingaretti CM, et al. Fasting inhibits natriuretic peptides clearance receptor expression in rat adipose tissue. J Hypertens. 1995;13(11):1241-1246. doi:10.1097/00004872-199511000-00004
- Dessi-Fulgheri P, Sarzani R, Rappelli A. The natriuretic peptide system in obesity-related hypertension: new pathophysiological aspects. J Nephrol. 1998;11(6):296-299. Accessed March 14, 2023. https://pubmed.ncbi.nlm.nih.gov/10048495/
- Boudin E, de Jong TR, Prickett TCR, et al. Bi-allelic Loss-of-Function Mutations in the NPR- C Receptor Result in Enhanced Growth and Connective Tissue Abnormalities. Am J Hum Genet. 2018;103(2):288-295. doi:10.1016/J.AJHG.2018.06.007
- Bayes-Genis A, Docherty KF, Petrie MC, et al. Practical algorithms for early diagnosis of heart failure and heart stress using NT-proBNP: A clinical consensus statement from the Heart Failure Association of the ESC. Eur J Heart Fail. 2023;25(11). doi:10.1002/EJHF.3036
- Frankenstein L, Remppis A, Nelles M, et al. Relation of N-terminal pro-brain natriuretic peptide levels and their prognostic power in chronic stable heart failure to obesity status. Eur Heart J. 2008;29(21):2634-2640. doi:10.1093/EURHEARTJ/EHN388
- Reddon H, Patel Y, Turcotte M, Pigeyre M, Meyre D. Revisiting the evolutionary origins of obesity: lazy versus peppy-thrifty genotype hypothesis. Obes Rev. 2018;19(11):1525-1543. doi:10.1111/OBR.12742
- Sun K, Kusminski CM, Scherer PE. Adipose tissue remodeling and obesity. J Clin Invest. 2011;121(6):2094-2101. doi:10.1172/JCI45887
- Zhou Z, Macpherson J, Gray SR, et al. Are people with metabolically healthy obesity really healthy? A prospective cohort study of 381,363 UK Biobank participants. Diabetologia. 2021;64(9):1963-1972. doi:10.1007/S00125-021-05484-6
- Zhao H, Huang R, Jiang M, et al. Myocardial Tissue-Level Characteristics of Adults With Metabolically Healthy Obesity. Cardiovascular Imaging. 2023;16(7):889-901. doi:10.1016/J.JCMG.2023.01.022
- Hiuge-Shimizu A, Kishida K, Funahashi T, et al. Absolute value of visceral fat area measured on computed tomography scans and obesity-related cardiovascular risk factors in large-scale Japanese general population (the VACATION-J study). Ann Med. 2012;44(1):82-92. doi:10.3109/07853890.2010.526138
- Neeland IJ, Poirier P, Després JP. Cardiovascular and Metabolic Heterogeneity of Obesity: Clinical Challenges and Implications for Management. Circulation. 2018;137(13):1391-1406. doi:10.1161/CIRCULATIONAHA.117.029617
- Agabiti-Rosei C, Saxton SN, De Ciuceis C, et al. Influence of Perivascular Adipose Tissue on Microcirculation: A Link Between Hypertension and Obesity. Hypertension. 2024;81(1):24-33. doi:10.1161/HYPERTENSIONAHA.123.19437
- Tsvetkov D, Schleifenbaum J, Wang Y, et al. KCNQ5 Controls Perivascular Adipose Tissue– Mediated Vasodilation. Hypertension. Published online December 28, 2023. doi:10.1161/HYPERTENSIONAHA.123.21834
- Browning JD, Horton JD. Molecular mediators of hepatic steatosis and liver injury. J Clin Invest. 2004;114(2):147-152. doi:10.1172/JCI22422
- Golabi P, Otgonsuren M, De Avila L, Sayiner M, Rafiq N, Younossi ZM. Components of metabolic syndrome increase the risk of mortality in nonalcoholic fatty liver disease (NAFLD). Medicine. 2018;97(13). doi:10.1097/MD.0000000000010214
- Rinella ME, Lazarus J V., Ratziu V, et al. A multi-society Delphi consensus statement on new fatty liver disease nomenclature. Ann Hepatol. Published online June 2023:101133. doi:10.1016/J.AOHEP.2023.101133
- Ndumele CE, Neeland IJ, Tuttle KR, et al. A Synopsis of the Evidence for the Science and Clinical Management of Cardiovascular-Kidney-Metabolic (CKM) Syndrome: A Scientific Statement From the American Heart Association. Circulation. 2023;148(20):1636-1664. doi:10.1161/CIR.0000000000001186
- Ruze R, Liu T, Zou X, et al. Obesity and type 2 diabetes mellitus: connections in epidemiology, pathogenesis, and treatments. Front Endocrinol (Lausanne). 2023;14. doi:10.3389/FENDO.2023.1161521
- Bays HE. Adiposopathy is “sick fat” a cardiovascular disease? J Am Coll Cardiol. 2011;57(25):2461-2473. doi:10.1016/J.JACC.2011.02.038
- RR W, P B, FL B, et al. Cardiovascular effects of intensive lifestyle intervention in type 2 diabetes. N Engl J Med. 2013;369(2):145-154. doi:10.1056/NEJMOA1212914
- EW G, JM J, G B, et al. Association of the magnitude of weight loss and changes in physical fitness with long-term cardiovascular disease outcomes in overweight or obese people with type 2 diabetes: a post-hoc analysis of the Look AHEAD randomised clinical trial. Lancet Diabetes Endocrinol. 2016;4(11):913-921. doi:10.1016/S2213-8587(16)30162-0
- Mechanick JI, Farkouh ME, Newman JD, Garvey WT. Cardiometabolic-Based Chronic Disease, Adiposity and Dysglycemia Drivers: JACC State-of-the-Art Review. J Am Coll Cardiol. 2020;75(5):525-538. doi:10.1016/J.JACC.2019.11.044
- Spannella F, Giulietti F, Di Pentima C, Sarzani R. Prevalence and Control of Dyslipidemia in Patients Referred for High Blood Pressure: The Disregarded “Double-Trouble” Lipid Profile in Overweight/Obese. Adv Ther. 2019;36(6):1426-1437. doi:10.1007/S12325-019-00941-6
- Neter JE, Stam BE, Kok FJ, Grobbee DE, Geleijnse JM. Influence of weight reduction on blood pressure: a meta-analysis of randomized controlled trials. Hypertension. 2003;42(5):878-884. doi:10.1161/01.HYP.0000094221.86888.AE
- Cook NR, Appel LJ, Whelton PK. Weight change and mortality: Long-term results from the trials of hypertension prevention. J Clin Hypertens (Greenwich). 2018;20(12):1666-1673. doi:10.1111/JCH.13418
- Dimitriadis K, Tsioufis C, Tousoulis D. Lowering weight equals reduction of mortality: How far are we from the “Ithaka” of ideal weight control? J Clin Hypertens (Greenwich). 2018;20(12):1674-1675. doi:10.1111/JCH.13414
- Lewington S, Clarke R, Qizilbash N, Peto R, Collins R. Age-specific relevance of usual blood pressure to vascular mortality: A meta-analysis of individual data for one million adults in 61 prospective studies. Lancet. 2002;360(9349):1903-1913. doi:10.1016/S0140-6736(02)11911- 8
- Chagnac A, Herman M, Zingerman B, et al. Obesity-induced glomerular hyperfiltration: its involvement in the pathogenesis of tubular sodium reabsorption. Nephrol Dial Transplant. 2008;23(12):3946-3952. doi:10.1093/NDT/GFN379
- Sarzani R, Laureti G, Gezzi A, Spannella F, Giulietti F. Single-pill fixed-dose drug combinations to reduce blood pressure: the right pill for the right patient. Ther Adv Chronic Dis. 2022;13. doi:10.1177/20406223221102754
- Sarzani R, Dessì-Fulgheri P, Rappelli A. Angiotensin receptor blockers: dose does matter. J Hypertens. 2008;26(3):607-608. doi:10.1097/HJH.0B013E3282F47675
- Hollenberg NK, Parving HH, Viberti G, et al. Albuminuria response to very high-dose valsartan in type 2 diabetes mellitus. J Hypertens. 2007;25(9):1921-1926. doi:10.1097/HJH.0B013E328277596E
- Carson P, Tognoni G, Cohn JN. Effect of valsartan on hospitalization: Results from Val-HeFT. J Card Fail. 2003;9(3):164-171. doi:10.1054/jcaf.2003.22
- Ay J, Ohn NC, Ianni G, et al. A Randomized Trial of the Angiotensin-Receptor Blocker Valsartan in Chronic Heart Failure. https://doi.org/101056/NEJMoa010713. 2001;345(23):1667-1675. doi:10.1056/NEJMOA010713
- Cohn JN, Tognoni G, Glazer R, Spormann D. Baseline demographics of the Valsartan Heart Failure Trial. Val-HeFT Investigators. Eur J Heart Fail. 2000;2(4):439-446. doi:10.1016/S1388-9842(00)00130-6
- Parving HH, Lehnert H, Bröchner-Mortensen J, Gomis R, Andersen S, Arner P. The effect of irbesartan on the development of diabetic nephropathy in patients with type 2 diabetes. N Engl J Med. 2001;345(12):870-878. doi:10.1056/NEJMOA011489
- Lewis EJ, Hunsicker LG, Clarke WR, et al. Renoprotective effect of the angiotensin-receptor antagonist irbesartan in patients with nephropathy due to type 2 diabetes. N Engl J Med. 2001;345(12):851-860. doi:10.1056/NEJMOA011303
- Mallamaci F, Ruggenenti P, Perna A, et al. ACE inhibition is renoprotective among obese patients with proteinuria. J Am Soc Nephrol. 2011;22(6):1122-1128. doi:10.1681/ASN.2010090969
- Sarzani R. Lercanidipina nel trattamento dell’ipertensione essenziale e nella prevenzione del danno d’organo. Focus su comuni pazienti a rischio. J Clin Med. 2023;25.
- Grassi G, Robles NR, Seravalle G, Fici F. Lercanidipine in the Management of Hypertension: An Update. J Pharmacol Pharmacother. 2017;8(4):155-165. doi:10.4103/JPP.JPP_34_17
- De Ciuceis C, Salvetti M, Paini A, et al. Comparison of lercanidipine plus hydrochlorothiazide vs. lercanidipine plus enalapril on micro and macrocirculation in patients with mild essential hypertension. Intern Emerg Med. 2017;12(7):963-974. doi:10.1007/S11739-017-1696-7
- Brixius K, Gross T, Tossios P, et al. Increased vascular selectivity and prolonged pharmacological efficacy of the L-type Ca2+ channel antagonist lercanidipine in human cardiovascular tissue. Clin Exp Pharmacol Physiol. 2005;32(9):708-713. doi:10.1111/J.1440- 1681.2005.04265.X
- Jamerson K, Weber MA, Bakris GL, et al. Benazepril plus amlodipine or hydrochlorothiazide for hypertension in high-risk patients. N Engl J Med. 2008;359(23):2417-2428. doi:10.1056/NEJMOA0806182
- Jamerson KA, Devereux R, Bakris GL, et al. Efficacy and duration of benazepril plus amlodipine or hydrochlorothiazide on 24-hour ambulatory systolic blood pressure control. Hypertension. 2011;57(2):174-179. doi:10.1161/HYPERTENSIONAHA.110.159939
- Weber MA, Jamerson K, Bakris GL, et al. Effects of body size and hypertension treatments on cardiovascular event rates: subanalysis of the ACCOMPLISH randomised controlled trial. Lancet. 2013;381(9866):537-545. doi:10.1016/S0140-6736(12)61343-9
- Zhang Y, Ly C, Yannoutsos A, et al. Effect of a fixed combination of Perindopril and Amlodipine on blood pressure control in 6256 patients with not-at-goal hypertension: the AVANT’AGE study. J Am Soc Hypertens. 2013;7(2):163-169. doi:10.1016/J.JASH.2013.01.006
- Sarzani R, Giulietti F, Di Pentima C, Spannella F. Sodium-glucose co-transporter-2 inhibitors: peculiar “hybrid” diuretics that protect from target organ damage and cardiovascular events. Nutr Metab Cardiovasc Dis. 2020;30(10):1622-1632. doi:10.1016/J.NUMECD.2020.05.030
- Ansary TM, Nakano D, Nishiyama A. Diuretic Effects of Sodium Glucose Cotransporter 2 Inhibitors and Their Influence on the Renin-Angiotensin System. Int J Mol Sci. 2019;20(3). doi:10.3390/IJMS20030629
- Wilcox CS. Antihypertensive and Renal Mechanisms of SGLT2 (Sodium-Glucose Linked Transporter 2) Inhibitors. Hypertension. 2020;75(4):894-901. doi:10.1161/HYPERTENSIONAHA.119.11684
- Beal B, Schutte AE, Neuen BL. Blood Pressure Effects of SGLT2 Inhibitors: Mechanisms and Clinical Evidence in Different Populations. Curr Hypertens Rep. 2023;25(12). doi:10.1007/S11906-023-01281-1
- Tonneijck L, Muskiet MHA, Smits MM, et al. Glomerular Hyperfiltration in Diabetes: Mechanisms, Clinical Significance, and Treatment. J Am Soc Nephrol. 2017;28(4):1023-1039. doi:10.1681/ASN.2016060666
- Melsom T, Schei J, Stefansson VTN, et al. Prediabetes and Risk of Glomerular Hyperfiltration and Albuminuria in the General Nondiabetic Population: A Prospective Cohort Study. Am J Kidney Dis. 2016;67(6):841-850. doi:10.1053/J.AJKD.2015.10.025
- Desai AS, Jhund PS, Claggett BL, et al. Effect of Dapagliflozin on Cause-Specific Mortality in Patients With Heart Failure Across the Spectrum of Ejection Fraction: A Participant-Level Pooled Analysis of DAPA-HF and DELIVER. JAMA Cardiol. Published online 2022. doi:10.1001/JAMACARDIO.2022.3736
- Solomon SD, McMurray JJV, Claggett B, et al. Dapagliflozin in Heart Failure with Mildly Reduced or Preserved Ejection Fraction. New England Journal of Medicine. 2022;387(12):1089-1098. doi:10.1056/NEJMOA2206286/SUPPL_FILE/NEJMOA2206286_DATA-SHARING.PDF
- Selvaraj S, Vaduganathan M, Claggett BL, et al. Blood Pressure and Dapagliflozin in Heart Failure With Mildly Reduced or Preserved Ejection Fraction: DELIVER. JACC Heart Fail. 2023;11(1):76-89. doi:10.1016/J.JCHF.2022.09.002
- Heerspink HJL, Stefánsson B V., Correa-Rotter R, et al. Dapagliflozin in Patients with Chronic Kidney Disease. N Engl J Med. 2020;383(15):1436-1446. doi:10.1056/NEJMOA2024816
- Cherney DZI, Dekkers CCJ, Barbour SJ, et al. Effects of the SGLT2 inhibitor dapagliflozin on proteinuria in non-diabetic patients with chronic kidney disease (DIAMOND): a randomised, double-blind, crossover trial. Lancet Diabetes Endocrinol. 2020;8(7):582-593. doi:10.1016/S2213-8587(20)30162-5
- Packer M, Anker SD, Butler J, et al. Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure. N Engl J Med. 2020;383(15):1413-1424. doi:10.1056/NEJMOA2022190
- Anker SD, Butler J, Filippatos G, et al. Empagliflozin in Heart Failure with a Preserved Ejection Fraction. N Engl J Med. 2021;385(16):1451-1461. doi:10.1056/NEJMOA2107038
- Savarese G, Uijl A, Lund LH, et al. Empagliflozin in Heart Failure With Predicted Preserved Versus Reduced Ejection Fraction: Data From the EMPA-REG OUTCOME Trial. J Card Fail. 2021;27(8):888-895. doi:10.1016/J.CARDFAIL.2021.05.012
- Scheen AJ. Effects of reducing blood pressure on cardiovascular outcomes and mortality in patients with type 2 diabetes: Focus on SGLT2 inhibitors and EMPA-REG OUTCOME. Diabetes Res Clin Pract. 2016;121:204-214. doi:10.1016/J.DIABRES.2016.09.016
- Requena-Ibáñez JA, Santos-Gallego CG, Rodriguez-Cordero A, et al. Mechanistic Insights of Empagliflozin in Nondiabetic Patients With HFrEF: From the EMPA-TROPISM Study. JACC Heart Fail. 2021;9(8):578-589. doi:10.1016/J.JCHF.2021.04.014
- WG H, N S, C W, et al. Empagliflozin in Patients with Chronic Kidney Disease. N Engl J Med. Published online November 4, 2022. doi:10.1056/NEJMOA2204233
- Neal B, Perkovic V, Mahaffey KW, et al. Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes. New England Journal of Medicine. 2017;377(7):644-657. doi:10.1056/NEJMOA1611925/SUPPL_FILE/NEJMOA1611925_DISCLOSURES.PDF
- Matthews DR, Li Q, Perkovic V, et al. Effects of canagliflozin on amputation risk in type 2 diabetes: the CANVAS Program. Diabetologia. 2019;62(6). doi:10.1007/S00125-019-4839-8
- Carbone S, Dixon DL. The CANVAS Program: implications of canagliflozin on reducing cardiovascular risk in patients with type 2 diabetes mellitus. Cardiovasc Diabetol. 2019;18(1). doi:10.1186/S12933-019-0869-2
- Jardine MJ, Mahaffey KW, Neal B, et al. The Canagliflozin and Renal Endpoints in Diabetes with Established Nephropathy Clinical Evaluation (CREDENCE) Study Rationale, Design, and Baseline Characteristics. Am J Nephrol. 2017;46(6):462-472. doi:10.1159/000484633
- Ye N, Jardine MJ, Oshima M, et al. Blood Pressure Effects of Canagliflozin and Clinical Outcomes in Type 2 Diabetes and Chronic Kidney Disease: Insights From the CREDENCE Trial. Circulation. 2021;143(18):1735-1749. doi:10.1161/CIRCULATIONAHA.120.048740
- Müller TD, Finan B, Bloom SR, et al. Glucagon-like peptide 1 (GLP-1). Mol Metab. 2019;30:72-130. doi:10.1016/J.MOLMET.2019.09.010
- Secher A, Jelsing J, Baquero AF, et al. The arcuate nucleus mediates GLP-1 receptor agonist liraglutide-dependent weight loss. J Clin Invest. 2014;124(10):4473-4488. doi:10.1172/JCI75276
- Van Can J, Sloth B, Jensen CB, Flint A, Blaak EE, Saris WHM. Effects of the once-daily GLP- 1 analog liraglutide on gastric emptying, glycemic parameters, appetite and energy metabolism in obese, non-diabetic adults. Int J Obes (Lond). 2014;38(6):784-793. doi:10.1038/IJO.2013.162
- Avogaro A, Azzolina D, Gregori D, De Kreutzenberg S, Fadini GP, Mannucci E. The effect of GLP-1 receptor agonists on N-terminal pro-brain natriuretic peptide. A scoping review and metanalysis. Int J Cardiol. 2022;357:123-127. doi:10.1016/J.IJCARD.2022.03.032
- SP M, GH D, K BF, et al. Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med. 2016;375(4):101. doi:10.1056/NEJMOA1603827
- Neeland IJ, Marso SP, Ayers CR, et al. Effects of liraglutide on visceral and ectopic fat in adults with overweight and obesity at high cardiovascular risk: a randomised, double-blind, placebo-controlled, clinical trial. Lancet Diabetes Endocrinol. 2021;9(9):595-605. doi:10.1016/S2213-8587(21)00179-0
- Knudsen LB, Lau J. The Discovery and Development of Liraglutide and Semaglutide. Front Endocrinol (Lausanne). 2019;10(APR). doi:10.3389/FENDO.2019.00155
- Robinson LE, Holt TA, Rees K, Randeva HS, O’Hare JP. Effects of exenatide and liraglutide on heart rate, blood pressure and body weight: systematic review and meta-analysis. BMJ Open. 2013;3(1). doi:10.1136/BMJOPEN-2012-001986
- Marso SP, Bain SC, Consoli A, et al. Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. New England Journal of Medicine. 2016;375(19):1834-1844. doi:10.1056/NEJMOA1607141/SUPPL_FILE/NEJMOA1607141_DISCLOSURES.PDF
- Lincoff AM, Brown-Frandsen K, Colhoun HM, et al. Semaglutide and Cardiovascular Outcomes in Obesity without Diabetes. N Engl J Med. 2023;389(24). doi:10.1056/NEJMOA2307563
- Husain M, Birkenfeld AL, Donsmark M, et al. Oral Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med. 2019;381(9):841-851. doi:10.1056/NEJMOA1901118
- Volpe S, Lisco G, Fanelli M, et al. Oral semaglutide improves body composition and preserves lean mass in patients with type 2 diabetes: a 26-week prospective real-life study. Front Endocrinol (Lausanne). 2023;14. doi:10.3389/FENDO.2023.1240263
- Candido R, Gaiotti S, Giudici F, et al. Real-World Retrospective Study into the Effects of Oral Semaglutide (As a Switchover or Add-On Therapy) in Type 2 Diabetes. J Clin Med. 2023;12(18). doi:10.3390/JCM12186052
- Yanai H, Hakoshima M, Adachi H, Katsuyama H. A Significant Effect of Oral Semaglutide on Cardiovascular Risk Factors in Patients With Type 2 Diabetes. Cardiol Res. 2022;13(5):303-308. doi:10.14740/CR1441
- Wu W, Tong H mu, Li Y sheng, Cui J. The effect of semaglutide on blood pressure in patients with type-2 diabetes: a systematic review and meta-analysis. Endocrine. Published online 2023. doi:10.1007/S12020-023-03636-9
- Lunati ME, Cimino V, Bernasconi D, et al. Type 2 diabetes mellitus pharmacological remission with dapagliflozin plus oral semaglutide. Pharmacol Res. 2023;199:107040. doi:10.1016/J.PHRS.2023.107040
- Gerstein HC, Colhoun HM, Dagenais GR, et al. Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): a double-blind, randomised placebo-controlled trial. Lancet. 2019;394(10193):121-130. doi:10.1016/S0140-6736(19)31149-3
- Sattar N, McGuire DK, Pavo I, et al. Tirzepatide cardiovascular event risk assessment: a pre- specified meta-analysis. Nat Med. 2022;28(3):591-598. doi:10.1038/S41591-022-01707-4
- Małecki MT, Batterham RL, Sattar N, et al. Predictors of ≥15% Weight Reduction and Associated Changes in Cardiometabolic Risk Factors With Tirzepatide in Adults With Type 2 Diabetes in SURPASS 1-4. Diabetes Care. 2023;46(12). doi:10.2337/DC23-1135
- Le Roux CW, Zhang S, Aronne LJ, et al. Tirzepatide for the treatment of obesity: Rationale and design of the SURMOUNT clinical development program. Obesity (Silver Spring). 2023;31(1):96-110. doi:10.1002/OBY.23612
- Study Record | ClinicalTrials.gov. Accessed September 18, 2023. https://clinicaltrials.gov/study/NCT04255433
- Blüher M, Rosenstock J, Hoefler J, Manuel R, Hennige AM. Dose-response effects on HbA1c and bodyweight reduction of survodutide, a dual glucagon/GLP-1 receptor agonist, compared with placebo and open-label semaglutide in people with type 2 diabetes: a randomised clinical trial. Diabetologia. Published online 2023. doi:10.1007/S00125-023-06053-9
- Tucker EM. New “Twincretin” Pemvidutide: Another Option for Obesity. Medscape.
- Stahl SM, Pradko JF, Haight BR, Modell JG, Rockett CB, Learned-Coughlin S. A Review of the Neuropharmacology of Bupropion, a Dual Norepinephrine and Dopamine Reuptake Inhibitor. Prim Care Companion J Clin Psychiatry. 2004;6(4):159-166. doi:10.4088/PCC.V06N0403
- Billes SK, Sinnayah P, Cowley MA. Naltrexone/bupropion for obesity: an investigational combination pharmacotherapy for weight loss. Pharmacol Res. 2014;84:1-11. doi:10.1016/J.PHRS.2014.04.004
- Apovian CM, Aronne L, Rubino D, et al. A randomized, phase 3 trial of naltrexone SR/bupropion SR on weight and obesity-related risk factors (COR-II). Obesity (Silver Spring). 2013;21(5):935-943. doi:10.1002/OBY.20309
- Aaseth J, Ellefsen S, Alehagen U, Sundfør TM, Alexander J. Diets and drugs for weight loss and health in obesity – An update. Biomed Pharmacother. 2021;140. doi:10.1016/J.BIOPHA.2021.111789
- Sarzani R, Spannella F, Falcioni P, et al. The adipo-centric nature of the common metabolic, cardiovascular, and renal conditions in obese patients. G Ital Arterioscler. 2023;14(4):31-58.
- Sarzani R, Spannella F, Falcioni P, et al. The adipo-centric nature of the common metabolic, cardiovascular, and renal conditions in obese patients. G Ital Arterioscler. 2023;14(4):11-30.
- Elmaleh-Sachs A, Schwartz JL, Bramante CT, Nicklas JM, Gudzune KA, Jay M. Obesity Management in Adults: A Review. JAMA. 2023;330(20):2000-2015. doi:10.1001/JAMA.2023.19897
- Associazione Medici Endocrinologi – Linea Guida ISS su Terapia del sovrappeso e dell’obesità resistenti al trattamento comportamentale nella popolazione adulta con comorbilità metaboliche. Accessed July 1, 2023. http://associazionemediciendocrinologi.it/index.php/position-statement/position-statement-2022/4698-linee-guida-terapia-del-sovrappeso-e-dell-obesita-resistenti-al-trattamento-comportamentale-nella-popolazione-adulta-con-comorbilita-metaboliche
- Alhiary R, Kesselheim AS, Gabriele S, Beall RF, Tu SS, Feldman WB. Patents and Regulatory Exclusivities on GLP-1 Receptor Agonists. JAMA. Published online July 28, 2023. doi:10.1001/JAMA.2023.13872
Abstract
L’obesità è una malattia cronica multifattoriale caratterizzata da eccessivo accumulo di adipe spesso a distribuzione viscerale, che porta a numerose conseguenze cardio-metaboliche, tra cui l’aumento dei valori di pressione arteriosa sistemica. Considerare l’obesità non solo come fattore di rischio, ma come elemento centrale all’origine di numerose malattie metaboliche, cardiovascolari e renali, permette di superare l’approccio settoriale delle patologie legate all’obesità. Una visione “adipocentrica” trova il proprio fulcro nel trattamento del sovrappeso/obesità viscerale e nella gestione integrata del paziente, al fine di evitare complicanze cliniche e ridurre morbilità e mortalità obesità-correlate. Insieme alle terapie farmacologiche per l’ipertensione arteriosa, nel panorama terapeutico per la riduzione del peso corporeo, accanto all’orlistat e all’associazione bupropione/naltrexone, si sono aggiunti recentemente gli agonisti del recettore del peptide-1 simile al glucagone (GLP1-RA), come liraglutide e semaglutide. Questi farmaci, inizialmente considerati solo per il trattamento del diabete mellito di tipo 2 (DMT2), sono attualmente utilizzati in molti pazienti in sovrappeso con adiposità viscerale o obesi, mostrando numerosi effetti positivi anche in assenza di DMT2. Anche gli inibitori del co-trasportatore sodio-glucosio di tipo 2 (SGLT2-i) stanno rivoluzionando la gestione del DMT2 e dell’obesità, nonché la protezione cardio-renale anche in assenza di DMT2. Entrambe queste classi di farmaci si integrano in maniera ottimale con le varie tipologie di anti-ipertensivi. Sulla base dei recenti progressi della ricerca di base e clinica sull’adiposità e sulla base delle nuove terapie disponibili, questa rassegna intende contribuire a un nuovo approccio clinico concettuale, con approfondimenti fisiopatologici e terapeutici, considerando l’ipertensione arteriosa essenziale come una complicanza spesso direttamente correlata all’eccesso di adipe e agli associati pattern alimentari.
Parole chiave: Obesità, sovrappeso, adiposità viscerale, adipocentricità, ipertensione, agonisti recettore GLP-1, inibitori SGLT-2, cardiometabolico, eventi cardiovascolari.
Introduzione
Il termine “adipocentricità” viene coniato per identificare un denominatore comune, nonché primum movens, di condizioni cardio-metaboliche altamente prevalenti, rappresentato dall’obesità, soprattutto di tipo viscerale. L’obesità è una condizione patologica cronica multifattoriale che si contraddistingue per l’eccesso di tessuto adiposo. L’Organizzazione Mondiale della Sanità (OMS) la definisce sulla base di un indice di massa corporea (body mass index, BMI) uguale o superiore a 30 kg/m2 (1). Dalla metà degli anni ‘70 ai giorni nostri, l’incidenza mondiale di sovrappeso (BMI ≥ 25 kg/m2) e obesità è quasi triplicata. Circa il 36% degli adulti a livello globale (1,9 miliardi di individui) risulta in sovrappeso, mentre oltre il 13% (650 milioni di individui) risulta obesa (2). Dalle stime elaborate dall’OMS, entro il 2025 il 18% degli uomini e il 21% delle donne sarà obeso, mentre il 40% della popolazione mondiale sarà in sovrappeso (3). Nel caso specifico dell’Italia, almeno una persona su dieci è obesa e complessivamente il 45% degli individui con età > 18 anni è in sovrappeso (4). In un recente studio veniva evidenziato come quasi quattro milioni di morti all’anno a livello globale siano correlati direttamente all’obesità e alle sue complicanze cardiovascolari (5). In particolare, l’obesità rappresenta il fattore più comune e frequente per lo sviluppo dell’ipertensione arteriosa essenziale (IAE). Si stima che almeno un 75% dei casi di ipertensione arteriosa possa essere attribuibile al fenotipo sovrappeso/obesità soprattutto quando coesiste una predisposizione genetica (6). Numerosi fattori genetici, ambientali-sociali ed anche comportamentali hanno portato contemporaneamente non solo alla nota “epidemia di obesità”, ma anche all’aumentata prevalenza dell’IAE, più che duplicata dal 1990 al 2019, arrivando a colpire 626 milioni di donne e 652 milioni di uomini nel 2019 (7). Si stima che l’ipertensione affligga il 33% degli adulti di età compresa tra 30 e 79 anni in tutto il mondo (stima standardizzata per età) (8). A livello globale, la prevalenza dell’ipertensione è leggermente superiore nel sesso maschile (34%) rispetto a quello femminile (32%). Il numero di adulti con ipertensione è raddoppiato, passando da 650 milioni nel 1990 a 1,3 miliardi nel 2019 (9). La prevalenza di ipertensione arteriosa è sensibilmente maggiore nei pazienti in sovrappeso o obesi rispetto ai pazienti normopeso, a causa dell’alterazione di diversi meccanismi e circuiti neuroumorali e metabolici, in particolare la disregolazione del sistema nervoso simpatico (SNS), del sistema renina-angiotensina-aldosterone (SRAA) e del sistema dei peptidi natriuretici cardiaci (SPNC) che, associati a predisposizione genetica, a fattori ambientali e ad abitudini di vita, contribuiscono all’aumento dei valori pressori in tali individui.
Le principali localizzazioni del tessuto adiposo sono quella sottocutanea e quella viscerale (10). L’obesità definita “centrale” o viscerale si distingue per accumulo di adipe in eccesso a livello intraddominale, mediastinico, epicardico, nelle regioni del collo e nella lingua, con infiltrazioni intraparenchimali come quella cardiaca e renale. È un tessuto adiposo diffuso che accompagna i vasi sanguigni e circonda e infiltra organi e muscoli scheletrici. Questo genere di obesità è quella maggiormente associata ad ipertensione arteriosa (sia diurna che notturna), ad aritmie, a dislipidemia, a steatosi epatica, a sindrome metabolica, ad insulino-resistenza, a prediabete e DMT2, e infine ad un aumento di eventi cardiovascolari (sopratutto ictus e scompenso cardiaco ma anche cardiopatia ischemica) (11–15). Il rischio di scompenso cardiaco a frazione di eiezione preservata, di aritmie quali fibrillazione atriale e aritmie ventricolari, di patologie a carico dell’apparato respiratorio e di mortalità per tutte le cause risulta nettamente aumentato negli obesi (16). L’obesità rappresenta un fattore di rischio cardiovascolare indipendente (17) e circa il 60% dei decessi per cause cardiovascolari sono registrate in soggetti obesi (5). Il danno diffuso ai piccoli vasi del microcircolo (arteriolosclerosi) ed ai grandi vasi (arteriosclerosi), caratteristico dell’aumento cronico della pressione arteriosa che accompagna l’obesità viscerale e la presenza di accelerata aterosclerosi determinante placche “instabili” prone a complicanze quali trombosi e trombo-embolie arteriose, sono alla base delle note e più comuni patologie cardiovascolari di questi pazienti.
Da quanto sopra riportato, consegue l’importanza di riconoscere la natura “adipocentrica” dei comuni fattori di rischio metabolici e cardiovascolari citati. Da notare come anche solo un lieve sovrappeso, quando associato ad “obesità viscerale”, possa comportare conseguenze identiche a quelle riscontrabili nell’obesità conclamata. Vi è consapevolezza dalla fine degli anni ’80 della “sindrome metabolica”, incentrata proprio sull’obesità centrale e sulle associate alterazioni metaboliche e cardiovascolari, e nel 2009 è stato pubblicato un documento di consenso internazionale sull’argomento (18). Questa ampia rassegna “concettuale” si focalizza sul ruolo dell’eccesso di adiposità, specie viscerale, nel determinare lo sviluppo dell’IAE e il suo ulteriore ruolo nello sviluppo delle complicanze cardiovascolari. Si approfondirà anche sulle nuove opportunità terapeutiche nel trattamento dell’eccesso di adipe, condizione spesso sottovalutata in ambito clinico, dove per troppi anni ci si è solamente concentrati sulle conseguenze della stessa, spesso senza nemmeno realizzare che erano appunto conseguenze di una comune condizione sottovalutata anche dal punto di vista fisiopatologico.
Fisiopatologia adipocentrica dell’ipertensione arteriosa
Obesità con pressione arteriosa normale-alta e con ipertensione arteriosa
È stato documentato che oltre all’eccessivo introito calorico, nel paziente obeso iperteso vi sia un eccessivo introito di sale con la dieta, fino ad una media di oltre 10 grammi al giorno, ovvero più del doppio della quantità raccomandata dall’OMS (19,20). Obesità, quindi, è spesso sinonimo anche di dieta inappropriatamente ricca di sale. L’eccesso di adipe si accompagna quindi non solo ad un introito alimentare eccessivo rispetto ai consumi energetici, ma anche alla preferenza di cibi spesso ricchi in sodio e poveri in potassio, altro fattore che influenza la pressione arteriosa riducendola quando è abbondante nella dieta.
L’eccessivo aumento di tessuto adiposo, specie se viscerale, ha molte conseguenze biologiche, tra cui un aumento dei livelli di leptina circolante, che nel paziente obeso ha una minore efficacia a livello ipotalamico nella regolazione di fame e sazietà, mentre si pensa venga mantenuta piena attività di stimolo a livello del SNS e a livello renale (21). Di conseguenza, si assiste ad una cronica iper-attivazione del SNS (22) che contribuisce, assieme alla frequente sedentarietà, all’aumento della frequenza cardiaca e, a livello renale, all’iperfiltrazione glomerulare accoppiata ad un eccessivo riassorbimento tubulare di sodio (23). L’adipe in eccesso favorisce l’aumento dei livelli circolanti di aldosterone tramite adipochine, tra cui l’angiotensinogeno, precursore delle angiotensine, e tramite derivati lipidici legati all’eccesso circolante di lipoproteine a densità molto bassa (VLDL) e i loro remnants ricchi di trigliceridi (24,25). Ne risulta che il paziente obesoiperteso ha spesso un quadro di relativo iperaldosteronismo secondario (in assenza cioè di soppressione della renina), che favorisce l’ulteriore incremento del riassorbimento di sodio a livello del tubulo distale, in un contesto caratterizzato da disregolazione del SRAA. Infatti, nel soggetto obeso iperteso, nonostante una dieta caratterizzata da eccessivo introito di sale, non si assiste alla soppressione dell’attività reninica né dell’attività mineralcorticoide con valori plasmatici “inappropriatamente normali” di renina, di attività reninica e di aldosterone (19,26). In questa tipologia di pazienti è stato anche documentato il fenomeno di “escape” della secrezione di aldosterone dall’attività farmacologica di ACE-inibitori e antagonisti del recettore AT1 dell’angiotensina II (sartani), in relazione fisiopatologica con l’eccesso di adipe (27). Per valutare rapidamente l’inibizione del SRAA e correlarla all’efficacia della terapia con ACE-inibitori o sartani, è stato proposto il rapporto renina plasmatica/aldosterone plasmatico (Renin-to-Aldosterone Ratio, RAR). Tale indice risulta essere il reciproco di quello usato nello screening dell’iperaldosteronismo primitivo (Aldosterone-to-Renin Ratio, ARR). Valori maggiori di RAR si associano a miglior controllo pressorio nelle 24 ore ed in particolare a maggior controllo della pressione arteriosa notturna documentata al monitoraggio ambulatoriale della pressione arteriosa (ABPM) (28). La presenza di RAR elevato è correlato a buona efficacia della terapia con ACE-inibitori o sartani. Il meccanismo d’azione di questi farmaci attraverso l’antagonismo dell’angiotensina-II determina infatti un aumento di renina per riduzione del feedback negativo dell’angiotensina-II sulla secrezione della stessa e una riduzione della secrezione di aldosterone dipendente da una minore produzione di angiotensina II o da blocco del recettore AT1. Un basso RAR, al contrario, può essere dovuto all’assunzione di dosaggi inadeguati di tali farmaci, o può smascherare un’inadeguata aderenza alla terapia, principale causa di ipertensione (pseudo)resistente. Quando si assiste al fenomeno definito “escape” della secrezione di aldosterone è indicato l’utilizzo di un antagonismo dell’angiotensina-II più efficace, ricorrendo in particolare a dosi piene di ACE-inibitori o sartani per garantire una adeguata copertura delle 24 ore, o ad antagonisti dell’aldosterone, come canrenone ed eplerenone, farmaci di scelta nelle vere ipertensioni resistenti, cioè in caso di pazienti non adeguatamente controllati nonostante una triplice terapia con ACE-inibitore o sartano + diuretico tiazidico o tiazidico-simile + calcio antagonista a dosaggi adeguati (11). Evidenze recenti su pazienti obesi, mostrano come il finerenone (un antagonista non steroideo del recettore mineralcorticoide) rallenti la progressione del danno renale e cardiovascolare in pazienti con nefropatia diabetica (29). Sebbene siano stati ipotizzati vari meccanismi, il finerenone agisce principalmente antagonizzando il riassorbimento distale del sodio e riducendo quindi la pressione arteriosa, con conseguente riduzione del rischio di ospedalizzazione per scompenso cardiaco, senza tuttavia ridurre in modo significativo la mortalità per tutte le cause. Nell’analisi combinata del FIDELITY si è evidenziato come il finerenone riduca gli eventi cardio-renali nei pazienti con malattia renale diabetica (30). Tutti i pazienti arruolati assumevano una dose massima tollerata di ACE-inibitori o sartani. Tuttavia, la pressione arteriosa sistolica (PAS) media al basale era di 136,7 ± 14,2 mmHg, mentre dopo 4 mesi dall’inizio dello studio la PAS si era ridotta di 3,2 mmHg rispetto al basale nel gruppo finerenone, mentre era aumentata di 0,5 mmHg nel gruppo placebo, indicando come il finerenone abbia avuto un effetto rilevante sulla riduzione della PAS (-3,7 mmHg vs. placebo).
Ulteriore fondamentale meccanismo fisiopatologico caratteristico del paziente obeso è la disregolazione del SPNC, per alterato metabolismo e ridotta azione dei peptidi natriuretici cardiaci (ANP e BNP), che agiscono legandosi al recettore NPRA (generando GMP-ciclico come secondo messaggero), recettore espresso in molti tipi cellulari e organi, tra cui rene, surrene, organo adiposo, cuore e muscolo liscio vasale (31,32). Il ruolo di questi peptidi è quello di inibire e antagonizzare gli effetti del SRAA, in primis a livello renale, determinando aumento della perfusione e natriuresi. Agiscono inoltre inibendo il riassorbimento di sodio a livello del tubulo prossimale similmente agli inibitori del co-trasportatore SGLT2, ma hanno anche azione inibitoria diretta sul riassorbimento del sodio a livello del tubulo distale. Nel distretto vascolare producono una vasodilatazione sia sul versante arterioso che venoso (31). Nei pazienti obesi, l’aumentata clearance di questi peptidi fa sì che i loro livelli plasmatici risultino ridotti rispetto ai pazienti sovrappeso e normopeso, indipendentemente dal sesso (32,33) (Figura 1). Una spiegazione di questo dato sta nell’inferiore rapporto tra recettore NPRA e recettore di clearance dei peptidi natriuretici (NPRC) nel tessuto adiposo di pazienti obesi ipertesi confrontato con il tessuto adiposo di pazienti ipertesi normopeso (34).
Nell’ipertensione obesità-correlata, tali peptidi ed i loro sistemi recettoriali sembrano rivestire un ruolo chiave anche per le implicazioni metaboliche. Infatti, insulina e glucosio determinano uno spiccato aumento dell’espressione di NPRC negli adipociti umani, con conseguente ridotta attività biologica dei peptidi natriuretici, tra le quali spicca la grande efficacia nell’indurre lipolisi e natriuresi (35). Ne consegue che a causa dell’eccessivo apporto calorico con l’alimentazione, specie se a base di cibi o bevande determinanti picchi glicemici e insulinemici, viene favorito l’accumulo di trigliceridi negli adipociti che diventano più ipertrofici e insulino-resistenti, mentre viene ridotto il “browning” dell’adipocita da parte dei peptidi natriuretici, ovvero la trans-differenziazione tra tessuto adiposo bianco e tessuto adiposo beige e bruno, ricco di mitocondri e di “uncoupling protein” (UCP) che facilita la dissipazione di energia sotto forma di calore (36). È stato dimostrato come in pazienti obesi ipertesi trattati con dieta fortemente ipocalorica vi sia uno spiccato aumento di efficacia biologica e clinica di un’infusione di ANP (37). D’altro canto, sia la natriuresi che la diuresi con la riduzione della pressione arteriosa indotta dal digiuno sono almeno in parte il risultato di una spiccata soppressione di NPRC nel tessuto adiposo. Infatti, il digiuno sopprime in maniera tessuto-specifica e gene-specifica l’espressione del gene NPRC nel tessuto adiposo, con conseguente incremento dell’attività biologica dell’ANP. Il drastico decremento dei livelli dell’RNA messaggero di NPRC veniva osservato nel tessuto adiposo bruno e bianco, mentre l’espressione di NPRA nel tessuto adiposo rimaneva costante o tendeva ad aumentare con il digiuno (38). Invece, a livello della corteccia renale, i livelli di RNA messaggero di NPRC e NPRA non sembrano condizionati dal digiuno (39). Pazienti nati con deficit omozigote per il gene codificante NPRC sono generalmente di alta statura, sottopeso e con pressione arteriosa bassa, a conferma del ruolo cardio-metabolico chiave rivestito dai peptidi natriuretici e dal loro metabolismo (40).
Inoltre, a testimonianza dell’importante ruolo rivestito dall’obesità nel ridurre i livelli circolanti di peptidi natriuretici, la Heart Failure Association della Società Europea di Cardiologia (ESC) indica, in un documento di consenso del 2023, di utilizzare una riduzione almeno del 40% del cut-off dei valori di peptidi natriuretici circolanti per fare diagnosi di scompenso cardiaco in pazienti con BMI oltre i 40 kg/m2. Viene invece suggerita una riduzione del 25% per valori di BMI compresi tra 30 e 35 kg/m2 e una riduzione del 30% per valori di BMI compresi tra 35 e 40 kg/m2 (41), sebbene tale approccio non sia stato attualmente ancora validato (42). L’insieme dei meccanismi fisiopatologici sopra descritti è sufficiente anche a spiegare la tendenza alla ritenzione idrosalina nei pazienti obesi, specie di sesso femminile e soprattutto se in menopausa, in cui il comune sintomo riferito come “sensazione di gonfiore” ha quindi anche una reale base fisiopatologica e clinica. Per quanto questa tipologia di pazienti richieda quasi costantemente una terapia diuretica per ottenere un adeguato controllo dei valori pressori, la persistenza di una dieta ricca di sodio e povera di potassio conduce ad aumento della pressione arteriosa e tendenza all’ipokaliemia, che talvolta può presentarsi anche in assenza di terapia diuretica, a causa dell’esaltato riassorbimento tubulare distale di sodio che si associa invariabilmente ad aumentata escrezione di potassio.
Sintesi fisiopatologica dell’obesità nell’adulto e delle complicanze cardio-metaboliche correlate e associate ad aumentata pressione arteriosa
La forma più frequente di obesità è quella definibile come “alimentare-poligenica” (43) dove, ad una predisposizione genetica si somma la componente ambientale e socio-familiare. L’accumulo di tessuto adiposo risulta sempre causato da un bilancio energetico positivo tra “entrate” (calorie introdotte con cibi e bevande) e “uscite” (consumo energetico per metabolismo e attività fisica). Il tessuto adiposo in tale contesto agisce anche come organo endocrino poiché in grado di secernere ormoni e adipochine (quali leptina e adiponectina) come pure proteine e peptidi del SRAA e sequestrare i peptidi natriuretici cardiaci degradandoli (10). Da non sottovalutare è anche la localizzazione del tessuto adiposo. Gli individui con depositi principalmente sottocutanei hanno in genere adipociti più piccoli e ridotte alterazioni metaboliche sistemiche. Alcuni individui hanno infatti elevata capacità di immagazzinare l’eccesso di calorie sotto forma di trigliceridi nell’adipe sottocutaneo, con minori conseguenze metaboliche, e sono spesso definiti obesi “metabolicamente sani”, anche se ciò è di fatto un ossimoro (44,45). Un recente studio ha infatti dimostrato come questi pazienti mostrino in realtà precoce danno cardiaco caratterizzato da aumentato tessuto interstiziale/fibrosi e alterazione della funzione diastolica. Ciò aumenta il rischio di scompenso cardiaco a frazione di eiezione preservata che è tipico del paziente obeso (46).
Il tessuto adiposo viscerale è inoltre un marcatore indipendente di morbilità e mortalità (47). Questo si presenta non solo a livello intra-addominale (mesenterico) ma anche a livello renale (retroperitoneale), del muscolo scheletrico e del muscolo cardiaco (mediastinico). È l’adipe che avvolge i vasi sanguigni e che circonda e infiltra vari organi e muscoli coinvolgendo anche collo e testa non solo l’addome. Gli adipociti localizzati a livello viscerale risultano spesso ipertrofici e probabilmente caratterizzati da una maggior insulino-resistenza. L’ipertrofia con aumento dell’insulino-resistenza e la sofferenza cellulare conducono alla morte di molti di questi adipociti, con richiamo di macrofagi, determinando l’instaurarsi di processi flogistici e fibrotici innescati dalla secrezione di citochine pro-infiammatorie, quali tumor necrosis factor-alfa (TNF-a) e interleuchina-6 (IL-6) (48), con successivo aumento della proteina C reattiva in circolo e quadro di infiammazione cronica di basso grado.
È particolarmente in voga attribuire peculiare importanza al grasso viscerale pericardiaco e perivascolare (49), anche se complessivamente è proprio l’intera quota di adipe viscerale, che caratteristicamente circonda e infiltra i vari organi, a risultare patologico, mentre è al momento praticamente impossibile attribuire un ruolo specifico ad un peculiare deposito viscerale piuttosto che ad un altro, anche per la presenza di dati contrastanti in letteratura. Ad esempio, un recente studio sul tessuto adiposo perivascolare ha mostrato un effetto vasodilatatorio mediato da ossilipine (50). A livello epatico, l’iperinsulinemia e l’insulino-resistenza contribuiscono alla produzione e all’accumulo di trigliceridi anche negli epatociti, determinando steatosi epatica, lipotossicità e steato-epatite non alcolica, caratterizzate comunque da molteplici meccanismi patogenetici (51). Questi quadri epatici sono conosciuti come “non-alcoholic fatty liver disease” (NAFLD) (15) e “non-alcoholic steato-hepatitis” (NASH) e rappresentano un’espressione di danno d’organo della sindrome metabolica che espone indipendentemente ad una maggiore mortalità anche per eventi cardiovascolari (52). Un recente “Consensus Statement” multi-societario la ridefinisce come “metabolic dysfunction-associated steatotic liver disease” (MASLD), associando tale condizione ad almeno uno dei cinque fattori di rischio cardio-metabolici (53). La crescente consapevolezza dell’interrelazione fisiopatologica tra fattori di rischio metabolici come obesità e DMT2, le malattie renali croniche e le malattie cardiovascolari ha portato alla concettualizzazione da parte dell’American Heart Association della sindrome cardiovascolare-nefro-metabolica. La malattia renale cronica (CKD) rappresenta un importante amplificatore del rischio cardiovascolare. I tratti distintivi della CKD, albuminuria e/o ridotta velocità di filtrazione glomerulare (GFR), sono associati a progressivo aumento del rischio di eventi vascolari aterosclerotici, scompenso cardiaco e morte cardiovascolare. Di conseguenza, le cause di morte più comuni negli individui affetti da DMT2 e CKD sono lo scompenso cardiaco e la malattia cardiovascolare aterosclerotica (ASCVD), e solo circa il 10% dei pazienti con CKD sopravvive fino all’insufficienza renale. La CKD provoca anche anemia e disturbi del metabolismo osseo e minerale che aggravano la patologia cardiovascolare. La minore capacità di trasporto dell’ossigeno aumenta la richiesta del miocardio e può peggiorare lo scompenso cardiaco (54).
L’insieme di questi fattori fisiopatologici e delle loro conseguenze cliniche sono alla base del maggior rischio da parte degli obesi di sviluppare problematiche cardiovascolari specie quando coesista un aumento della pressione arteriosa.
Obesità con pre-diabete o diabete mellito di tipo 2: come considerare già iperteso un paziente con la pressione alta-normale e come amplificare i danni da ipertensione arteriosa
Una delle principali complicanze legate all’eccesso di tessuto adiposo è un alterato metabolismo glucidico che in genere progredisce fino al DMT2 conclamato. Il paziente obeso ha un rischio aumentato di 6,7 volte di sviluppare intolleranza glucidica e di 4,9 volte di sviluppare DMT2, ma il rischio reale è probabilmente molto più elevato (55). Nonostante la forte predisposizione genetica poligenica al DMT2, predisposizione spesso associata alla facilità di sviluppare insulino-resistenza, circa il 70-80% dei pazienti non svilupperebbe mai un DMT2 in assenza di sovrappeso e obesità.
L’eccessivo introito calorico, specie in presenza di carente attività fisica, determina diminuzione della sensibilità all’insulina anche tramite la produzione di citochine pro-infiammatorie (TNF-a e IL-6) e riduzione della produzione di adiponectina, adipochina notoriamente ad azione “protettiva” antidiabetica, anti-aterogena e antinfiammatoria. L’eccesso di tessuto adiposo “infiammato” che contribuisce all’insulino-resistenza e al DMT2 rappresenta una “adiposopatia”, vale a dire una condizione di “adipe patologico” (56).
La complessità molecolare dei meccanismi post-recettoriali documentati alla base dell’insulino-resistenza, può essere globalmente “semplificata” e interpretata in modo più “logico” facendo riferimento al continuo eccessivo introito calorico in un contesto di insufficiente consumo, che conduce molti tessuti, tra cui soprattutto quello muscolare scheletrico infarcito di glicogeno e acidi grassi, a mettere in atto dei meccanismi che si oppongono all’entrata di ulteriore glucosio (la probabile vera “logica” cellulare nella genesi dell’insulino-resistenza), perché l’accumulo intracellulare di un eccesso di “combustibile” che non viene utilizzato può risultare nociva per le cellule stesse. Quindi l’insulino-resistenza può essere interpretata anche come un meccanismo di difesa cellulare dall’accumulo di zuccheri e grassi intracellulari.
Oltre ai meccanismi fisiopatologici, per l’instaurarsi della clinica e degli eventi cardiovascolari quello che conta è sempre e comunque il bilancio energetico. Infatti, nel noto studio clinico “Look Ahead”, i pazienti diabetici obesi nel lungo termine ottenevano solo una modica perdita media di peso con le modifiche intensive dello stile di vita, modico calo di peso che non è risultato sufficiente a ridurre l’incidenza di eventi cardiovascolari (end-point primario composito di ricovero per angina, infarto, ictus e morte cardiovascolare) (57). Un’analisi post-hoc dello stesso studio ha tuttavia dimostrato come nella minoranza dei casi in cui si perdeva oltre il 10% del proprio peso corporeo si raggiungesse una significativa riduzione dell’end-point primario (58), documentando come sia necessaria una consistente perdita dell’eccesso di energia immagazzinata negli adipociti sotto forma di trigliceridi per ottenere dei benefici cardiovascolari.
È ben noto, inoltre, come il DMT2 nel paziente sovrappeso/obeso sia preceduto da una fase di “pre-diabete”, che si manifesta in genere con una sindrome metabolica, durante la quale risultano accelerati danno vascolare, aterogenesi e complicanze dell’aterosclerosi, con un netto aumento di incidenza e prevalenza di eventi cardiovascolari in quanto spesso associata anche a pressione arteriosa alta-normale o ad ipertensione conclamata (59). Quindi una pressione arteriosa più elevata è una caratteristica quasi sempre presente nell’eccesso di peso associato a disglicemia. Il pre-diabete, o il DMT2, amplificano nettamente il danno al microcircolo (renale, retinico, cerebrale e cardiaco) che è noto essere alla base del danno cronico negli organi bersaglio dell’ipertensione arteriosa. Ecco perché anche una pressione alta-normale è considerabile già come fosse un’ipertensione arteriosa e può richiedere un intervento farmacologico in condizioni di alterato metabolismo glucidico.
Obesità con dislipidemia: una comune condizione che accompagna valori elevati di pressione arteriosa
In una cospicua percentuale di pazienti obesi, si riscontrano anche aumentati livelli di “remnants” delle VLDL, con aumentato colesterolo aterogeno totale in circolo, complessivamente noto come colesterolo non-HDL. Questo è spiegato sia dall’aumentata sintesi di VLDL che dal loro rallentato catabolismo negli obesi. Gli elevati livelli plasmatici di trigliceridi, tipici dei pazienti obesi, i bassi livelli circolanti di colesterolo HDL e l’aumento della concentrazione del numero di particelle LDL, in genere del tipo più aterogeno e cioè “piccole e dense”, caratterizzano la “triade” della comune dislipidemia aterogena associata al sovrappeso e all’obesità comunemente riscontrata anche nei pazienti ipertesi (60). Siccome gran parte del tessuto adiposo viscerale è drenato da vene confluenti nella vena porta, l’elevato turnover dei trigliceridi con iperlipolisi negli adipociti ipertrofici espone il fegato a maggiori concentrazioni di acidi grassi liberi e glicerolo. Ciò contribuisce ad una alterazione del metabolismo epatico, con aumento della produzione di VLDL ricche in trigliceridi e della produzione di glucosio/glicogeno a livello epatico con associata steatosi epatica. Questo meccanismo contribuisce al collegamento tra adiposità viscerale, steatosi epatica e intolleranza glucidica. Data la comune associazione con una pressione alta-normale o ipertensione arteriosa nel contesto disglicemia/dislipidemia, è ben comprensibile il milieu cronico che facilita il danno macro e microvascolare arterioso, con aumentata incidenza e prevalenza di eventi cardiovascolari in tale contesto dismetabolico chiaramente “adipocentrico”.
La Figura 2 riassume graficamente quanto finora esposto e le complicanze legate all’eccesso di adipe.
Effetti cardio-metabolici del calo ponderale che portano a riduzione della pressione arteriosa e a positive conseguenze cliniche
Il calo ponderale riduce l’insulino-resistenza, completamente reversibile nelle fasi iniziali, prevenendo anche la progressione verso il DMT2 o facendolo addirittura regredire qualora già presente, comportando anche una riduzione della pressione arteriosa sistolica di circa 1 mmHg per ogni kg di peso corporeo perso (61). Nei trial THOP I e II seguiti da follow-up a lungo termine, la riduzione di peso con la riduzione di pressione arteriosa comportavano una riduzione della mortalità (62). In questi studi clinici, individui di età compresa tra i 30 e i 54 anni con una pressione arteriosa elevata e normale sono stati randomizzati per calo ponderale, cure abituali o altri interventi per 18 mesi (TOHP I) o 3-4 anni (TOHP II), con un follow-up medio di 23 anni sulla mortalità, uno dei più grandi studi randomizzati per l’indagine degli effetti della riduzione di peso sui livelli di pressione arteriosa a lungo termine. Nel gruppo di riduzione del peso con un’intensa educazione, il peso perso dopo 6 mesi era di 4,4 kg, dopo 18 mesi di 2 kg e dopo 3 anni di soli 0,2 kg, sottolineando la difficoltà di mantenere i risultati positivi. Il 50% dei soggetti riprende il peso iniziale dopo un periodo medio di 3 anni e questo provoca un aumento della pressione arteriosa (63).
L’entità di tali riduzioni di pressione arteriosa sono rilevanti se si pensa come una riduzione anche di “soli” 2 mmHg di PAS nel medio-lungo termine si accompagni ad una riduzione del 10% della mortalità per ictus e del 7% della mortalità per cardiopatia ischemica (64). Le più recenti linee guida della Società Europea dell’Ipertensione Arteriosa (ESH) sottolineano infatti l’importanza del calo ponderale come fondamentale strategia terapeutica per ottenere una riduzione della pressione arteriosa (11). La perdita di peso nel paziente obeso migliora anche il grado di apnee ostruttive del sonno (OSA), che correlano con ipertensione resistente al trattamento e con aumentato rischio di ictus. Il calo ponderale inoltre determina diminuzione dei lipidi circolanti, soprattutto del colesterolo non-HDL e dei trigliceridi, con parallelo aumento del colesterolo HDL, soprattutto quando il calo ponderale si associa ad aumentata attività fisica. A livello renale ne deriva una riduzione dell’iperfiltrazione glomerulare, riduzione dell’albuminuria e rallentamento della perdita di funzionalità renale (65). Ne beneficiano anche la steatosi e i markers di danno epatico. In sintesi, una riduzione dell’eccesso di adipe soprattutto “mangiando meno e meglio” anche grazie a un moderno aiuto farmacologico ha quindi un netto beneficio metabolico e cardiovascolare come dimostrato dallo studio SELECT descritto di seguito.
La nuova concezione adipocentrica nell’approccio terapeutico farmacologico all’ipertensione arteriosa nel paziente obeso
Il paziente con sovrappeso viscerale o obesità affetto da ipertensione arteriosa è da anni oggetto di speciale interesse clinico in quanto spesso, per ottenere un adeguato controllo pressorio, necessita di una terapia antipertensiva in duplice o più spesso triplice associazione, che garantisca un’adeguata copertura delle 24 ore e che contenga un diuretico oltre a un antagonista del SRAA (11,66). Tali associazioni vedono come farmaci di prima scelta gli ACE-inibitori o i sartani, preferibilmente a dosaggio “massimale”, ovvero generalmente quello somministrato negli studi clinici di outcome cardiovascolare o renale (67). Ad esempio, nello studio DROP (68) condotto su obesi ipertesi con DMT2 e microalbuminuria, i dosaggi di valsartan più efficaci per il controllo pressorio e per la riduzione della microalbuminuria erano pari a ben 640 mg al giorno, ovvero il doppio del dosaggio massimo commercializzato in Italia. Nello studio VAL-HEFT, in cui sono stati arruolati molti pazienti obesi ipertesi, il valsartan veniva utilizzato nello scompenso cardiaco con ridotta frazione di eiezione al dosaggio di 160 mg due volte al giorno nonostante la pressione arteriosa fosse “bassa-normale” data la tipologia di scompenso (69–71). L’irbesartan ha ottenuto ottimi risultati dosaggio-dipendenti in termini di nefroprotezione in pazienti diabetici con microalbuminuria che erano in genere ipertesi. Lo studio IRMA-2 condotto su 590 pazienti ipertesi con DMT2 ha dimostrato come irbesartan prevenga e rallenti la progressione alla nefropatia conclamata. L’end-point primario era rappresentato dal tempo di insorgenza della nefropatia diabetica, definita da albuminuria persistente in campioni notturni, con un tasso di escrezione urinaria di albumina superiore a 200 µg al minuto e superiore di almeno il 30% rispetto al livello di base. Dieci dei 194 pazienti del gruppo “irbesartan 300mg” (5,2%) e 19 dei 195 pazienti del gruppo “irbesartan 150 mg” (9,7%) hanno raggiunto l’end-point primario, rispetto a 30 dei 201 pazienti del gruppo placebo (14,9%) (72). Lo studio IDNT, condotto su 1715 ipertesi in sovrappeso od obesi con DMT2, proteinuria e nefropatia in stadio avanzato, ha dimostrato come irbesartan al dosaggio di 300 mg al giorno, paragonato ad amlodipina e altri trattamenti, proteggesse maggiormente dal rischio di incremento dei valori di creatininemia fino all’insufficienza renale terminale o di morte (73). Riguardo gli ACE-inibitori, nello studio REIN in pazienti nefropatici cronici, ma non diabetici, è stato dimostrato come l’effetto protettivo renale del ramipril fosse significativo solo nei soggetti obesi, sia per la progressione del danno renale sia per la proteinuria, mentre tale effetto era praticamente assente nelle persone con BMI normale (74). Negli obesi risulta spesso necessaria l’associazione con diuretici tiazidici o tiazidico-simili, utilizzabili fino a valori di filtrato glomerulare stimato (eGFR) di circa 30 ml/min/1,73m2, o diuretici dell’ansa (furosemide o torasemide, quest’ultima da preferire per la più lunga emivita e per il miglior profilo di biodisponibilità) per valori di eGFR<30 ml/min/1,73m2. Se da un lato il diuretico serve a eliminare l’eccesso di sale introdotto con l’alimentazione dagli obesi, dall’altro lato il sartano o ACE-inibitore serve a moderare la conseguente stimolazione del SRAA dovuta all’utilizzo del diuretico (66). Infatti, nella maggior parte degli obesi, l’associazione con un diuretico è indispensabile per ottenere un adeguato controllo dei valori pressori nelle 24 ore, proprio a causa dell’elevato introito sodico che caratterizza la dieta di questi pazienti, introito elevato spesso misconosciuto sia dai clinici che dai pazienti stessi. I pazienti obesi sono anche quelli in cui spesso nemmeno una duplice terapia di associazione diuretico-antagonista SRAA permette di raggiungere un ottimale controllo pressorio, per cui spesso vengono associati anche i calcio-antagonisti diidropiridinici. Va ricordato come l’amlodipina blocchi principalmente i canali del calcio di “tipo L”, presenti soprattutto sull’arteriola afferente glomerulare e che quindi potrebbe favorire l’iperfiltrazione glomerulare se usata, impropriamente quanto comunemente, in monoterapia nei pazienti obesi ipertesi. Il noto e frequente effetto collaterale conseguente all’utilizzo di amlodipina, rappresentato dall’insorgenza di edemi declivi generalmente perimalleolari, in caso di monoterapia in pazienti obesi, già di per sé gravati da possibili problematiche di stasi flebo-linfatica agli arti inferiori oltre alla tendenza alla ritenzione idrosalina, può facilmente comportare l’insorgenza di edemi anche “colonnari” fino alle ginocchia. L’azione vasodilatatoria diretta dell’amlodipina dovrebbe infatti essere sempre controbilanciata da un antagonista del SRAA, vale a dire un sartano o un ACE-inibitore, financo un antagonista dell’aldosterone, altrimenti, in alcuni pazienti, per l’efficace vasodilatazione arteriolare glomerulare afferente è possibile osservare anche un effetto “diuretico” da amlodipina con comparsa di nicturia, specie se il farmaco viene assunto la sera prima di coricarsi, con possibile riduzione dell’aderenza terapeutica. La lercanidipina, apparentemente agendo in modo più bilanciato sui canali del calcio sia di “tipo L” che di “tipo T” che sono più abbondanti a livello post glomerulare nell’arteriola efferente, eserciterebbe una dilatazione più equilibrata delle arteriole glomerulari afferente ed efferente, non favorendo quindi l’iperfiltrazione glomerulare dell’obeso, e può pertanto rappresentare una valida alternativa all’amlodipina dando anche minori edemi declivi a parità di riduzione pressoria tramite meccanismi analoghi (75–78).
Le più recenti linee guida promulgate dalla ESH confermano la necessità di un utilizzo estensivo di duplici o triplici combinazioni fisse contenenti un diuretico, per ottenere un adeguato controllo pressorio delle 24 ore nei pazienti obesi, e allo stesso tempo aumentare l’aderenza terapeutica (11), come ampiamente descritto in una nostra revisione sull’argomento, che tiene conto anche indispensabilmente delle differenti caratteristiche fenotipiche dei pazienti ipertesi (66). In Italia sono disponibili triplici associazioni precostituite che includono, oltre a un sartano (olmesartan o valsartan) o un ACE-inibitore (perindopril o ramipril), anche un diuretico (indapamide o idroclorotiazide) e un calcio-antagonista diidropiridinico (amlodipina), associazioni che aumentano nettamente l’aderenza alla terapia farmacologica e quindi il controllo pressorio delle 24 ore.
Da notare come nello studio ACCOMPLISH79,80, come del resto in moltissimi altri studi sul trattamento farmacologico dell’ipertensione arteriosa, circa il 50% dei pazienti avesse un BMI >30 kg/m2, mentre la quasi totalità del resto del campione fosse sovrappeso. È molto importante evidenziare come da una sotto-analisi di tale studio sia emerso che negli obesi l’associazione ACE inibitore/diuretico (benazepril- idroclorotiazide) si associasse a un miglior outcome combinato di morte cardiovascolare, infarto e ictus rispetto all’outcome globale dello studio, dove invece l’associazione ACE-inibitore e calcio-antagonista prevaleva (81). In un ulteriore studio, condotto con un’associazione fissa di ACE-inibitore/calcio-antagonista (perindopril-amlodipina) si osservava come i fattori principali che ostacolavano l’efficacia della terapia sul calo pressorio fossero proprio BMI e circonferenza vita, due noti indici di adiposità, diffusa e centrale rispettivamente (82). Appare quindi chiaro come molti studi clinici siano stati condotti proprio in pazienti con sovrappeso o obesità, con le inevitabili conseguenze “adipocentriche” come l’ipertensione arteriosa e che proprio in questi pazienti vi siano specifiche scelte terapeutiche da fare con specifici risultati ottenibili.
Un’altra classe farmacologica utilizzabile nel paziente obeso è quella rappresentata dai beta-bloccanti, in particolare i bloccanti selettivi (o super-selettivi) del recettore beta-1 adrenergico, come il bisoprololo e il nebivololo, da preferire al metoprololo tartrato (poiché meno selettivo e dotato di durata d’azione di circa 8 ore, per cui si dovrebbe assumere almeno tre volte al giorno), per mantenere la frequenza cardiaca < 70 bpm, specie negli obesi sedentari. Questa classe farmacologica contribuisce anche a ridurre la secrezione di renina da stimolo (ad esempio in ortostatismo) adrenergico beta-1 sulle cellule renina-secernenti dell’arteriola glomerulare afferente, senza peraltro determinare mai ipotensione ortostatica, al contrario dell’alfa-1 antagonista adrenergico doxazosina, che non ha indicazioni specifiche in questi pazienti ed è un farmaco di quarta-quinta scelta, oppure dell’alfa-2 agonista centrale clonidina (disponibile anche in formulazione transdermica), che risulta addirittura controindicata negli obesi, in quanto causerebbe anche rallentamento psico-motorio favorendo ulteriore incremento ponderale. Eppure tali due farmaci sono inconcepibilmente tuttora prescritti in grande eccesso dai medici italiani. È importante ricordare come nell’obeso iperteso sia spesso necessario ricorrere all’utilizzo di antagonisti del recettore dei mineralcorticoidi (MRA), anche a basse dosi (canrenone 12,5-25 mg) per ottenere un completo controllo dei valori pressori nelle 24 ore. Ciò è dovuto alla persistente quanto inappropriata secrezione di aldosterone che caratterizza l’obeso iperteso, nonostante l’utilizzo di ACE-inibitori o sartani, specie se sottodosati (come ad esempio ramipril a soli 2,5/5 mg al giorno). Nei pazienti obesi, ricordiamo infatti il fenomeno dell’escape della secrezione di aldosterone dall’inibizione esercitata da ACE-inibitori e antagonisti dell’angiotensina II (27,28).
In associazione alle classi di farmaci anti-ipertensivi raccomandati, gli SGLT2-i (gliflozine) rappresentano una nuova opportunità per il paziente iperteso specie se affetto da scompenso cardiaco, indipendentemente dalla frazione di eiezione, e da CKD, a prescindere dalla presenza o meno di DMT2. Le gliflozine hanno il loro sito di azione nel tubulo prossimale renale e, per il fatto che inibiscono sia il riassorbimento di glucosio che di sodio, abbiamo proposto il termine di diuretici “ibridi” o “doppi” anche perché, al contrario delle altre classi di diuretici disponibili, non stimolano, ma anzi inibiscono, il SRAA. Agendo a livello del tubulo contorto prossimale del nefrone, favoriscono la natriuresi e la glicosuria, con una ulteriore componente di diuresi osmotica (83) (Figura 3). Infatti, nella fase iniziale “acuta” di terapia, la riduzione di volume e pressione è tale che può prevalere uno stimolo temporaneo sull’attività del SRAA (84), la cui secrezione e attività sono regolate a multipli livelli, includendo il sistema nervoso autonomo attivato dai recettori di volume e pressione. L’inibizione del co-trasportatore SGLT2 conduce a minore riassorbimento di glucosio e cloruro di sodio a livello prossimale. Il “sensore” della macula densa, ovvero il co-trasportatore Na-K-2Cl analogo a quello presente nella parte terminale ascendente “spessa” dell’ansa di Henle di cui la macula densa è la diretta continuità, percepisce un maggior quantitativo di sodio (ma soprattutto di cloro), interpretandolo come un’iperfiltrazione glomerulare, o comunque come un’abbondanza in introito alimentare e contenuto corporeo totale di sale. Ne consegue un maggior rilascio paracrino dei nucleotidi ATP/ADP che rapidamente vengono enzimaticamente convertiti nel nucleoside adenosina a livello interstiziale del polo vascolare del glomerulo dello stesso nefrone, con conseguente stimolo dei recettori di tipo 1 dell’adenosina e successiva vasocostrizione dell’arteriola afferente assieme a una inibizione del rilascio di renina. Questo comporta protezione dall’iperfiltrazione ma anche una minore produzione locale di angiotensina I dal lume dell’arteriola afferente in poi, con conseguente minori concentrazioni a livello dell’arteriola efferente di angiotensina II, che viene rapidamente prodotta dal locale ACE presente in tutto l’endotelio glomerulare. Ne risulta pertanto, oltre che una riduzione in cronico dell’attività sistemica del SRAA anche una minore vasocostrizione dell’arteriola efferente. Il termine diuretico “ibrido” da noi coniato è correlabile proprio alla capacità di questi farmaci di vasocostringere l’arteriola afferente e ridurre l’attività del SRAA “intra-renale” mimando quindi l’azione di un ACE-inibitore, ma senza avere gli effetti di stimolo sulla secrezione di renina, comportandosi quindi anche in modo opposto ai diuretici dell’ansa, che inibiscono anche il “sensore” della macula densa, o di quelli tiazidici che agiscono sul tubulo contorto distale, i quali appunto stimolano l’attività del SRAA (83).
È proprio questa caratteristica degli SGLT2-i che determina la loro efficacia nel ridurre la pressione arteriosa sia a livello sistemico che a livello glomerulare, limitando lo stimolo secretivo reninico a livello del nefrone e di conseguenza la stimolazione dei recettori AT1 dell’angiotensina II sull’arteriola efferente, stimolazione che non viene mai completamente inibita nemmeno con l’utilizzo di sartani o ACE- inibitori. Infatti, tali classi di farmaci non riescono mai a contrastare completamente l’azione locale intra-renale concentrazione-dipendente dell’angiotensina II, che può essere prodotta a partire dall’angiotensina I anche per vie alternative all’ACE. Inoltre, sia sartani che ACE inibitori aumentano i livelli di renina dall’arteriola afferente in giù, ostacolando l’inibizione della sua secrezione tramite il feedback negativo angiotensina II-dipendente. Inoltre, nei pazienti obesi l’escape dagli effetti di ACE-inibitori o sartani sul controllo della secrezione di aldosterone si ha probabilmente anche per la contemporanea esaltata attività reninica (27).
Gli SGLT2-i aumentano transitoriamente l’attività della renina plasmatica in modo acuto attraverso la diuresi osmotica e la maggiore eliminazione di sodio. Nei pazienti con DMT2 è infatti stato osservato un aumento dell’escrezione urinaria di sodio durante la fase iniziale del trattamento con canagliflozin ed empagliflozin. Il SGLT2 e lo scambiatore idrogeno-sodio 3 (NHE3) sono entrambi co-localizzati nel tubulo prossimale del rene e sono up-regolati in risposta all’iperglicemia cronica. Entrambi i trasportatori sono collegati dalla multi-proteina associata alla membrana 17 (MAP17). L’inibizione indiretta di NHE3 attraverso l’interruzione del complesso MAP17 è probabilmente un modo importante per ottenere una maggiore natriuresi con l’inibizione di SGLT2. Nel complesso, i dati sperimentali suggeriscono che NHE3 è un importante determinante della natriuresi mediata dagli SGLT2-i. Di conseguenza, tali farmaci riducono il contenuto totale di sodio corporeo e il sovraccarico di volume (85,86). Gli effetti antipertensivi riscontrati nello studio EMPA-REG OUTCOME e nel programma CANVAS sono probabilmente dovuti alla natriuresi indotta dagli SGLT2-i. In particolare, è stato dimostrato come dapagliflozin riduca il volume plasmatico in modo simile ai diuretici tiazidici, ma con un effetto diuretico più duraturo rispetto ad altri diuretici. La riduzione “acuta” del volume plasmatico è accompagnata da un aumento dell’ematocrito, che è stato osservato nei pazienti trattati con SGLT2-i. Allo stesso modo, i pazienti trattati con empagliflozin hanno mostrato un ematocrito superiore di circa il 5% rispetto ai pazienti trattati con placebo. Modelli matematici hanno indicato che gli SGLT2-i possono determinare soprattutto una clearance del fluido interstiziale con minori modifiche del volume intravascolare mediante diuresi osmotica. Nell’ultimo decennio, l’accumulo di sodio nei tessuti ha ricevuto una crescente attenzione come marcatore di stati di espansione del volume. Le concentrazioni di sodio cutanee e muscolari sono positivamente correlate al rischio di malattie cardiovascolari e alla pressione arteriosa nella malattia renale cronica. È interessante notare come il trattamento cronico con dapagliflozin riduca significativamente le concentrazioni di sodio cutanee nei pazienti con DMT2. Questi dati supportano l’ipotesi che gli SGLT2-i diminuiscano la concentrazione di sodio nel fluido interstiziale e quindi riducano il rischio di malattie cardiovascolari. Studi clinici hanno dimostrato come canagliflozin aumenti il volume delle urine nei pazienti con DMT2 durante i primi giorni di trattamento. In pazienti giapponesi con DMT2, empagliflozin aumentava inizialmente il volume delle urine. Osservazioni simili sono state riscontrate anche in pazienti affetti da DMT2 trattati con dapagliflozin. Nel complesso, i dati indicano costantemente come il trattamento con SGLT2-i determini una natriuresi associata a glicosuria. Tuttavia, gli effetti diuretici più evidenti sembrano essere transitori in base ai dati disponibili nei pazienti con DMT2 (84).
Tuttavia, la durata della natriuresi e della riduzione del volume rimane un’area controversa, poiché ci sono poche prove a lungo termine che la natriuresi persista dopo le prime settimane di trattamento, probabilmente a causa di un aumento compensatorio del riassorbimento di sodio nel nefrone distale. Inoltre, l’obesità severa può associarsi a stimolazione della secrezione di aldosterone attraverso vari meccanismi, portando a livelli inappropriatamente normali o alti nei pazienti obesi con ipertensione essenziale, nonostante il trattamento e la dieta ricca di sale (28). Questa azione farmacologica degli SGLT2-i è simile all’azione dei peptidi natriuretici sull’assorbimento di sodio a livello del tubulo prossimale, di cui appunto ne simulano i benefici fisiopatologici inclusa la capacità di inibire direttamente il SRAA agendo a vari livelli. A seguito dell’inibizione del co-trasportatore SGLT2 si hanno quindi notevoli benefici in termini di cardio e nefro-protezione, benefici che hanno determinato una vera rivoluzione nella gestione delle malattie cardiovascolari e renali, a prescindere dal diabete mellito (87,88). Per quanto siano stati ipotizzati dozzine di diversi meccanismi per l’azione benefica degli SGLT2-i sulla base di studi in vitro o sperimentali, rimane molto solida la fisiopatologia basata sull’asse sodio/volume/pressione arteriosa con i benefici clinici confermati da decenni di studi. In aggiunta, questa classe di farmaci permette all’organismo di perdere circa 70 grammi di glucosio al giorno (280 kcal), facilitando così il calo ponderale nel paziente sovrappeso/obeso. I maggiori rappresentanti di questa classe, di cui riporteremo i dati sulla pressione arteriosa, sono empagliflozin, dapagliflozin, canagliflozin, sotagliflozin ed ertugliflozin.
Il dapagliflozin ha dimostrato di facilitare un calo ponderale medio fino a un massimo del 6,4% e di ridurre la pressione arteriosa, dimostrando un ruolo significativo in termini di protezione cardiovascolare, con associata riduzione delle ospedalizzazioni per scompenso cardiaco, in pazienti con scompenso a frazione di eiezione ridotta (studio DAPA-HF) (89). Nello studio DELIVER sono stati evidenziati benefici significativi anche nei pazienti con scompenso cardiaco a frazione di eiezione preservata dimostrando l’unicità dei risultati ottenuti da questa classe di farmaci (90). Dapagliflozin inoltre riduce il decadimento negli anni della funzionalità renale fino al 28% in pazienti diabetici con nefropatia diabetica. L’età media dei pazienti arruolati nello studio era di 72 ± 10 anni e il 44% erano di sesso femminile. Valori di PAS <120 mmHg erano associati a maggiori eventi di scompenso cardiaco e mortalità (molto probabilmente non come causa-effetto), mentre il rischio di amputazione e ictus aumentava con una PAS più elevata. Dapagliflozin ha ridotto la PAS di 1,8 (95% CI: 1,1- 2,5) mmHg rispetto al placebo a 1 mese (91). Nello studio DAPA-CKD si è dimostrato come l’utilizzo di dapagliflozin in pazienti con malattia renale cronica indipendentemente dalla presenza di DMT2, riducesse significativamente il rischio di declino della velocità di filtrazione glomerulare del 50% rispetto al placebo, riducendo il rischio di progressione del danno renale e di morte per cause renali o per cause cardiovascolari (92).
Lo studio DIAMOND ha valutato gli effetti di dapagliflozin nella CKD proteinurica non diabetica per 6 settimane e ha mostrato una riduzione della pressione arteriosa sistolica e diastolica di 3,6/-1,4 mmHg. Nello studio DAPA-CKD, dapagliflozin ha ridotto la pressione arteriosa nei pazienti con nefropatia IgA di 3,5/-2,2mmHg in 2,1 anni. L’effetto è apparso meno pronunciato nei pazienti con glomerulosclerosi focale segmentale (FSGS) (93).
L’empagliflozin, nello studio EMPEROR REDUCED (94), ha dimostrato un minor rischio di morte cardiovascolare o ospedalizzazione per scompenso cardiaco, indipendentemente dalla presenza o meno di DMT2. Inoltre, il tasso di riduzione del filtrato glomerulare era inferiore nei pazienti che assumevano empagliflozin, indipendentemente dal grado di severità della malattia renale cronica di partenza (misurato come eGFR o come albuminuria) studiando pazienti con un filtrato stimato fino a 20 ml/min/1,73m2.
Lo studio EMPEROR PRESERVED ha dimostrato una riduzione del rischio combinato di morte cardiovascolare o ospedalizzazione per scompenso cardiaco in pazienti con scompenso cardiaco a frazione di eiezione preservata, indipendentemente dalla presenza o meno di DMT2, confermando l’effetto di classe degli SGLT2-i nel modificare significativamente il management dello scompenso cardiaco a frazione di eiezione preservata (95). Molti pazienti con HFpEF sono risultati ipertesi e si è assistito ad una riduzione della pressione arteriosa sistolica nel gruppo trattato con empagliflozin. Inoltre, è emerso come i pazienti con PAS > 130 mmHg avessero un tasso di incidenza di scompenso cardiaco aumentato di 8,58 rispetto ad un tasso di incidenza di 8,26 presente nei pazienti con PAS di 110-130 mmHg.
Nello studio EMPA-REG OUTCOME si riscontravano i seguenti risultati significativi: riduzione della mortalità cardiovascolare, riduzione della mortalità per tutte le cause, riduzione dell’ospedalizzazione per scompenso cardiaco e riduzione del rischio cardiovascolare, nei pazienti trattati con empagliflozin in associazione allo standard di terapia, indipendentemente dalla presenza o meno di scompenso cardiaco, e indipendentemente dalla frazione di eiezione (96). In questo studio su 4.687 pazienti trattati con empagliflozin e 2.333 pazienti trattati con placebo per 3 anni di follow up, partendo da livelli di pressione arteriosa medi di 135/76 mmHg si è assistito ad una riduzione media di 4 mmHg nei pazienti trattati con empagliflozin (97).
Lo studio EMPA-TROPISM ha dimostrato come empagliflozin riduca l’adiposità, specialmente quella viscerale, la fibrosi interstiziale miocardica, in particolare quella perivascolare, la rigidità aortica ed i livelli circolanti di markers infiammatori in pazienti non diabetici con scompenso cardiaco a frazione di eiezione ridotta (98).
Nello studio EMPA- KIDNEY si sono evidenziati minor progressione del danno renale cronico e minori ospedalizzazioni con empagliflozin, confermando l’efficacia di classe degli inibitori di SGLT2 nella protezione dal danno renale cronico. In questo studio su 3.304 pazienti i valori medi di pressione arteriosa dei partecipanti al baseline erano di 136/78 mmHg e si verificò una riduzione media di 2,6 mmHg per la PAS e 0,5 mmHg per la pressione diastolica (PAD) (99).
Il canagliflozin nello studio CANVAS, condotto su pazienti con DMT2 e malattie cardiovascolari o elevato rischio cardiovascolare, ha evidenziato una riduzione degli eventi cardiovascolari rispetto al placebo, ma un maggior rischio di amputazione a livello metatarsale o a livello delle dita dei piedi (100). Successivamente, si è chiarito come tale rischio fosse aumentato solo in soggetti con determinate caratteristiche associate, quali precedenti anamnestici per amputazione, malattie vascolari periferiche e neuropatia (101). In termini di riduzione della pressione arteriosa si assisteva ad una netta riduzione sia della PAS (− 3,93 mmHg) che della PAD (− 1,39 mmHg) (102).
Lo studio CREDENCE ha invece arruolato pazienti diabetici con malattia renale cronica (eGFR tra 30 e 90 ml/min/1,73m2 e albuminuria), dimostrando una riduzione degli eventi renali e cardiovascolari con l’utilizzo di canagliflozin. Nei pazienti con DMT2 e CKD dello studio CREDENCE, circa tre quarti dei pazienti avevano una PAS >130 mmHg al basale, e un quinto dei pazienti riceveva più di quattro principi attivi per la riduzione della pressione arteriosa: si tratta quindi di uno degli studi sugli inibitori SGLT2 con il più alto carico di ipertensione. In questo studio, canagliflozin ha ridotto la pressione arteriosa di 3,5/1,0 mmHg, con effetti costanti indipendentemente dalla funzione renale, dalla pressione arteriosa al basale e dal numero di farmaci per la riduzione della pressione arteriosa. I partecipanti randomizzati a canagliflozin avevano il 45% di probabilità in più di registrare una riduzione della pressione arteriosa sistolica superiore a 5 mmHg entro la terza settimana. Canagliflozin ha anche ridotto l’assunzione di nuovi farmaci per la riduzione della pressione arteriosa nel corso del tempo (cioè i nuovi farmaci per la pressione arteriosa sono stati assunti più frequentemente nel braccio placebo), sollevando la possibilità che il vero effetto di riduzione della pressione arteriosa possa essere ancora maggiore di 3,5 mmHg (103). Un’analisi secondaria del lavoro ha dimostrato come i pazienti trattati con 100 mg di canagliflozin e con filtrato renale stimato compreso tra 45 e 60 ml/min/1,73m2 avessero avuto i maggiori benefici in termini di outcome renale (104). L’utilizzo di canagliflozin ha determinato un calo inziale dei valori di filtrato glomerulare stimato, con una successiva stabilizzazione, come era da attendersi sulla base del meccanismo di azione principale di questa classe di farmaci (103). Infatti, è stata riscontrata anche una significativa riduzione della pressione arteriosa sistolica, riducendo la necessità di ulteriori farmaci antipertensivi, dimostrando come gli inibitori di SGLT2 possiedano molteplici meccanismi organo-protettivi (104). In conclusione, le gliflozine hanno dimostrato complessivamente effetti metabolici, cardiovascolari e renali molto positivi incentrati sull’eliminazione di più sodio, glucosio e acqua per via urinaria senza attivazione del SRAA. Sicuramente hanno già un ruolo sia primario che integrativo nella terapia in molti pazienti obesi ipertesi sia con DMT2 sia senza e con scompenso cardiaco e/o nefropatia cronica. Una rimodulazione di altri farmaci per il trattamento dell’ipertensione e delle comorbidità associate è pertanto spesso necessario usando gli inibitori di SGLT2. Per limitare alcuni effetti collaterali prevedibili, i pazienti devono essere adeguatamente istruiti a mantenere un’adeguata idratazione e un’accurata igiene genitale quotidiana.
Nuove terapie adipocentriche focalizzate sulla riduzione dell’eccesso di adipe con conseguente riduzione della pressione arteriosa
Come riportato anche dalle più recenti linee guida europee per la gestione dell’ipertensione arteriosa, nel paziente obeso iperteso, oltre alla necessaria terapia farmacologica antipertensiva, si dovrebbe ricorrere anche ad una terapia farmacologica che consenta di ottenere un significativo calo ponderale, poiché al calo ponderale seguirà inevitabilmente un calo pressorio, con agevolazione in termini di adeguato controllo pressorio delle 24 ore e possibilità di ridurre il carico della terapia antipertensiva (11).
Nella nostra rassegna, a tal proposito, presentiamo un approccio terapeutico, supportato da crescenti evidenze, fondato sull’integrazione precoce di terapie anti-ipertensive e terapie anti obesità mirate alla protezione cardiorenale e alla prevenzione degli eventi cardiovascolari.
Il GLP-1 è un ormone secreto a livello intestinale con effetti molteplici sull’organismo sebbene di breve emivita (105). L’azione principale più rilevante nella pratica clinica si esplica però a livello cerebrale. Questa molecola, infatti, raggiunge i neuroni ipotalamici degli organi circumventricolari, inclusi i neuroni del nucleo arcuato e del nucleo del tratto solitario. Grazie agli effetti inibitori centrali ipotalamici sull’appetito (106), il GLP-1 riduce la sensazione di fame stimolando sia il senso di ripienezza che quello di sazietà, agendo direttamente sui neuroni secernenti proopiomelanocortina (POMC) nel nucleo arcuato, aumentando la secrezione di melanocortina (MSH) e l’espressione del suo recettore MC4R a livello del nucleo paraventricolare (107) simulando quindi gli effetti della leptina (Figura 4).
Gli analoghi del GLP-1 (classificati come GLP-1 receptor agonists, GLP-1 RA) grazie al prolungamento dell’emivita e della durata di azione non solo hanno una persistente azione contrale ma esercitano inoltre effetti “ancillari”, quali un’azione diretta sulle cellule beta e alfa pancreatiche con facilitazione della secrezione di insulina e diminuzione della secrezione di glucagone, una ridotta motilità e svuotamento gastrico (anche per azione diretta sul nervo vago e sul plesso mioenterico) ed un aumento del metabolismo del tessuto muscolare scheletrico (105). Inducendo un minor introito di cibo e calorie, facilitano indirettamente anche la natriuresi per un miglioramento dell’efficacia del sistema dei peptidi natriuretici, grazie alla ridotta espressione del loro recettore di clearance (NPRC) che è insulino/glucosio-dipendente negli adipociti (35) e, nonostante l’obesità si associ a livelli inferiori di peptidi natriuretici circolanti per loro ipercatabolismo periferico, si osserva una riduzione dei livelli di NT-proBNP circolante conseguente a riduzione dello stress di parete ventricolare (108).
Le principali molecole con dimostrata efficacia clinica appartenenti alla classe degli agonisti del recettore del GLP-1 sono: liraglutide, dulaglutide, semaglutide (sottocute e orale) e la più recente tirzepatide che è in realtà un “dual agonist” (o twincretin) agendo anche come analogo del GIP (vedi sotto).
La liraglutide sebbene richieda iniezioni sottocutanee giornaliere, rappresenta il primo long-acting di dimostrata efficacia clinica all’interno di questa classe farmacologica, approvata per uso in mono- somministrazione quotidiana sottocutanea e con outcome favorevole negli studi clinici condotti. Lo studio LEADER, uno studio landmarking condotto su pazienti con DMT2, ha dimostrato infatti una minor mortalità per cause cardiovascolari, in particolare per infarto miocardico acuto (IMA) (109). Veniva inoltre dimostrata la riduzione del tessuto adiposo viscerale e del grasso ectopico (110) sebbene la riduzione del peso corporeo sia risultata contenuta (107). L’aumento progressivo della dose permette al paziente di ridurre gli effetti avversi transitori di tipo gastrointestinale, come dispepsia e nausea. Con la perdita di peso conseguente al ridotto introito calorico, si riduce l’insulino-resistenza e migliorano anche tutti gli altri fattori di rischio cardiovascolare di natura adipocentrica con riduzione della pressione arteriosa (111). Sono state riscontrate differenze medie significative tra gruppo liraglutide e gruppo placebo per quanto riguarda cambiamento dal basale a 36 mesi: la PAS era di 1,2 mmHg (95% CI, 1,9-0,5) più bassa nel gruppo liraglutide, mentre la PAD era più alta di 0,6 mmHg (95%CI, da 0,2 a 1,0) nel gruppo liraglutide (109,112). Purtroppo, non vi sono dati riguardo l’accuratezza di queste misurazioni pressorie.
La semaglutide in somministrazione sottocutanea ha il vantaggio di avere un’emivita maggiore, permettendo quindi di essere somministrata settimanalmente anziché quotidianamente. È sempre necessario iniziare con la dose più bassa, da aumentare gradualmente, al fine di ridurre i principali e transitori effetti collaterali gastrointestinali precedentemente citati. Lo studio di outcome cardiovascolare SUSTAIN 6 ha dimostrato, somministrando una dose massima di 1 mg, una riduzione del 26% del rischio globale di morte per cause cardiovascolari, IMA non fatale o stroke non fatale in pazienti con DMT2. Inoltre, veniva confermata una riduzione significativa del peso corporeo, anche una riduzione del 36% del rischio di insorgenza o aggravamento di nefropatia, con conseguente significativo beneficio metabolico e cardiovascolare (113). In questo studio venne osservata una riduzione media di PAS di 1,3 mmHg nei pazienti trattati con semaglutide al dosaggiodi 0,5 mg ed una riduzione pressoria di 2,6 mmHg nei pazienti che assumevano semaglutide al dosaggio di 1 mg. Va ricordato che in studi clinici su pazienti diabetici anche con lungo follow-up, come il LOOK AHEAD, non si otteneva un calo ponderale medio sufficiente e non veniva raggiunto l’obiettivo di riduzione di incidenza degli eventi cardiovascolari (end-point primario composito di ricovero per angina, infarto, ictus e morte cardiovascolare) (57). Al contrario, un’analisi post-hoc dimostrava che solo nella minoranza di pazienti che perdevano oltre il 10% del proprio peso corporeo si raggiungeva una significativa riduzione dell’end-point primario (58). Il recente studio SELECT ha invece reclutato 17604 pazienti ad alto rischio cardiovascolare con aterosclerosi (coronarica nell’82%) in sovrappeso od obesi (71%) non diabetici dimostrando come la semaglutide per via sottocutanea settimanale al dosaggio elevato di 2,4 mg, confrontato con il placebo, abbia ridotto il peso corporeo del 9,4% e, indipendentemente dal BMI di partenza, con un follow-up medio di circa 40 mesi abbia ridotto del 20% l’endpoint composto da morte cardiovascolare e infarto o ictus non fatale (114). In termini di riduzione della pressione arteriosa, si evidenziava come la PAS scendesse di ben 3,8 mmHg nel gruppo di pazienti trattati con semaglutide rispetto ai 0,5mmHg nel gruppo dei pazienti trattati con placebo (114).
La semaglutide ha inoltre la possibilità di poter anche essere somministrata per via orale una volta al giorno, grazie allo sviluppo di una particolare tecnologia che prevede la co-formulazione con un potenziatore dell’assorbimento: il salcaprozato di sodio [Sodio N-(8-(2-hydroxybenzil-Amino) caprylato] (SNAC), che determina a stomaco vuoto un “buffering” locale sulla mucosa gastrica, aumentando localmente il pH e riducendo l’efficacia degli enzimi che potrebbero degradare la semaglutide orale, facilitandone l’assorbimento. Lo SNAC permette anche un aumento della permeabilità della membrana gastrica e promuove la monomerizzazione della semaglutide. Questa formulazione è stata premiata nell’anno 2020 come “Outstanding Contribution in Human Health” dall’Agenzia Europea del Farmaco (EMA). La semaglutide orale esercita un discreto effetto sul calo ponderale, con una riduzione media di 2,3 kg per la posologia da 14 mg rispetto al placebo, e benefici sul controllo della glicemia. Nello studio PIONEER 6 (115) che aveva come obiettivo primario l’outcome cardiovascolare, è stata dimostrata la non inferiorità rispetto al placebo, ma non una sua superiorità, per cui è attualmente in corso un ulteriore studio (SOUL) su 9.642 soggetti che ha come end-point primario l’outcome cardiovascolare. Nello studio PIONEER 6 il peso corporeo si riduceva di 4,2 kg utilizzando semaglutide orale rispetto alla riduzione di 0,8 kg utilizzando il placebo. Studi real-life con la formulazione orale hanno mostrato come si assista già nelle prime settimane ad un miglioramento della composizione corporea con riduzione significativa della massa grassa, del VAT (tessuto adiposo viscerale). Contemporaneamente veniva preservata la massa magra e la massa muscolare, risultante in un benefico aumento del rapporto massa muscolare/tessuto adiposo viscerale (116). In una nota analisi post-hoc che ha analizzato i dati dello studio PIOONER 6 in pazienti con DMT2, si è evidenziato un effetto della semaglutide orale nella riduzione della pressione arteriosa. La semaglutide orale ha dimostrato di ridurre significativamente i valori di PAS di ben 12,5 mmHg ma non si è evidenziata invece una significativa riduzione in termini di PAD (117). Inoltre, nello studio condotto da Yanai et al. veniva dimostrata una riduzione significativa del peso corporeo di 1,2 kg dopo 3 mesi di trattamento con semagutide orale e di 2,4 kg dopo 6 mesi di trattamento. Si osservò inoltre una riduzione notevole della PAS di 6,2 mmHg dopo sei mesi di trattamento (118).
Sono stati identificati studi controllati randomizzati (RCT) che confrontavano semaglutide sottocutanea o orale con placebo o altri agenti anti-iperglicemici in pazienti con T2D.
In una recente review sistematica e metanalisi dove sono stati analizzati ventinove RCT con un totale di 26985 partecipanti, la variazione dalla PAS di semaglutide rispetto al placebo o ad altri farmaci è stata di -2,31 mmHg (95% CI: da -3,11 a -1,51), mentre quella della PAD è stata di 0,09 mmHg (95% CI: da -0,16 a 0,33). La riduzione della PAS è stata simile per la somministrazione sottocutanea e orale di semaglutide, con -2,36 mmHg con la formulazione sottocutanea e -2,50 con la formulazione orale. Dunque, nei pazienti diabetici, la PAS è diminuita significativamente nel gruppo semaglutide rispetto al placebo o sottoposti ad altri farmaci (119).
Un recente studio ha analizzato l’efficacia della semaglutide orale associata all’utilizzo di dapagliflozin. La terapia di combinazione ha dimostrato, oltre che una netta riduzione in termini di emoglobina glicata, anche una riduzione media della PAS di 5,1 mmHg e riduzione della PAD di 3,1 mmHg rispetto al gruppo trattato con il solo dapagliflozin (120).
La dulaglutide ha un’omologia di circa il 90% con il GLP-1 umano nativo, è resistente alla degradazione da parte dell’enzima dipeptidil peptidasi 4 (DPP-4) e le sue grandi dimensioni ne rallentano l’assorbimento e ne riducono la clearance a livello renale. Queste caratteristiche permettono di avere una formulazione solubile e un’emivita di 4,7 giorni, per cui viene generalmente somministrata sottocute una volta alla settimana. Lo studio a lungo termine sugli esiti cardiovascolari (REWIND) ha reclutato una popolazione di pazienti con DMT2 differente rispetto a quella dei precedenti studi di outcome cardiovascolare con analoghi del GLP-1. Infatti, solo il 31,5% dei partecipanti aveva una storia di patologia cardiovascolare nota al momento del reclutamento, con la maggioranza che presentava solo fattori di rischio cardiovascolari o danno vascolare subclinico ed era quindi in prevenzione primaria. I partecipanti assegnati al trattamento con dulaglutide mostravano nel follow-up livelli più bassi di HbA1c, peso corporeo, BMI, pressione arteriosa e colesterolo totale ed LDL. Nello specifico la terapia con dulaglutide utilizzato per 5,4 anni riduceva l’emoglobina glicata di 0,6%, il peso corporeo di 1,5 kg e la PAS di 1,7 mmHg (in pazienti con pressione basale media di 137 mmHg). Il trattamento con dulaglutide ha dimostrato per tutta la durata del follow-up un controllo glicemico migliore e più bassi livelli di alcuni fattori di rischio cardiovascolare rispetto al placebo. Si osservava un possibile maggior effetto sull’ictus rispetto all’infarto miocardico non fatale ed è stato confermato l’effetto nefroprotettivo. Gli eventi avversi riportati a livello gastrointestinale sono stati nausea, diarrea e vomito. Questi eventi erano generalmente di intensità lieve o moderata, mostravano un picco durante le prime 2 settimane di trattamento e diminuivano rapidamente nelle seguenti 4 settimane. Per quanto concerne l’effetto di dulaglutide sul calo ponderale, lo studio REWIND ha evidenziato però un calo del peso corporeo medio di soli 1,6 kg rispetto al gruppo placebo nei pazienti che assumevano dulaglutide alla dose di 1,5 mg (121).
La tirzepatide è una molecola innovativa che viene definita “twincretin” o meglio “doppio agonista”, poiché si lega sia al recettore del GLP-1 che a quello del “gastric inibitory polipeptide”, oggi noto soprattutto come “glucose-dependent insulinotropic polypeptide” (GIP), con maggiore affinità per quest’ultimo recettore, e la sua duplice azione provoca un effetto additivo, generando anche un aumento significativo della risposta insulinica alla glicemia. La tirzepatide viene somministrata sottocute una volta alla settimana, data la sua emivita di cinque giorni (122). Nello studio SURPASS 3 la pressione basale media dei partecipanti era di 131 mmHg e venne ridotta a 120 mmHg nei pazienti che erano riusciti ad ottenere una riduzione di peso maggiore del 15% (123). Negli studi SURMOUNT questa molecola ha dimostrato una importantissima azione in termini di riduzione dell’emoglobina glicata con un associato effetto sul calo ponderale. Inoltre, i fattori di rischio cardiometabolico misurati al basale nella popolazione dello studio, come la pressione sanguigna e i lipidi, erano relativamente normali, attenuando forse il potenziale di miglioramento, sebbene siano stati osservati cambiamenti significativi in queste variabili. Nello specifico, nello studio SURMOUNT 1 i pazienti che assumevano tirzepatide beneficiavano di una riduzione media della pressione arteriosa di 7,2 mmHg rispetto alla riduzione pressoria di 1 mmHg riscontrata nei pazienti appartenenti al gruppo placebo (124). Lo studio SURPASS-CVOT (125) di fase 3 randomizzato in doppio cieco ha il fine di valutare gli outcomes cardiovascolari di tirzepatide, valutando la non inferiorità e la superiorità di questo farmaco rispetto alla dulaglutide. I risultati di questo studio sono attesi per il prossimo anno. Le aspettative per questa nuova molecola sono molto alte e l’opinione scientifica mondiale parla già di un farmaco rivoluzionario dal punto di vista metabolico, soprattutto per l’efficacia nell’indurre la perdita di peso (122). Oltre ai farmaci sopra descritti, in futuro si avranno a disposizione nuove armi farmacologiche rappresentate dai nuovi analoghi del GLP1 in corso di studio come i promettenti survodutide a pemvirutide.
La survodutide ha attualmente in corso uno studio clinico di fase 2 in pazienti con sovrappeso/obesità e DMT2. Dati preliminari mostrano che, alla dose massima di 4,8 mg, questo farmaco può permettere una perdita di peso del 20% a 46 settimane. Allo stesso tempo tale farmaco è in corso di studio per il trattamento della NAFLD (126).
Pemvirutide non ha effetto sui livelli di glucosio ed attualmente è in studio per il trattamento dell’obesità e della NASH. Nello studio clinico di fase 2 MOMENTUM, a 24 settimane dall’inizio del trattamento si assisteva ad una perdita di peso del 10,7% grazie all’assunzione di pemvirutide 2,4 mg (dose maggiore). La PAS scendeva di 5,5 mmHg e la PAD di 1,8 mmHg nel gruppo di pazienti trattati con il dosaggio di 2,4 mg (127).
Altre opzioni farmacologiche per la riduzione del peso corporeo ma che possono indurre aumento dei valori pressori
L’associazione bupropione/naltrexone è costituita da un inibitore del reuptake della noradrenalina e della dopamina, utilizzato con efficacia per il trattamento della depressione e per la cessazione dell’abitudine tabagica (bupropione) (128) e un antagonista del recettore degli oppioidi (naltrexone) usato per trattare la dipendenza da alcol ed oppiacei. L’attività del sistema incentrato sulla POMC è potentemente stimolata dai livelli di dopamina e norepinefrina (129). La combinazione di entrambi i principi attivi determinerebbe da una parte una stimolazione dell’ipotalamo da parte della dopamina (i cui livelli sono incrementati dal meccanismo inibente del bupropione) a produrre più POMC, che tramite il suo derivato MSH e l’attivazione del recettore MC4R, riduce l’appetito e aumenta la sazietà, mentre dall’altra parte il naltrexone ridurrebbe gli effetti della beta-endorfina, sia bloccando i recettori mu degli oppioidi, che inibiscono la secrezione di POMC, sia diminuendo anche il desiderio della ricerca di cibo e il conseguente piacere nel consumarlo (129). Tale combinazione, approvata nel 2014 da EMA e FDA, trova indicazione in aggiunta a una dieta ipocalorica e all’attività fisica, per la gestione del peso in pazienti adulti con BMI iniziale maggiore o uguale a 30 kg/m², oppure per BMI compreso tra 27 e 29,9 kg/m² in presenza di almeno una comorbilità correlata al peso, quale prediabete o DMT2, qualora gli agonisti del recettore del GLP-1 non vengano tollerati, in quanto non ci sono dati certi in termini di sicurezza cardiovascolare: infatti il bupropione in particolare può aumentare la pressione arteriosa e la frequenza del battito cardiaco. Nello studio di fase 3 con bupropione/naltrexone si è osservato una minima variazione della pressione arteriosa rispetto al placebo e un aumento di 1 bpm della frequenza cardiaca, probabilmente a causa dell’aumento di norepinefrina determinata proprio dal bupropione. Dopo 56 settimane di trattamento, con la perdita di peso, i livelli di pressione arteriosa sembrerebbero ridursi rispetto al basale. Al dosaggio massimo determina una riduzione del 4-6% del peso corporeo in più rispetto al placebo (131). Tale combinazione è anche gravata da effetti collaterali comuni quali nausea, cefalea e costipazione (130). In conclusione, questa associazione non ha un’indicazione primaria nell’obeso iperteso o con pressione alta-normale, ma qualora vi sia un’efficace terapia antipertensiva di combinazione può essere presa in considerazione per gli altri vantaggi che offre la perdita di peso.
Conclusioni
L’obesità rappresenta spesso il fulcro dell’aumento dei valori di pressione arteriosa (dalla alta-normale all’ipertensione arteriosa conclamata) e delle varie problematiche cardio-metaboliche associate, confermando la visione “adipocentrica” di tali affezioni (132,133).
L’obiettivo della presente revisione concettuale è stressare un concetto semplice quanto basato su ampie evidenze: il sovrappeso-obesità viscerale svolge un ruolo cruciale nel determinare una vasta gamma di fattori di rischio cardiovascolare e nel predire la morbilità e mortalità cardiovascolare. Pertanto auspichiamo un salto di qualità nella gestione di tali affezioni, passando da una pratica che possiamo definire come “medicina delle conseguenze”, basata sul trattamento della singola condizione associata all’obesità che tuttavia viene attesa per poter essere gestita, ad una “medicina preventiva proattiva”, basata su un precoce intervento non-farmacologico sullo stile di vita, incentrato su una dieta ipocalorica e un’adeguata attività fisica, cui vada altrettanto precocemente affiancato un approccio farmacologico basato sulle nuove classi farmacologiche disponibili (GLP-1RA e SGLT2-i) che si sono dimostrate efficaci e sicure nel ridurre l’adiposità viscerale e di conseguenza tutti i fattori di rischio che vi orbitano attorno (134). L’approccio dietetico isolato, per quanto valido e indispensabile, tende spesso a fallire prima o poi nella maggior parte dei pazienti, mentre l’utilizzo in combinazione con un GLP-1RA consente di migliorare l’aderenza e la persistenza, e quindi l’efficacia a lungo termine, del regime dietetico. Una linea guida promossa da molteplici società scientifiche italiane, tra cui l’Associazione Medici Endocrinologi (AME) e la Società Italiana dell’Obesità (SIO), inserita tra le linee guida dell’Istituto Superiore di Sanità (ISS) 2023, è stata recentemente pubblicata e si rimanda ad essa per una sintesi esaustiva sul cambiamento dello stile di vita, sulla terapia dietetica, su quella chirurgica e su ulteriori approcci al sovrappeso e all’obesità resistenti al trattamento comportamentale nella popolazione adulta con comorbilità metaboliche (135). La necessità di ricorrere alle nuove terapie farmacologiche anti-obesità, in particolare per il trattamento dell’adiposità viscerale metabolicamente rilevante, è chiara ormai a tutti ed è pertanto auspicabile una rivisitazione delle norme sulla prescrivibilità e sulla durata dei brevetti delle nuove terapie basate sul potenziamento di messaggi ormonali endogeni, al fine di ottenere quanto prima dei “generici” a basso costo per estenderne l’utilizzo alla maggior parte dei pazienti affetti da sovrappeso-obesità con comorbilità cardio-metaboliche. Le spese per i farmaci sono comunque anche adesso probabilmente più convenienti dati i risparmi sanitari legati alla prevenzione cardiovascolare e alla riduzione dei costi della “medicina delle conseguenze” (136).
Un innovativo approccio “adipocentrico” al trattamento dell’ipertensione arteriosa prevede la scelta di una terapia polifarmacologica che miri al raggiungimento dei target pressori adeguati anche tramite la riduzione dell’eccesso di adipe viscerale. Tale approccio è espresso graficamente con una rivisitazione della storica figura di Irvine Page, nell’ottica adipocentrica della problematica cardio-metabolica, con possibili nuove combinazioni terapeutiche spendibili nel paziente obeso-iperteso.
I GLP-1RA e gli inibitori di SGLT2, facilitando le modifiche dello stile di vita e integrandosi in maniera sicura ed efficace con gli altri farmaci per la prevenzione cardiovascolare, incluse anche le necessarie terapie ipocolesterolemizzanti, possono rappresentare un contributo senza precedenti al miglioramento della salute di un’ampia porzione della popolazione.
Bibliografia
- Obesity and overweight. Accessed September 17, 2023. https://www.who.int/news-room/fact- sheets/detail/obesity-and-overweight
- Bentham J, Di Cesare M, Bilano V, et al. Worldwide trends in body-mass index, underweight, overweight, and obesity from 1975 to 2016: a pooled analysis of 2416 population-based measurement studies in 128·9 million children, adolescents, and adults. Lancet. 2017;390(10113):2627-2642. doi:10.1016/S0140-6736(17)32129-3
- Obesità: da amplificatore di rischio a malattia cronica. Accessed November 28, 2022. https://www.siprec.it/siprec-flipbook/DOCUMENTO-SIPREC-2022/
- Obesità – sovrappeso – Dati epidemiologici in Italia. Accessed September 17, 2023. https://www.epicentro.iss.it/obesita/epidemiologia-italia
- A A, MH F, MB R, et al. Health Effects of Overweight and Obesity in 195 Countries over 25 Years. N Engl J Med. 2017;377(1):13-27. doi:10.1056/NEJMOA1614362
- Sarzani R, Castellano M, Cuspidi C, et al. L’ipertensione arteriosa nel paziente obeso. Raccomandazioni congiunte 2014 della Società Italiana dell’Ipertensione Arteriosa (SIIA) e della Società Italiana dell’Obesità (SIO). Ipertensione e Prevenzione Cardiovascolare. 2014;21(2):50-96. doi:10.1713/1549.16891
- Zhou B, Carrillo-Larco RM, Danaei G, et al. Worldwide trends in hypertension prevalence and progress in treatment and control from 1990 to 2019: a pooled analysis of 1201 population- representative studies with 104 million participants. Lancet. 2021;398(10304):957-980. doi:10.1016/S0140-6736(21)01330-1
- Noncommunicable diseases: Risk factors. Accessed January 3, 2024. https://www.who.int/data/gho/data/themes/topics/topic-details/GHO/ncd-risk-factors
- Global report on hypertension: the race against a silent killer. Accessed January 3, 2024. https://www.who.int/publications/i/item/9789240081062
- Cypess AM. Reassessing Human Adipose Tissue. New England Journal of Medicine. 2022;386(8):768-779. doi:10.1056/NEJMRA2032804/SUPPL_FILE/ NEJMRA2032804_DISCLOSURES.PDF
- Mancia G, Kreutz R, Brunström M, et al. 2023 ESH Guidelines for the management of arterial hypertension The Task Force for the management of arterial hypertension of the European Society of Hypertension Endorsed by the European Renal Association (ERA) and the International Society of Hypertension (ISH). J Hypertens. Published online June 21, 2023. doi:10.1097/HJH.0000000000003480
- Yeghiazarians Y, Jneid H, Tietjens JR, et al. Obstructive Sleep Apnea and Cardiovascular Disease: A Scientific Statement From the American Heart Association. Circulation. 2021;144(3):E56-E67. doi:10.1161/CIR.0000000000000988
- Ahmed B, Sultana R, Greene MW. Adipose tissue and insulin resistance in obese. Biomed Pharmacother. 2021;137. doi:10.1016/J.BIOPHA.2021.111315
- Elsayed NA, Aleppo G, Aroda VR, et al. 8. Obesity and Weight Management for the Prevention and Treatment of Type 2 Diabetes: Standards of Care in Diabetes-2023. Diabetes Care. 2023;46(Suppl 1):S128-S139. doi:10.2337/DC23-S008
- Marchesini G, Day CP, Dufour JF, et al. EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. J Hepatol. 2016;64(6):1388-1402. doi:10.1016/J.JHEP.2015.11.004
- Powell-Wiley TM, Poirier P, Burke LE, et al. Obesity and Cardiovascular Disease: A Scientific Statement From the American Heart Association. Circulation. 2021;143(21):E984-E1010. doi:10.1161/CIR.0000000000000973
- Wormser D, Kaptoge S, Di Angelantonio E, et al. Separate and combined associations of body- mass index and abdominal adiposity with cardiovascular disease: collaborative analysis of 58 prospective studies. Lancet. 2011;377(9771):1085-1095. doi:10.1016/S0140-6736(11)60105- 0
- Alberti KGMM, Eckel RH, Grundy SM, et al. Harmonizing the metabolic syndrome: a joint interim statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Circulation. 2009;120(16):1640-1645. doi:10.1161/CIRCULATIONAHA.109.192644
- Galletti F, Agabiti-Rosei E, Bernini G, et al. Excess dietary sodium and inadequate potassium intake by hypertensive patients in Italy: results of the MINISAL-SIIA study program. J Hypertens. 2014;32(1):48-56. doi:10.1097/HJH.0000000000000010
- WHO and FAO. Diet, Nutrition, and the Prevention of Chronic Diseases (Report of a joint WHO and FAO Expert Consulation). WHO Technical Report Series. 2003;916:1-160. Accessed January 3, https://apps.who.int/iris/bitstream/handle/10665/42665/WHO_TRS_916.pdf?sequence=1
- Bell BB, Rahmouni K. Leptin as a Mediator of Obesity-Induced Hypertension. Curr Obes Rep. 2016;5(4):397-404. doi:10.1007/S13679-016-0231-X
- Grassi G, Dell’Oro R, Facchini A, Trevano FQ, Bolla GB, Mancia G. Effect of central and peripheral body fat distribution on sympathetic and baroreflex function in obese normotensives. J Hypertens. 2004;22(12):2363-2369. doi:10.1097/00004872-200412000- 00019
- Hall JE, Brands MW, Henegar JR. Mechanisms of hypertension and kidney disease in obesity. Ann N Y Acad Sci. 1999;892:91-107. doi:10.1111/J.1749-6632.1999.TB07788.X
- Borghi F, Sevá-Pessôa B, Grassi-Kassisse DM. The adipose tissue and the involvement of the renin-angiotensin-aldosterone system in cardiometabolic syndrome. Cell Tissue Res. 2016;366(3):543-548. doi:10.1007/S00441-016-2515-6
- Marcus Y, Shefer G, Stern N. Adipose tissue renin-angiotensin-aldosterone system (RAAS) and progression of insulin resistance. Mol Cell Endocrinol. 2013;378(1-2):1-14. doi:10.1016/J.MCE.2012.06.021
- Sarzani R, Salvi F, Dessì-Fulgheri P, Rappelli A. Renin-angiotensin system, natriuretic peptides, obesity, metabolic syndrome, and hypertension: an integrated view in humans. J Hypertens. 2008;26(5):831-843. doi:10.1097/HJH.0B013E3282F624A0
- Sarzani R, Guerra F, Mancinelli L, Buglioni A, Franchi E, Dess-Fulgheri P. Plasma aldosterone is increased in class 2 and 3 obese essential hypertensive patients despite drug treatment. Am J Hypertens. 2012;25(7):818-826. doi:10.1038/AJH.2012.47
- Spannella F, Giulietti F, Balietti P, et al. Plasma renin activity to plasma aldosterone concentration ratio correlates with night-time and pulse pressures in essential hypertensive patients treated with angiotensin-converting enzyme inhibitors/AT1 blockers. J Hypertens. 2017;35(11):2315-2322. doi:10.1097/HJH.0000000000001438
- Rossing P, Filippatos G, Agarwal R, et al. Finerenone in Predominantly Advanced CKD and Type 2 Diabetes With or Without Sodium-Glucose Cotransporter-2 Inhibitor Therapy. Kidney Int Rep. 2021;7(1):36-45. doi:10.1016/J.EKIR.2021.10.008
- Agarwal R, Filippatos G, Pitt B, et al. Cardiovascular and kidney outcomes with finerenone in patients with type 2 diabetes and chronic kidney disease: the FIDELITY pooled analysis. Eur Heart J. 2022;43(6):474-484A. doi:10.1093/EURHEARTJ/EHAB777
- Sarzani R, Spannella F, Giulietti F, Balietti P, Cocci G, Bordicchia M. Cardiac Natriuretic Peptides, Hypertension and Cardiovascular Risk. High Blood Press Cardiovasc Prev. 2017;24(2):115-126. doi:10.1007/S40292-017-0196-1
- Sarzani R, Allevi M, Di Pentima C, Schiavi P, Spannella F, Giulietti F. Role of Cardiac Natriuretic Peptides in Heart Structure and Function. Int J Mol Sci. 2022;23(22). doi:10.3390/IJMS232214415
- Wang TJ, Larson MG, Levy D, et al. Impact of obesity on plasma natriuretic peptide levels. Circulation. 2004;109(5):594-600. doi:10.1161/01.CIR.0000112582.16683.EA
- Dessì-Fulgheri P, Sarzani R, Tamburrini P, et al. Plasma atrial natriuretic peptide and natriuretic peptide receptor gene expression in adipose tissue of normotensive and hypertensive obese patients. J Hypertens. 1997;15(12):1695-1698. doi:10.1097/00004872-199715120- 00074
- Bordicchia M, Ceresiani M, Pavani M, et al. Insulin/glucose induces natriuretic peptide clearance receptor in human adipocytes: a metabolic link with the cardiac natriuretic pathway. Am J Physiol Regul Integr Comp Physiol. 2016;311(1):R104-R114. doi:10.1152/AJPREGU.00499.2015
- Bordicchia M, Liu D, Amri EZ, et al. Cardiac natriuretic peptides act via p38 MAPK to induce the brown fat thermogenic program in mouse and human adipocytes. J Clin Invest. 2012;122(3):1022-1036. doi:10.1172/JCI59701
- Dessì-Fulgheri P, Sarzani R, Serenelli M, et al. Low calorie diet enhances renal, hemodynamic, and humoral effects of exogenous atrial natriuretic peptide in obese hypertensives. Hypertension. 1999;33(2):658-662. doi:10.1161/01.HYP.33.2.658
- Sarzani R, Paci VM, Zingaretti CM, et al. Fasting inhibits natriuretic peptides clearance receptor expression in rat adipose tissue. J Hypertens. 1995;13(11):1241-1246. doi:10.1097/00004872-199511000-00004
- Dessi-Fulgheri P, Sarzani R, Rappelli A. The natriuretic peptide system in obesity-related hypertension: new pathophysiological aspects. J Nephrol. 1998;11(6):296-299. Accessed March 14, 2023. https://pubmed.ncbi.nlm.nih.gov/10048495/
- Boudin E, de Jong TR, Prickett TCR, et al. Bi-allelic Loss-of-Function Mutations in the NPR- C Receptor Result in Enhanced Growth and Connective Tissue Abnormalities. Am J Hum Genet. 2018;103(2):288-295. doi:10.1016/J.AJHG.2018.06.007
- Bayes-Genis A, Docherty KF, Petrie MC, et al. Practical algorithms for early diagnosis of heart failure and heart stress using NT-proBNP: A clinical consensus statement from the Heart Failure Association of the ESC. Eur J Heart Fail. 2023;25(11). doi:10.1002/EJHF.3036
- Frankenstein L, Remppis A, Nelles M, et al. Relation of N-terminal pro-brain natriuretic peptide levels and their prognostic power in chronic stable heart failure to obesity status. Eur Heart J. 2008;29(21):2634-2640. doi:10.1093/EURHEARTJ/EHN388
- Reddon H, Patel Y, Turcotte M, Pigeyre M, Meyre D. Revisiting the evolutionary origins of obesity: lazy versus peppy-thrifty genotype hypothesis. Obes Rev. 2018;19(11):1525-1543. doi:10.1111/OBR.12742
- Sun K, Kusminski CM, Scherer PE. Adipose tissue remodeling and obesity. J Clin Invest. 2011;121(6):2094-2101. doi:10.1172/JCI45887
- Zhou Z, Macpherson J, Gray SR, et al. Are people with metabolically healthy obesity really healthy? A prospective cohort study of 381,363 UK Biobank participants. Diabetologia. 2021;64(9):1963-1972. doi:10.1007/S00125-021-05484-6
- Zhao H, Huang R, Jiang M, et al. Myocardial Tissue-Level Characteristics of Adults With Metabolically Healthy Obesity. Cardiovascular Imaging. 2023;16(7):889-901. doi:10.1016/J.JCMG.2023.01.022
- Hiuge-Shimizu A, Kishida K, Funahashi T, et al. Absolute value of visceral fat area measured on computed tomography scans and obesity-related cardiovascular risk factors in large-scale Japanese general population (the VACATION-J study). Ann Med. 2012;44(1):82-92. doi:10.3109/07853890.2010.526138
- Neeland IJ, Poirier P, Després JP. Cardiovascular and Metabolic Heterogeneity of Obesity: Clinical Challenges and Implications for Management. Circulation. 2018;137(13):1391-1406. doi:10.1161/CIRCULATIONAHA.117.029617
- Agabiti-Rosei C, Saxton SN, De Ciuceis C, et al. Influence of Perivascular Adipose Tissue on Microcirculation: A Link Between Hypertension and Obesity. Hypertension. 2024;81(1):24-33. doi:10.1161/HYPERTENSIONAHA.123.19437
- Tsvetkov D, Schleifenbaum J, Wang Y, et al. KCNQ5 Controls Perivascular Adipose Tissue– Mediated Vasodilation. Hypertension. Published online December 28, 2023. doi:10.1161/HYPERTENSIONAHA.123.21834
- Browning JD, Horton JD. Molecular mediators of hepatic steatosis and liver injury. J Clin Invest. 2004;114(2):147-152. doi:10.1172/JCI22422
- Golabi P, Otgonsuren M, De Avila L, Sayiner M, Rafiq N, Younossi ZM. Components of metabolic syndrome increase the risk of mortality in nonalcoholic fatty liver disease (NAFLD). Medicine. 2018;97(13). doi:10.1097/MD.0000000000010214
- Rinella ME, Lazarus J V., Ratziu V, et al. A multi-society Delphi consensus statement on new fatty liver disease nomenclature. Ann Hepatol. Published online June 2023:101133. doi:10.1016/J.AOHEP.2023.101133
- Ndumele CE, Neeland IJ, Tuttle KR, et al. A Synopsis of the Evidence for the Science and Clinical Management of Cardiovascular-Kidney-Metabolic (CKM) Syndrome: A Scientific Statement From the American Heart Association. Circulation. 2023;148(20):1636-1664. doi:10.1161/CIR.0000000000001186
- Ruze R, Liu T, Zou X, et al. Obesity and type 2 diabetes mellitus: connections in epidemiology, pathogenesis, and treatments. Front Endocrinol (Lausanne). 2023;14. doi:10.3389/FENDO.2023.1161521
- Bays HE. Adiposopathy is “sick fat” a cardiovascular disease? J Am Coll Cardiol. 2011;57(25):2461-2473. doi:10.1016/J.JACC.2011.02.038
- RR W, P B, FL B, et al. Cardiovascular effects of intensive lifestyle intervention in type 2 diabetes. N Engl J Med. 2013;369(2):145-154. doi:10.1056/NEJMOA1212914
- EW G, JM J, G B, et al. Association of the magnitude of weight loss and changes in physical fitness with long-term cardiovascular disease outcomes in overweight or obese people with type 2 diabetes: a post-hoc analysis of the Look AHEAD randomised clinical trial. Lancet Diabetes Endocrinol. 2016;4(11):913-921. doi:10.1016/S2213-8587(16)30162-0
- Mechanick JI, Farkouh ME, Newman JD, Garvey WT. Cardiometabolic-Based Chronic Disease, Adiposity and Dysglycemia Drivers: JACC State-of-the-Art Review. J Am Coll Cardiol. 2020;75(5):525-538. doi:10.1016/J.JACC.2019.11.044
- Spannella F, Giulietti F, Di Pentima C, Sarzani R. Prevalence and Control of Dyslipidemia in Patients Referred for High Blood Pressure: The Disregarded “Double-Trouble” Lipid Profile in Overweight/Obese. Adv Ther. 2019;36(6):1426-1437. doi:10.1007/S12325-019-00941-6
- Neter JE, Stam BE, Kok FJ, Grobbee DE, Geleijnse JM. Influence of weight reduction on blood pressure: a meta-analysis of randomized controlled trials. Hypertension. 2003;42(5):878-884. doi:10.1161/01.HYP.0000094221.86888.AE
- Cook NR, Appel LJ, Whelton PK. Weight change and mortality: Long-term results from the trials of hypertension prevention. J Clin Hypertens (Greenwich). 2018;20(12):1666-1673. doi:10.1111/JCH.13418
- Dimitriadis K, Tsioufis C, Tousoulis D. Lowering weight equals reduction of mortality: How far are we from the “Ithaka” of ideal weight control? J Clin Hypertens (Greenwich). 2018;20(12):1674-1675. doi:10.1111/JCH.13414
- Lewington S, Clarke R, Qizilbash N, Peto R, Collins R. Age-specific relevance of usual blood pressure to vascular mortality: A meta-analysis of individual data for one million adults in 61 prospective studies. Lancet. 2002;360(9349):1903-1913. doi:10.1016/S0140-6736(02)11911- 8
- Chagnac A, Herman M, Zingerman B, et al. Obesity-induced glomerular hyperfiltration: its involvement in the pathogenesis of tubular sodium reabsorption. Nephrol Dial Transplant. 2008;23(12):3946-3952. doi:10.1093/NDT/GFN379
- Sarzani R, Laureti G, Gezzi A, Spannella F, Giulietti F. Single-pill fixed-dose drug combinations to reduce blood pressure: the right pill for the right patient. Ther Adv Chronic Dis. 2022;13. doi:10.1177/20406223221102754
- Sarzani R, Dessì-Fulgheri P, Rappelli A. Angiotensin receptor blockers: dose does matter. J Hypertens. 2008;26(3):607-608. doi:10.1097/HJH.0B013E3282F47675
- Hollenberg NK, Parving HH, Viberti G, et al. Albuminuria response to very high-dose valsartan in type 2 diabetes mellitus. J Hypertens. 2007;25(9):1921-1926. doi:10.1097/HJH.0B013E328277596E
- Carson P, Tognoni G, Cohn JN. Effect of valsartan on hospitalization: Results from Val-HeFT. J Card Fail. 2003;9(3):164-171. doi:10.1054/jcaf.2003.22
- Ay J, Ohn NC, Ianni G, et al. A Randomized Trial of the Angiotensin-Receptor Blocker Valsartan in Chronic Heart Failure. https://doi.org/101056/NEJMoa010713. 2001;345(23):1667-1675. doi:10.1056/NEJMOA010713
- Cohn JN, Tognoni G, Glazer R, Spormann D. Baseline demographics of the Valsartan Heart Failure Trial. Val-HeFT Investigators. Eur J Heart Fail. 2000;2(4):439-446. doi:10.1016/S1388-9842(00)00130-6
- Parving HH, Lehnert H, Bröchner-Mortensen J, Gomis R, Andersen S, Arner P. The effect of irbesartan on the development of diabetic nephropathy in patients with type 2 diabetes. N Engl J Med. 2001;345(12):870-878. doi:10.1056/NEJMOA011489
- Lewis EJ, Hunsicker LG, Clarke WR, et al. Renoprotective effect of the angiotensin-receptor antagonist irbesartan in patients with nephropathy due to type 2 diabetes. N Engl J Med. 2001;345(12):851-860. doi:10.1056/NEJMOA011303
- Mallamaci F, Ruggenenti P, Perna A, et al. ACE inhibition is renoprotective among obese patients with proteinuria. J Am Soc Nephrol. 2011;22(6):1122-1128. doi:10.1681/ASN.2010090969
- Sarzani R. Lercanidipina nel trattamento dell’ipertensione essenziale e nella prevenzione del danno d’organo. Focus su comuni pazienti a rischio. J Clin Med. 2023;25.
- Grassi G, Robles NR, Seravalle G, Fici F. Lercanidipine in the Management of Hypertension: An Update. J Pharmacol Pharmacother. 2017;8(4):155-165. doi:10.4103/JPP.JPP_34_17
- De Ciuceis C, Salvetti M, Paini A, et al. Comparison of lercanidipine plus hydrochlorothiazide vs. lercanidipine plus enalapril on micro and macrocirculation in patients with mild essential hypertension. Intern Emerg Med. 2017;12(7):963-974. doi:10.1007/S11739-017-1696-7
- Brixius K, Gross T, Tossios P, et al. Increased vascular selectivity and prolonged pharmacological efficacy of the L-type Ca2+ channel antagonist lercanidipine in human cardiovascular tissue. Clin Exp Pharmacol Physiol. 2005;32(9):708-713. doi:10.1111/J.1440- 1681.2005.04265.X
- Jamerson K, Weber MA, Bakris GL, et al. Benazepril plus amlodipine or hydrochlorothiazide for hypertension in high-risk patients. N Engl J Med. 2008;359(23):2417-2428. doi:10.1056/NEJMOA0806182
- Jamerson KA, Devereux R, Bakris GL, et al. Efficacy and duration of benazepril plus amlodipine or hydrochlorothiazide on 24-hour ambulatory systolic blood pressure control. Hypertension. 2011;57(2):174-179. doi:10.1161/HYPERTENSIONAHA.110.159939
- Weber MA, Jamerson K, Bakris GL, et al. Effects of body size and hypertension treatments on cardiovascular event rates: subanalysis of the ACCOMPLISH randomised controlled trial. Lancet. 2013;381(9866):537-545. doi:10.1016/S0140-6736(12)61343-9
- Zhang Y, Ly C, Yannoutsos A, et al. Effect of a fixed combination of Perindopril and Amlodipine on blood pressure control in 6256 patients with not-at-goal hypertension: the AVANT’AGE study. J Am Soc Hypertens. 2013;7(2):163-169. doi:10.1016/J.JASH.2013.01.006
- Sarzani R, Giulietti F, Di Pentima C, Spannella F. Sodium-glucose co-transporter-2 inhibitors: peculiar “hybrid” diuretics that protect from target organ damage and cardiovascular events. Nutr Metab Cardiovasc Dis. 2020;30(10):1622-1632. doi:10.1016/J.NUMECD.2020.05.030
- Ansary TM, Nakano D, Nishiyama A. Diuretic Effects of Sodium Glucose Cotransporter 2 Inhibitors and Their Influence on the Renin-Angiotensin System. Int J Mol Sci. 2019;20(3). doi:10.3390/IJMS20030629
- Wilcox CS. Antihypertensive and Renal Mechanisms of SGLT2 (Sodium-Glucose Linked Transporter 2) Inhibitors. Hypertension. 2020;75(4):894-901. doi:10.1161/HYPERTENSIONAHA.119.11684
- Beal B, Schutte AE, Neuen BL. Blood Pressure Effects of SGLT2 Inhibitors: Mechanisms and Clinical Evidence in Different Populations. Curr Hypertens Rep. 2023;25(12). doi:10.1007/S11906-023-01281-1
- Tonneijck L, Muskiet MHA, Smits MM, et al. Glomerular Hyperfiltration in Diabetes: Mechanisms, Clinical Significance, and Treatment. J Am Soc Nephrol. 2017;28(4):1023-1039. doi:10.1681/ASN.2016060666
- Melsom T, Schei J, Stefansson VTN, et al. Prediabetes and Risk of Glomerular Hyperfiltration and Albuminuria in the General Nondiabetic Population: A Prospective Cohort Study. Am J Kidney Dis. 2016;67(6):841-850. doi:10.1053/J.AJKD.2015.10.025
- Desai AS, Jhund PS, Claggett BL, et al. Effect of Dapagliflozin on Cause-Specific Mortality in Patients With Heart Failure Across the Spectrum of Ejection Fraction: A Participant-Level Pooled Analysis of DAPA-HF and DELIVER. JAMA Cardiol. Published online 2022. doi:10.1001/JAMACARDIO.2022.3736
- Solomon SD, McMurray JJV, Claggett B, et al. Dapagliflozin in Heart Failure with Mildly Reduced or Preserved Ejection Fraction. New England Journal of Medicine. 2022;387(12):1089-1098. doi:10.1056/NEJMOA2206286/SUPPL_FILE/NEJMOA2206286_DATA-SHARING.PDF
- Selvaraj S, Vaduganathan M, Claggett BL, et al. Blood Pressure and Dapagliflozin in Heart Failure With Mildly Reduced or Preserved Ejection Fraction: DELIVER. JACC Heart Fail. 2023;11(1):76-89. doi:10.1016/J.JCHF.2022.09.002
- Heerspink HJL, Stefánsson B V., Correa-Rotter R, et al. Dapagliflozin in Patients with Chronic Kidney Disease. N Engl J Med. 2020;383(15):1436-1446. doi:10.1056/NEJMOA2024816
- Cherney DZI, Dekkers CCJ, Barbour SJ, et al. Effects of the SGLT2 inhibitor dapagliflozin on proteinuria in non-diabetic patients with chronic kidney disease (DIAMOND): a randomised, double-blind, crossover trial. Lancet Diabetes Endocrinol. 2020;8(7):582-593. doi:10.1016/S2213-8587(20)30162-5
- Packer M, Anker SD, Butler J, et al. Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure. N Engl J Med. 2020;383(15):1413-1424. doi:10.1056/NEJMOA2022190
- Anker SD, Butler J, Filippatos G, et al. Empagliflozin in Heart Failure with a Preserved Ejection Fraction. N Engl J Med. 2021;385(16):1451-1461. doi:10.1056/NEJMOA2107038
- Savarese G, Uijl A, Lund LH, et al. Empagliflozin in Heart Failure With Predicted Preserved Versus Reduced Ejection Fraction: Data From the EMPA-REG OUTCOME Trial. J Card Fail. 2021;27(8):888-895. doi:10.1016/J.CARDFAIL.2021.05.012
- Scheen AJ. Effects of reducing blood pressure on cardiovascular outcomes and mortality in patients with type 2 diabetes: Focus on SGLT2 inhibitors and EMPA-REG OUTCOME. Diabetes Res Clin Pract. 2016;121:204-214. doi:10.1016/J.DIABRES.2016.09.016
- Requena-Ibáñez JA, Santos-Gallego CG, Rodriguez-Cordero A, et al. Mechanistic Insights of Empagliflozin in Nondiabetic Patients With HFrEF: From the EMPA-TROPISM Study. JACC Heart Fail. 2021;9(8):578-589. doi:10.1016/J.JCHF.2021.04.014
- WG H, N S, C W, et al. Empagliflozin in Patients with Chronic Kidney Disease. N Engl J Med. Published online November 4, 2022. doi:10.1056/NEJMOA2204233
- Neal B, Perkovic V, Mahaffey KW, et al. Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes. New England Journal of Medicine. 2017;377(7):644-657. doi:10.1056/NEJMOA1611925/SUPPL_FILE/NEJMOA1611925_DISCLOSURES.PDF
- Matthews DR, Li Q, Perkovic V, et al. Effects of canagliflozin on amputation risk in type 2 diabetes: the CANVAS Program. Diabetologia. 2019;62(6). doi:10.1007/S00125-019-4839-8
- Carbone S, Dixon DL. The CANVAS Program: implications of canagliflozin on reducing cardiovascular risk in patients with type 2 diabetes mellitus. Cardiovasc Diabetol. 2019;18(1). doi:10.1186/S12933-019-0869-2
- Jardine MJ, Mahaffey KW, Neal B, et al. The Canagliflozin and Renal Endpoints in Diabetes with Established Nephropathy Clinical Evaluation (CREDENCE) Study Rationale, Design, and Baseline Characteristics. Am J Nephrol. 2017;46(6):462-472. doi:10.1159/000484633
- Ye N, Jardine MJ, Oshima M, et al. Blood Pressure Effects of Canagliflozin and Clinical Outcomes in Type 2 Diabetes and Chronic Kidney Disease: Insights From the CREDENCE Trial. Circulation. 2021;143(18):1735-1749. doi:10.1161/CIRCULATIONAHA.120.048740
- Müller TD, Finan B, Bloom SR, et al. Glucagon-like peptide 1 (GLP-1). Mol Metab. 2019;30:72-130. doi:10.1016/J.MOLMET.2019.09.010
- Secher A, Jelsing J, Baquero AF, et al. The arcuate nucleus mediates GLP-1 receptor agonist liraglutide-dependent weight loss. J Clin Invest. 2014;124(10):4473-4488. doi:10.1172/JCI75276
- Van Can J, Sloth B, Jensen CB, Flint A, Blaak EE, Saris WHM. Effects of the once-daily GLP- 1 analog liraglutide on gastric emptying, glycemic parameters, appetite and energy metabolism in obese, non-diabetic adults. Int J Obes (Lond). 2014;38(6):784-793. doi:10.1038/IJO.2013.162
- Avogaro A, Azzolina D, Gregori D, De Kreutzenberg S, Fadini GP, Mannucci E. The effect of GLP-1 receptor agonists on N-terminal pro-brain natriuretic peptide. A scoping review and metanalysis. Int J Cardiol. 2022;357:123-127. doi:10.1016/J.IJCARD.2022.03.032
- SP M, GH D, K BF, et al. Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med. 2016;375(4):101. doi:10.1056/NEJMOA1603827
- Neeland IJ, Marso SP, Ayers CR, et al. Effects of liraglutide on visceral and ectopic fat in adults with overweight and obesity at high cardiovascular risk: a randomised, double-blind, placebo-controlled, clinical trial. Lancet Diabetes Endocrinol. 2021;9(9):595-605. doi:10.1016/S2213-8587(21)00179-0
- Knudsen LB, Lau J. The Discovery and Development of Liraglutide and Semaglutide. Front Endocrinol (Lausanne). 2019;10(APR). doi:10.3389/FENDO.2019.00155
- Robinson LE, Holt TA, Rees K, Randeva HS, O’Hare JP. Effects of exenatide and liraglutide on heart rate, blood pressure and body weight: systematic review and meta-analysis. BMJ Open. 2013;3(1). doi:10.1136/BMJOPEN-2012-001986
- Marso SP, Bain SC, Consoli A, et al. Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. New England Journal of Medicine. 2016;375(19):1834-1844. doi:10.1056/NEJMOA1607141/SUPPL_FILE/NEJMOA1607141_DISCLOSURES.PDF
- Lincoff AM, Brown-Frandsen K, Colhoun HM, et al. Semaglutide and Cardiovascular Outcomes in Obesity without Diabetes. N Engl J Med. 2023;389(24). doi:10.1056/NEJMOA2307563
- Husain M, Birkenfeld AL, Donsmark M, et al. Oral Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med. 2019;381(9):841-851. doi:10.1056/NEJMOA1901118
- Volpe S, Lisco G, Fanelli M, et al. Oral semaglutide improves body composition and preserves lean mass in patients with type 2 diabetes: a 26-week prospective real-life study. Front Endocrinol (Lausanne). 2023;14. doi:10.3389/FENDO.2023.1240263
- Candido R, Gaiotti S, Giudici F, et al. Real-World Retrospective Study into the Effects of Oral Semaglutide (As a Switchover or Add-On Therapy) in Type 2 Diabetes. J Clin Med. 2023;12(18). doi:10.3390/JCM12186052
- Yanai H, Hakoshima M, Adachi H, Katsuyama H. A Significant Effect of Oral Semaglutide on Cardiovascular Risk Factors in Patients With Type 2 Diabetes. Cardiol Res. 2022;13(5):303-308. doi:10.14740/CR1441
- Wu W, Tong H mu, Li Y sheng, Cui J. The effect of semaglutide on blood pressure in patients with type-2 diabetes: a systematic review and meta-analysis. Endocrine. Published online 2023. doi:10.1007/S12020-023-03636-9
- Lunati ME, Cimino V, Bernasconi D, et al. Type 2 diabetes mellitus pharmacological remission with dapagliflozin plus oral semaglutide. Pharmacol Res. 2023;199:107040. doi:10.1016/J.PHRS.2023.107040
- Gerstein HC, Colhoun HM, Dagenais GR, et al. Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): a double-blind, randomised placebo-controlled trial. Lancet. 2019;394(10193):121-130. doi:10.1016/S0140-6736(19)31149-3
- Sattar N, McGuire DK, Pavo I, et al. Tirzepatide cardiovascular event risk assessment: a pre- specified meta-analysis. Nat Med. 2022;28(3):591-598. doi:10.1038/S41591-022-01707-4
- Małecki MT, Batterham RL, Sattar N, et al. Predictors of ≥15% Weight Reduction and Associated Changes in Cardiometabolic Risk Factors With Tirzepatide in Adults With Type 2 Diabetes in SURPASS 1-4. Diabetes Care. 2023;46(12). doi:10.2337/DC23-1135
- Le Roux CW, Zhang S, Aronne LJ, et al. Tirzepatide for the treatment of obesity: Rationale and design of the SURMOUNT clinical development program. Obesity (Silver Spring). 2023;31(1):96-110. doi:10.1002/OBY.23612
- Study Record | ClinicalTrials.gov. Accessed September 18, 2023. https://clinicaltrials.gov/study/NCT04255433
- Blüher M, Rosenstock J, Hoefler J, Manuel R, Hennige AM. Dose-response effects on HbA1c and bodyweight reduction of survodutide, a dual glucagon/GLP-1 receptor agonist, compared with placebo and open-label semaglutide in people with type 2 diabetes: a randomised clinical trial. Diabetologia. Published online 2023. doi:10.1007/S00125-023-06053-9
- Tucker EM. New “Twincretin” Pemvidutide: Another Option for Obesity. Medscape.
- Stahl SM, Pradko JF, Haight BR, Modell JG, Rockett CB, Learned-Coughlin S. A Review of the Neuropharmacology of Bupropion, a Dual Norepinephrine and Dopamine Reuptake Inhibitor. Prim Care Companion J Clin Psychiatry. 2004;6(4):159-166. doi:10.4088/PCC.V06N0403
- Billes SK, Sinnayah P, Cowley MA. Naltrexone/bupropion for obesity: an investigational combination pharmacotherapy for weight loss. Pharmacol Res. 2014;84:1-11. doi:10.1016/J.PHRS.2014.04.004
- Apovian CM, Aronne L, Rubino D, et al. A randomized, phase 3 trial of naltrexone SR/bupropion SR on weight and obesity-related risk factors (COR-II). Obesity (Silver Spring). 2013;21(5):935-943. doi:10.1002/OBY.20309
- Aaseth J, Ellefsen S, Alehagen U, Sundfør TM, Alexander J. Diets and drugs for weight loss and health in obesity – An update. Biomed Pharmacother. 2021;140. doi:10.1016/J.BIOPHA.2021.111789
- Sarzani R, Spannella F, Falcioni P, et al. The adipo-centric nature of the common metabolic, cardiovascular, and renal conditions in obese patients. G Ital Arterioscler. 2023;14(4):31-58.
- Sarzani R, Spannella F, Falcioni P, et al. The adipo-centric nature of the common metabolic, cardiovascular, and renal conditions in obese patients. G Ital Arterioscler. 2023;14(4):11-30.
- Elmaleh-Sachs A, Schwartz JL, Bramante CT, Nicklas JM, Gudzune KA, Jay M. Obesity Management in Adults: A Review. JAMA. 2023;330(20):2000-2015. doi:10.1001/JAMA.2023.19897
- Associazione Medici Endocrinologi – Linea Guida ISS su Terapia del sovrappeso e dell’obesità resistenti al trattamento comportamentale nella popolazione adulta con comorbilità metaboliche. Accessed July 1, 2023. http://associazionemediciendocrinologi.it/index.php/position-statement/position-statement-2022/4698-linee-guida-terapia-del-sovrappeso-e-dell-obesita-resistenti-al-trattamento-comportamentale-nella-popolazione-adulta-con-comorbilita-metaboliche
- Alhiary R, Kesselheim AS, Gabriele S, Beall RF, Tu SS, Feldman WB. Patents and Regulatory Exclusivities on GLP-1 Receptor Agonists. JAMA. Published online July 28, 2023. doi:10.1001/JAMA.2023.13872
Related papers
La pubblicazione recente di alcuni lavori scientifici basati sulle risultanze di alcuni osservatori epidemiologi mondiali, ha riportato alla ribalta il ruolo chiave delle malattie cardiovascolari come prima causa di morte e disabilità, non solo nel presente, ma anche nel futuro proiettato oggi al 2050 con un incremento più o meno equamente distribuito tra le malattie [more info]
1) Lipoproteine ed aterosclerosi Le lipoproteine sono particelle composte da un nucleo ricco in esteri del colesterolo e trigliceridi (TG) circondati da colesterolo libero, fosfolipidi e apolipoproteine. Le lipoproteine plasmatiche vengono suddivise in varie classi (VLDL, IDL, LDL, HDL e chilomicroni) in base alle dimensioni, alla composizione lipidica e alle apolipoproteine presenti (Tabella 1). I [more info]
Introduzione Le malattie cardiovascolari rappresentano la principale causa di morbilità e mortalità a livello globale, nonostante i progressi nella prevenzione e nel trattamento farmacologico. In questo contesto, l’adozione di strategie terapeutiche efficaci per la gestione dei fattori di rischio cardiovascolare è fondamentale. La combinazione farmacologica di farmaci con meccanismi d’azione complementari è diventata una pratica [more info]