La fibrillazione atriale è l’aritmia sostenuta di più comune riscontro nella pratica clinica (1). I dati del Global Burden of Disease stimano che la fibrillazione atriale colpisca oltre 37 milioni di persone nel mondo (2,3). Il rischio di sviluppare la fibrillazione atriale nel corso della vita a partire dall’età di 55 anni è del 37% (4). Questo rischio aumenta significativamente con l’età, soprattutto nei maschi che hanno una probabilità quasi doppia rispetto alle femmine di sviluppare la fibrillazione atriale (5).
La frequenza di questa aritmia oscilla tra 1% e 2% nella popolazione generale ma la sua prevalenza cresce da meno dello 0,5% nei soggetti con meno di 50 anni al 3-4% nei soggetti tra 60 e 70 anni fino a raggiungere tra gli ultraottantenni una frequenza stimata nelle diverse casistiche tra il 5% ed il 15% (6-9). Nei prossimi decenni il numero di pazienti affetti da fibrillazione atriale è destinato a raddoppiare a causa del progressivo invecchiamento della popolazione generale, in particolare nei paesi occidentali, conseguente all’espansione di quelle fasce di età tra le quali la fibrillazione atriale è più frequente ed il carico di fattori di rischio per fibrillazione atriale è più importante (Figura 1) (10).
La notevole rilevanza epidemiologica della fibrillazione atriale si associa ad una altrettanto importante rilevanza clinica in ragione della elevata quota di mortalità e morbilità legata a questa aritmia, con le conseguenti ricadute sulla salute del singolo paziente e della collettività e sugli aspetti socioeconomici (10). Peraltro, l’estrinsecazione clinica della fibrillazione atriale non di rado è piuttosto modesta o del tutto assente a fronte di un impatto prognostico quoad vitam e quoad valetudinem decisamente rilevante (10). Non appare inutile sottolineare come la fibrillazione atriale clinicamente manifesta rappresenti solo la punta dell’iceberg di un sommerso di patologia che espone chi ne è affetto ad un rischio di eventi particolarmente elevato.
Determinanti di rischio
La fibrillazione atriale rappresenta spesso il portato della cronica esposizione nel corso della vita a diversi determinanti di rischio cardiovascolare (Figura 2), spesso simultaneamente presenti a condizionare un rischio incrementale di fibrillazione atriale (Figura 3) (10).
L’ipertensione arteriosa è il più comune fattore di rischio modificabile per l’insorgenza di fibrillazione atriale in ragione della sua elevata prevalenza nella popolazione e del suo importante ruolo fisiopatologico nella genesi delle alterazioni strutturali a livello cardiaco che tipicamente favoriscono l’insorgenza di fibrillazione atriale, quali l’ipertrofia ventricolare sinistra, la dilatazione ed il rimodellamento strutturale della parete atriale (11). Il rischio di sviluppare fibrillazione atriale nel paziente iperteso è aumentato di circa il 70% rispetto ai soggetti normotesi (12,13). È interessante notare come il rischio di sviluppare fibrillazione atriale sia aumentato anche nei pazienti con pressione normale-alta (14,15).
Non meno rilevante il ruolo del diabete mellito come determinante patogenetico della fibrillazione atriale. La prevalenza di questa aritmia è circa 2 volte maggiore nei pazienti diabetici rispetto ai soggetti non diabetici (16) e la sua incidenza aumenta progressivamente con la severità delle complicanze microvascolari del diabete (retinopatia e malattia renale) (17). Questa stretta associazione tra fibrillazione atriale e diabete mellito trova il suo substrato fisiopatologico nella frequente condivisione di alcuni determinanti di rischio, quali l’ipertensione e l’obesità (18,19) e nel ruolo predisponente del dismetabolismo glicidico sull’insorgenza di fibrillazione atriale, soprattutto nei soggetti giovani (20), favorita nella sua comparsa dalla presenza di disautonomia legata alla malattia diabetica (21).
L’obesità è un ulteriore determinante indipendente per lo sviluppo di fibrillazione atriale (22). I dati delle coorti di Framingham e del Women’s Health Study dimostrano una stretta relazione tra incremento del peso corporeo e rischio di sviluppare fibrillazione atriale (23,24,25). Nello studio Atherosclerosis Risk in Communities (ARIC) circa un quinto dei nuovi casi di fibrillazione atriale è risultato riconducibile alla presenza di un body mass index > 25 kg/m2 (26,27), dati che portano a identificare nell’eccedenza ponderale il più importante fattore di rischio modificabile per fibrillazione atriale dopo l’ipertensione arteriosa. A tale riguardo, è interessante notare come lo sviluppo in tempi brevi di eccedenza ponderale comporti un significativo incremento del rischio di fibrillazione atriale laddove la riduzione dell’eccedenza ponderale si associa ad una significativa riduzione del rischio di fibrillazione atriale (23). La relazione tra obesità e fibrillazione atriale è indipendente dalla presenza di fattori che tipicamente ad essa si associano, quali il diabete e l’ipertensione arteriosa, come pure dalla presenza di sindrome delle apnee ostruttive, condizione di frequente riscontro nel paziente obeso (28-30).
La presenza di problematiche cardiovascolari rappresenta una condizione altamente predisponente allo sviluppo di fibrillazione atriale. Scompenso cardiaco e fibrillazione atriale spesso coesistono e si influenzano reciprocamente dal punto di vista prognostico (10). Lo scompenso cardiaco, inoltre, è un importante determinante del rischio cardioembolico nel paziente con fibrillazione atriale. Nel paziente con sindrome coronarica acuta l’incidenza di fibrillazione atriale oscilla tra il 2 e il 23% (32), con un rischio di fibrillazione atriale di nuova insorgenza aumentato del 60-77% nei pazienti con infarto miocardico (33).
La fibrillazione atriale è piuttosto frequente anche nei pazienti con BPCO stabile, con una prevalenza che oscilla tra il 4,7% e il 15% nelle diverse casistiche e percentuali significativamente maggiori, pari a circa il 20-30%, nelle forme più severe di BPCO (34-37). Le ragioni di questa associazione tra BPCO e fibrillazione atriale vanno ricercate principalmente nella condivisione dei fattori di rischio. La BPCO, inoltre, può direttamente contribuire alla comparsa di fibrillazione atriale attraverso diversi meccanismi fisiopatologici (37).
La fibrillazione atriale è l’aritmia di più frequente riscontro anche in pazienti con malattia renale e la sua presenza si associa ad un aumento della mortalità (38). La prevalenza della fibrillazione atriale è del 15-20% nella popolazione generale di pazienti nefropatici, mentre nei pazienti in dialisi oscilla nelle diverse casistiche tra il 7 ed il 27% ed incrementa con l’età, anche se il rischio relativo appare più alto nei giovani (39). Un variabile grado di compromissione della funzione renale si osserva nel 40-50% dei pazienti con fibrillazione.
La frequente occorrenza dei diversi determinanti di rischio di fibrillazione atriale in età geriatrica rende ragione della grande diffusione di questa aritmia tra gli anziani. Studi di popolazione condotti in Europa hanno dimostrato, nel corso di quasi 13 anni di follow-up, una sua incidenza complessiva più alta negli uomini che nelle donne (6,4% vs 4,4%), con trend progressivamente crescente all’aumentare dell’età (40,41). Dopo i 50-60 anni, rispettivamente in uomini e donne, i nuovi casi di fibrillazione atriale sono sempre più numerosi, raggiungendo la massima incidenza oltre gli 80 anni (42). Negli ultratottantenni la prevalenza è di circa il 10% ma va considerata una quota non trascurabile di forme non diagnosticate. La particolare suscettibilità dell’anziano a sviluppare fibrillazione atriale è in parte da ricondurre anche ai fenomeni di rimodellamento elettrico e anatomico a carico dell’atrio sinistro legati in parte alle modificazioni fisiologiche o “parafisiologiche” del miocardio atriale dovute alla senescenza stessa. Infatti, dal punto di vista anatomico nel paziente anziano si osserva una progressiva e costante deposizione di tessuto amiloide in atrio, con conseguente perdita di elasticità e contrattilità del miocardio e dilatazione della cavità cardiaca (6). Dal punto di vista elettrico, invece, si verifica un diffuso rallentamento nella conduzione del potenziale elettrico e un aumento dei periodi refrattari dell’atrio associato ad una riduzione della frequenza di scarica del nodo del seno (7). Questi fenomeni involutivi, ovviamente, non sono sempre sufficienti ad innescare una fibrillazione atriale che, se così fosse, dovrebbe interessare tutti gli anziani. Invero, le succitate modificazioni del miocardio rappresentano per lo più condizioni predisponenti che vengono amplificate nelle loro potenzialità aritmogeniche dalla cronica esposizione nel corso della vita ai diversi fattori che aumentano significativamente il rischio di fibrillazione atriale connesso all’età quali l’eccedenza ponderale e la sindrome delle apnee ostruttive, l’ipertensione arteriosa, il diabete mellito e l’insufficienza renale. Le linee guida 2019 AHA/ACC/HRS suggeriscono infatti il controllo dei fattori di rischio come primo intervento per la gestione della fibrillazione atriale sottolineando i benefici della perdita di peso nei pazienti con fibrillazione atriale e body mass index > 27 kg/m2 (43).
Screening della fibrillazione atriale asintomatica
Le ultime Linee Guida della Società Europea di Cardiologia (ESC) e della Società Europea di Chirurgia Cardio Toracica (EACTS) (10) hanno sottolineato la necessità di implementare lo screening della fibrillazione atriale nella pratica clinica, in seguito a numerose considerazioni, tra le quali:
- l’aumento della prevalenza di fibrillazione atriale;
- la rilevazione di fibrillazione atriale precedentemente non nota in circa il 10% di tutti gli ictus ischemici;
- l’elevata prevalenza di fibrillazione atriale asintomatica;
- il potenziale di prevenzione degli ictus correlati alla fibrillazione atriale con un trattamento appropriato.
In questo scenario emerge chiaro l’obiettivo di unire la necessità clinica con i progressi della tecnologia che offre vantaggi economici e opzioni semplici ed utili per il rilevamento della fibrillazione atriale.
Come già accennato, in numerosi casi la fibrillazione atriale è del tutto asintomatica, lasciando esposto il paziente ad un rischio elevatissimo di complicanze, prima fra tutte l’ictus cerebrale ischemico, potenzialmente letale. In considerazione di questo, emerge del tutto ovvio il concetto dell’importanza di un riscontro il più precoce possibile della fibrillazione atriale da parte del paziente al fine di consentire al medico che lo ha in cura di porre in essere gli interventi diagnostici e terapeutici più appropriati. Una recente meta-analisi degli studi clinici disponibili ha dimostrato che lo screening sistematico della fibrillazione atriale è più efficace di quello opportunistico; inoltre, lo screening risulta più efficace se le misurazioni ECG sono ripetute (anche in registrazioni semplificate a meno di 12 derivazioni), rispetto a quelle isolate. In particolare, dall’analisi multivariata è emerso il dato che solo una maggiore frequenza di misurazione del ritmo cardiaco con ECG aveva una significatività statistica nel rilevare la fibrillazione atriale. Questa osservazione ha una certa rilevanza per l’applicazione di sistemi che possano rilevare la fibrillazione atriale in modo semplice. In quest’ottica, oltre ai sistemi ECG tradizionali, oggi sono disponibili numerosi sistemi che consentono di effettuare un soddisfacente screening della fibrillazione atriale, dotati di una elevata specificità e sensibilità rispetto al Gold Standard rappresentato dall’ECG a 12 derivazioni. In base a queste crescenti evidenze, anche le Linee Guida ESC per la diagnosi ed il management della fibrillazione atriale, pur ribadendo il concetto che per definire la diagnosi di FA è necessaria una evidenza elettrocardiografica (ECG), affermano che, oltre al Gold Standard dell’ECG a 12 derivazioni, si possa utilizzare anche un ECG a singola derivazione con un tracciato di almeno 30 secondi (Tabella 1) (10).
In questo nuovo scenario tecnologico, la European Heart Rhythm Association (EHRA) ha sviluppato nel 2022 un Position Paper dal titolo “How to use digital devices to detect and manage arrhythmias: an EHRA practical guide” (44) per fare il punto delle evidenze scientifiche a supporto delle nuove tecnologie; hanno inoltre sviluppato un diagramma di flusso che integra l’utilizzo delle varie tecnologie per lo screening della fibrillazione atriale, principalmente guidato in base alla fascia di età e alla storia clinica dei potenziali pazienti.
Indubbiamente la prospettiva di poter identificare l’enorme sommerso di fibrillazione ricorrendo ai moderni dispositivi che consentono di ottenere una registrazione elettrocardiografica della durata di 30 secondi, adeguata, secondo quanto indicato dalle linee guida, per lo screening della fibrillazione atriale (10) è estremamente interessante. Questi dispositivi, di dimensioni contenute, comodamente riponibili in una tasca, interfacciandosi con una App dedicata, consentono di registrare 1 o 6 derivazioni elettrocardiografiche al proprio domicilio. Invero, non solo molti i dispositivi che hanno ricevuto adeguate validazioni da consentirne l’approvazione da parte di enti regolatori quali la Food and Drug Administration (FDA) (10). Tra questi, il dispositivo KardiaMobile rappresenta un esempio di connubio assai ben riuscito tra i requisiti, entrambi fondamentali, di accuratezza diagnostica e semplicità d’uso. A tale riguardo, il dispositivo KardiaMobile si interfaccia direttamente con una App dedicata scaricabile sul proprio smartphone. Basta appoggiare i polpastrelli di una o due dita di ciascuna mano sui due elettrodi posti sulla parte superiore del dispositivo per avviare la registrazione di una traccia elettrocardiografica che si completa dopo 30 secondi. Esiste anche la possibilità, limitatamente a KardiaMobile 6L, di registrare 6 derivazioni appoggiando la parte inferiore del dispositivo sulla coscia sinistra, in prossimità del ginocchio, o sulla caviglia della stessa gamba, mentre si tengono i polpastrelli sui 2 elettrodi superiori.
Efficacia dello screening della fibrillazione atriale
La palpazione del polso per identificare il “delirium cordis”, tanto caro ai raffinati semeiologi di un tempo quale reperto patognomonico della fibrillazione atriale, ha oggi un significato soprattutto romantico, in ragione del carattere sovente accessionale della fibrillazione atriale che ne rende difficile lo screening in occasione della visita medica. Decisamente più sensibili i nuovi strumenti diagnostici. Meritevoli di menzione, a tale riguardo, i risultati dello studio SEARCH-AF, condotto in una popolazione di 1.000 ultrasessantacinquenni (età media 76 anni) utenti di farmacie, che hanno dimostrato le notevoli potenzialità diagnostiche dello screening mediante ECG su smartphone con una sensibilità nella identificazione della fibrillazione atriale del 98,5% (intervallo di confidenza, 92–100%) ed una specificità del 91,4% (intervallo di confidenza, 89–93%) (45). L’uso di questo dispositivo ha consentito di individuare una fibrillazione atriale misconosciuta nell’1,5% dei soggetti sottoposti a screening. Risultati analoghi sono stati ottenuti nello studio AF-SMART, condotto in una popolazione di 1.805 individui ultrasessantacinquenni seguiti in un contesto di primary care, nel corso del quale l’uso di KardiaMobile ha consentito di individuare una fibrillazione atriale misconosciuta nell’1,1% dei soggetti sottoposti a screening (46). In un ulteriore studio, che ha coinvolto 184 medici di medicina generale canadesi chiamati ad effettuare uno screening della fibrillazione atriale nei loro pazienti ultrasessantacinquenni in un arco temporale di 3 mesi, l’uso di questo tipo di dispositivo ha consentito di identificare 471 casi di fibrillazione atriale misconosciuta su un totale di 7.885 pazienti sottoposti a screening (47). La prevalenza del 6,2%, decisamente elevata, esprime probabilmente una particolare attenzione dei medici coinvolti nel ricercare la fibrillazione atriale nei loro pazienti a più alto rischio. La semplicità d’uso rappresenta indubitabilmente un valore aggiunto per ogni dispositivo che debba poter essere utilizzato prevalentemente in ambito domiciliare.
Meritevoli di menzione anche i risultati del trial SCREEN-AF che ha arruolato 856 soggetti con un’età superiore ai 75 anni e ipertesi, randomizzati a prendere parte a un programma sperimentale di screening per la fibrillazione atriale o a un programma di controllo standard (48). Lo screening prevedeva l’impiego continuativo di un sensore indossabile per la registrazione dell’elettrocardiogramma per due distinti periodi di due settimane a tre mesi di distanza l’uno dall’altro. Nel gruppo di controllo, invece, i soggetti sono stati sottoposti a due visite di controllo, al momento dell’arruolamento e dopo sei mesi. Sono stati individuati 23 casi (5,3%) di fibrillazione atriale nel gruppo sottoposto al programma di screening sperimentale e 2 (0,5%) nel gruppo di controllo (p = 0,001), per un number needed to screen di 21. Il 75% dei pazienti nei quali è stata identificata la fibrillazione atriale sono poi stati sottoposti a un trattamento anticoagulante. In generale, a sei mesi dall’inizio del trial questa strategia di prevenzione farmacologica ha interessato il 4,1% dei soggetti del programma di screening e lo 0,9% di quelli del gruppo di controllo. Questi risultati, indubbiamente interessanti, dimostrano chiaramente l’efficacia diagnostica dei moderni dispositivi per lo screening della fibrillazione atriale subclinica pur non producendo evidenze concrete in termini di possibili ricadute terapeutiche (49).
A tale riguardo, appaiono particolarmente interessanti i risultati dello studio randomizzato prospettico STROKESTOP, che mostrano per la prima volta un beneficio clinico associato a uno screening sistematico per la fibrillazione atriale in soggetti anziani asintomatici (50). Lo studio ha arruolato soggetti di 75-76 anni provenienti dalle contee di Stoccolma (n=23.888) e Halland (n=4.880) in Svezia. Il programma di screening prevedeva l’utilizzo a domicilio di un sistema ECG a singola derivazione 2 volte al giorno per un periodo di 2 settimane. In caso di riscontro di fibrillazione atriale i pazienti venivano inclusi in un programma di visite di follow-up e indirizzati a una terapia con anticoagulanti orali. L’endpoint primario era un composito di ictus ischemico o emorragico, tromboembolismo sistemico, sanguinamenti maggiori per cui si è reso necessario un ricovero o morte per tutte le cause. I risultati del follow-up a 7 anni hanno messo in evidenza nell’analisi intention-to-treat una riduzione del 4% della probabilità di incorrere nell’endpoint composito nel gruppo sottoposto a screening (p=0,045) rispetto al gruppo di controllo, per un numero di persone da invitare per lo screening pari a 91 (per evitare ogni singolo evento è necessario sottoporre a screening 91 persone) (Figura 4) (50).
Non meno interessanti i dati dell’analisi per-protocol che ha dimostrato l’evidenziazione di una fibrillazione atriale misconosciuta nel 5% dei partecipanti ed una riduzione del 24% dell’endpoint primario composito (p<0,001) al follow-up, guidata da un numero significativamente inferiore di ictus ischemici (p<0,001). I risultati dello studio STROKESTOP forniscono la dimostrazione di un beneficio clinico netto dello screening della fibrillazione atriale con la registrazione ECG domiciliare in soggetti anziani. Non appare inutile sottolineare la consistente differenza in termini di riduzione dell’outcome primario includendo nell’analisi anche i soggetti che avevano declinato l’invito a partecipare. Questi soggetti, infatti, hanno presentato un numero di eventi superiore a quanto osservato nei soggetti che avevano effettivamente partecipato allo studio, dato suggestivo di condizioni generali probabilmente peggiori (Figura 5) (50).
La significatività di quanto emerso dall’analisi più conservativa dei dati dimostra comunque un beneficio clinico netto della procedura di screening della fibrillazione atriale asintomatica.
Conclusioni
Lo screening della fibrillazione atriale rappresenta una tematica clinica di indiscutibile rilevanza. L’attuale disponibilità di moderni dispositivi che consentono di derivare, interfacciandosi con una App dedicata, una registrazione elettrocardiografica di 1 o più derivazioni della durata di 30 secondi, nel rispetto di quanto raccomandato dalle linee guida, rappresenta un importante passo in avanti nello screening di quella quota sommersa di fibrillazione atriale responsabile di una proporzione rilevante di eventi embolici a livello cerebrale e sistemico, soprattutto nei soggetti maggiormente a rischio quali gli anziani. Questi dispositivi, semplici da usare e di dimensioni contenute, rappresentano una preziosa opportunità per estendere con semplicità lo screening della fibrillazione atriale ad ampie fasce di popolazione, come i pazienti geriatrici o, più in generale, i soggetti ad aumentato rischio cardiovascolare tra i quali la fibrillazione atriale misconosciuta è una problematica assai frequente e condiziona ricadute cliniche spesso particolarmente rilevanti.
Bibliografia
- Chugh SS, et al. Worldwide epidemiology of atrial fibrillation: a Global Burden of Disease 2010 study. Circulation 2014;129:837–47.
- Dai H, et al. Global, regional, and national prevalence, incidence, mortality, and risk factors for atrial fibrillation, 1990–2017: results from the Global Burden of Disease Study 2017. Eur Heart J Qual Care Clin Outcomes 2021;7:574–82.
- Smyth B, et al. Opportunistic screening for atrial fibrillation in a rural area. QJM 2016;109:539–43.
- Weng L-C, et al. Genetic predisposition, clinical risk factor burden, and lifetime risk of atrial fibrillation. Circulation 2018;137:1027–38.
- Zoni-Berisso M, et al. Epidemiology of atrial fibrillation: European perspective. Clin Epidemiol 2014;6:213–20.
- Kirchhof P, et al. Comprehensive risk reduction in patients with atrial fibrillation: emerging diagnostic and therapeutic options. Executive summary of the report from the 3rd AFNET/EHRA consensus conference. Thromb Haemost. 2011;106:1012–1019.
- McIntyre WF, Healey J. Stroke prevention for patients with atrial fibrillation: beyond the guidelines. J Atr Fibrillation. 2017;9:1475. doi: 10.4022/jafib.147
- Chugh SS, et al. Global burden of atrial fibrillation in developed and developing nations. Glob Heart. 2014;9:113–119.
- Kirchhof P, et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur J Cardiothorac Surg. 2016;50:e1–e88.
- Hindricks G, et al; ESC Scientific Document Group. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J. 2021 Feb 1;42(5):373-498.
- Ha JT, et al. Benefits and harms of oral anticoagulant therapy in chronic kidney disease: a systematic review and meta-analysis. Ann Intern Med 2019;171:181-189.
- Lip GYH, et al. Hypertension and cardiac arrhythmias: a consensus document from the European Heart Rhythm Association (EHRA) and ESC Council on Hypertension, endorsed by the Heart Rhythm Society (HRS), Asia-Pacific Heart Rhythm Society (APHRS) and Sociedad Latinoamericana de Estimulacion Cardiaca y Electrofisiologia (SOLEACE). Europace 2017;19:891 911.
- Dzeshka MS, et al. Atrial fibrillation and hypertension. Hypertension 2017;70:854-861.
- Pokorney SD. RENal hemodialysis patients ALlocated apixaban versus warfarin in Atrial Fibrillation (RENAL-AF). Presentation at the American Heart Association Annual Scientific Sessions (AHA 2019), Philadelphia, PA, 16 November 2019.
- Violi F, et al. ARAPACIS Study Investigators. Prevalence of peripheral artery disease by abnormal ankle-brachial index in atrial fibrillation: implications for risk and therapy. J Am Coll Cardiol 2013;62:2255-2256.
- Movahed MR, et al. Diabetes mellitus is a strong, independent risk for atrial fibrillation and flutter in addition to other cardiovascular disease. Int J Cardiol 2005;105:315-318.
- Lee SR, et al. Evaluation of the association between diabetic retinopathy and the incidence of atrial fibrillation: a nationwide population-based study. Int J Cardiol 2016;223:953-957.
- Wang TJ, et al. Obesity and the risk of new-onset atrial fibrillation. JAMA 2004;292:2471-2477.
- Du X, et al. Risks of cardiovascular events and effects of routine blood pressure lowering among patients with type 2 diabetes and atrial fibrillation: results of the ADVANCE study. Eur Heart J 2009;30:1128 1135.
- Pallisgaard JL, et al. Risk of atrial fibrillation in diabetes mellitus: a nationwide cohort study. Eur J Prev Cardiol 2016;23:621-627.
- Rizzo MR, et al. Autonomic dysfunction is associated with brief episodes of atrial fibrillation in type 2 diabetes. J Diabetes Complications 2015;29:88-92.
- Javed S et al. Obesity and atrial fibrillation: making inroads through fat. Eur Heart J Cardiovasc Pharmacother 2021 Jan 16;7(1):59-67.
- Tedrow UB, et al. The long- and short-term impact of elevated body mass index on the risk of new atrial fibrillation the WHS (Women’s Health Study). J Am Coll Cardiol 2010;55:2319–2327.
- Echahidi N, et al. Obesity and metabolic syndrome are independent risk factors for atrial fibrillation after coronary artery bypass graft surgery. Circulation 2007;116:I213–I219.
- Wang TJ, et al. Obesity and the risk of new-onset atrial fibrillation. JAMA 2004;292:2471–2477.
- Morin DP, et al. The state of the art: atrial fibrillation epidemiology, prevention, and treatment. Mayo Clin Proc 2016;91:1778–1810.
- Huxley RR, et al. Absolute and attributable risks of atrial fibrillation in relation to optimal and borderline risk factors: the Atherosclerosis Risk in Communities (ARIC) study. Circulation 2011;123:1501–1508.
- Frost L, et al. Overweight and obesity as risk factors for atrial fibrillation or flutter: the Danish Diet, Cancer, and Health Study. Am J Med 2005;118:489–495.
- Tsang TS, et al. Obesity as a risk factor for the progression of paroxysmal to permanent atrial fibrillation: a longitudinal cohort study of 21 years. Eur Heart J 2008;29:2227–2233.
- Foy AJ, et al. Relation of obesity to new-onset atrial fibrillation and atrial flutter in adults. Am J Cardiol 2018;121:1072–1075.
- Karasoy D, et al. Obesity is a risk factor for atrial fibrillation among fertile young women: a nationwide cohort study. Europace 2013;15:781–786.
- Szekely P. Systemic embolism and anticoagulant prophylaxis in rheumatic heart disease. Br Med J 1964;1:1209-1212.
- Philippart R, et al. Oral anticoagulation, stroke and thromboembolism in patients with atrial fibrillation and valve bioprosthesis. The Loire Valley Atrial Fibrillation Project. Thromb Haemost 2016;115:1056-1063.
- Konecny T, et al. Relation of chronic obstructive pulmonary disease to atrial and ventricular arrhythmias. Am J Cardiol 2014;114:272–277.
- Liao KM, et al. Incidence and risk factors of atrial fibrillation in Asian COPD patients. Int J Chron Obstruct Pulmon Dis. 2017 Aug 23;12:2523-2530.
- Chen X, et al. The progression in atrial fibrillation patients with COPD: a systematic review and meta-analysis. Oncotarget. 2017 Oct 26;8(60):102420-102427.
- Simons SO, et al. Chronic obstructive pulmonary disease and atrial fibrillation: an interdisciplinary perspective. Eur Heart J. 2021 Feb 1;42(5):532-540.
- Zimmerman D, et al. Systematic review and meta-analysis of incidence, prevalence and outcomes of atrial fibrillation in patients on dialysis. Nephrol Dial Transplant 2012;27:3816-3822.
- Wetmore JB, et al. The prevalence of and factors associated with chronic atrial fibrillation in Medicare/Medicaid-eligible dialysis patients. Kidney Int 2012;81:469–76.
- Marchionni N, , et al. Percorso clinico decisionale nel paziente anziano fragile con fibrillazione atriale: la proposta di un gruppo di lavoro multidisciplinare. G Ital Cardiol (Rome). 2021 Feb;22(2 Suppl 1):e3-e27.
- Volgman AS, et al. Management of Atrial Fibrillation in Patients 75 Years and Older: JACC State-of-the-Art Review. J Am Coll Cardiol. 2022 Jan 18;79(2):166-179. doi: 10.1016/j.jacc.2021.10.037.
- Magnussen C, et al. Sex differences and similarities in atrial fibrillation epidemiology, risk factors, and mortality in community cohorts: results from the BiomarCaRE Consortium (Biomarker for Cardiovascular Risk Assessment in Europe). Circulation 2017;136:1588-97.
- January CT, Wann LS, Calkins H, et al. 2019 AHA/ACC/HRS focused update of the 2014 AHA/ ACC/HRS Guideline for the Management of Patients With Atrial Fibrillation: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm. Society. J Am Coll Cardiol. 2019;74:104–132.
- How to use digital devices to detect and manage arrhythmias: an EHRA practical guide. E. Svennberg et al. April 2022.
- Lowres N, et al. Feasibility and cost-effectiveness of stroke prevention through community screening for atrial fibrillation using iPhone ECG in pharmacies. The SEARCH-AF study. Thromb Haemost 2014;111:1167–1176.
- Orchard J, et al. eHealth tools to provide structured assistance for atrial fibrillation screening, management, and guideline-recommended therapy in metropolitan general practice: the AF—SMART study. J Am Heart Assoc 2019;8: e010959.
- Godin R, et al. Screening for atrial fibrillation using a mobile, single-lead electrocardiogram in Canadian Primary Care Clinics. Can J Cardiol 2019;35:840–845.
- Gladstone DJ, Wachter M, Schmalstieg-Bahr K, et al. Screening for Atrial Fibrillation in the Older Population. A Randomized Clinical Trial. JAMA Cardiology 2021; doi:10.1001/jamacardio.2021.0038.
- Sandhu RK, Albert C. Screening the Older Population for Atrial Fibrillation—Have We Moved the Needle Forward? JAMA Cardiology 2021; doi:10.1001/jamacardio.2021.0052
- Svennberg E, Friberg L, Frykman V, Al-Khalili F, Engdahl J, Rosenqvist M. Clinical outcomes in systematic screening for atrial fibrillation (STROKESTOP): a multicentre, parallel group, unmasked, randomised controlled trial. Lancet. 2021 Oct 23;398(10310):1498-1506. doi: 10.1016/S0140-6736(21)01637-8. Epub 2021 Aug 29. PMID: 34469764.
La fibrillazione atriale è l’aritmia sostenuta di più comune riscontro nella pratica clinica (1). I dati del Global Burden of Disease stimano che la fibrillazione atriale colpisca oltre 37 milioni di persone nel mondo (2,3). Il rischio di sviluppare la fibrillazione atriale nel corso della vita a partire dall’età di 55 anni è del 37% (4). Questo rischio aumenta significativamente con l’età, soprattutto nei maschi che hanno una probabilità quasi doppia rispetto alle femmine di sviluppare la fibrillazione atriale (5).
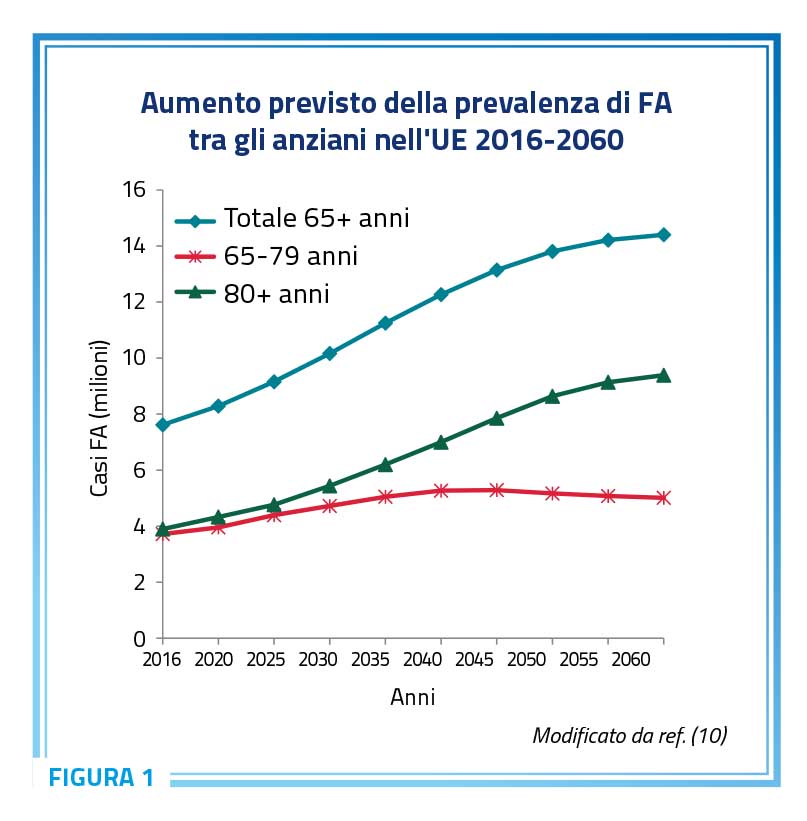
La frequenza di questa aritmia oscilla tra 1% e 2% nella popolazione generale ma la sua prevalenza cresce da meno dello 0,5% nei soggetti con meno di 50 anni al 3-4% nei soggetti tra 60 e 70 anni fino a raggiungere tra gli ultraottantenni una frequenza stimata nelle diverse casistiche tra il 5% ed il 15% (6-9). Nei prossimi decenni il numero di pazienti affetti da fibrillazione atriale è destinato a raddoppiare a causa del progressivo invecchiamento della popolazione generale, in particolare nei paesi occidentali, conseguente all’espansione di quelle fasce di età tra le quali la fibrillazione atriale è più frequente ed il carico di fattori di rischio per fibrillazione atriale è più importante (Figura 1) (10).
La notevole rilevanza epidemiologica della fibrillazione atriale si associa ad una altrettanto importante rilevanza clinica in ragione della elevata quota di mortalità e morbilità legata a questa aritmia, con le conseguenti ricadute sulla salute del singolo paziente e della collettività e sugli aspetti socioeconomici (10). Peraltro, l’estrinsecazione clinica della fibrillazione atriale non di rado è piuttosto modesta o del tutto assente a fronte di un impatto prognostico quoad vitam e quoad valetudinem decisamente rilevante (10). Non appare inutile sottolineare come la fibrillazione atriale clinicamente manifesta rappresenti solo la punta dell’iceberg di un sommerso di patologia che espone chi ne è affetto ad un rischio di eventi particolarmente elevato.
Determinanti di rischio
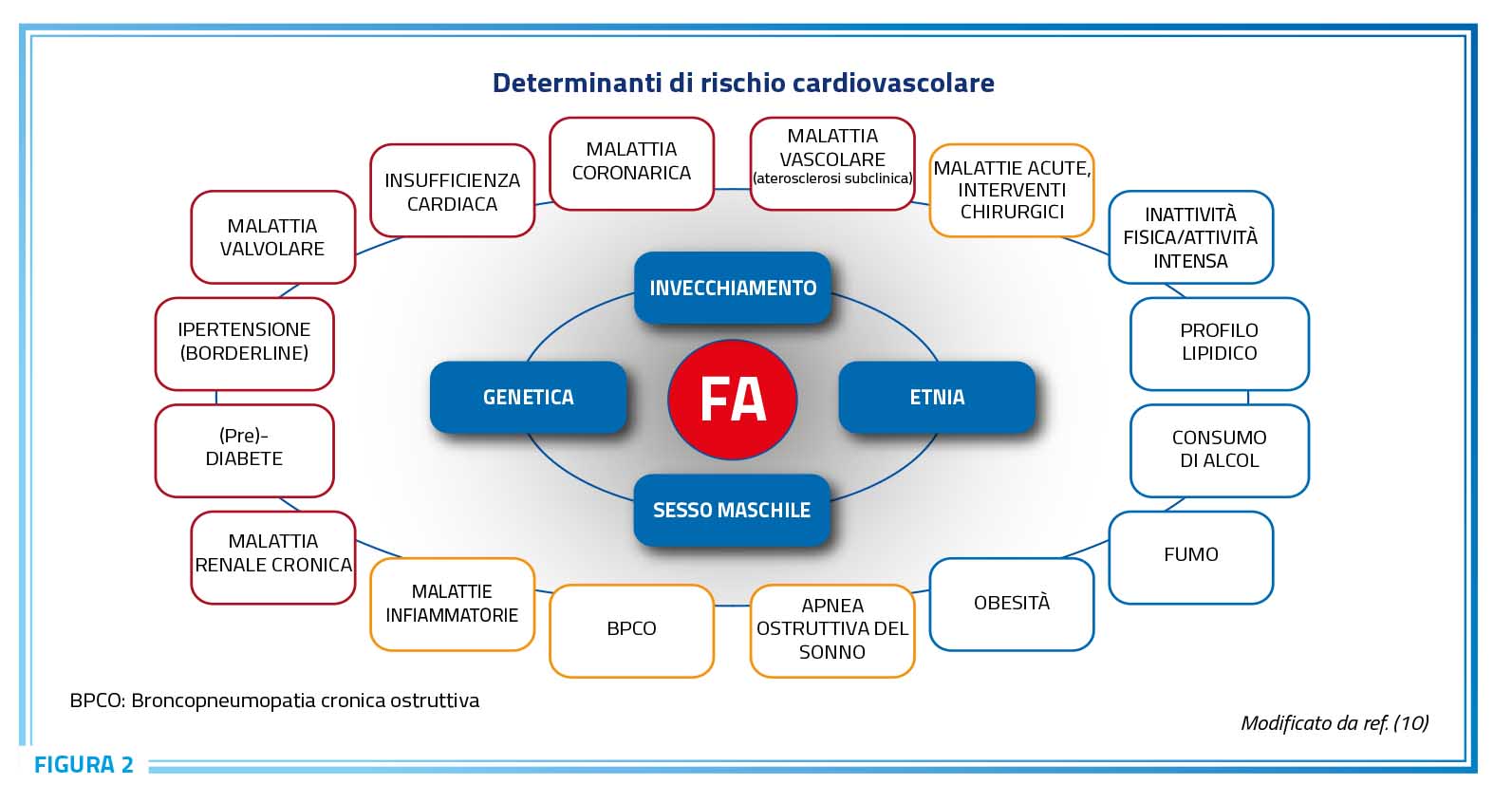
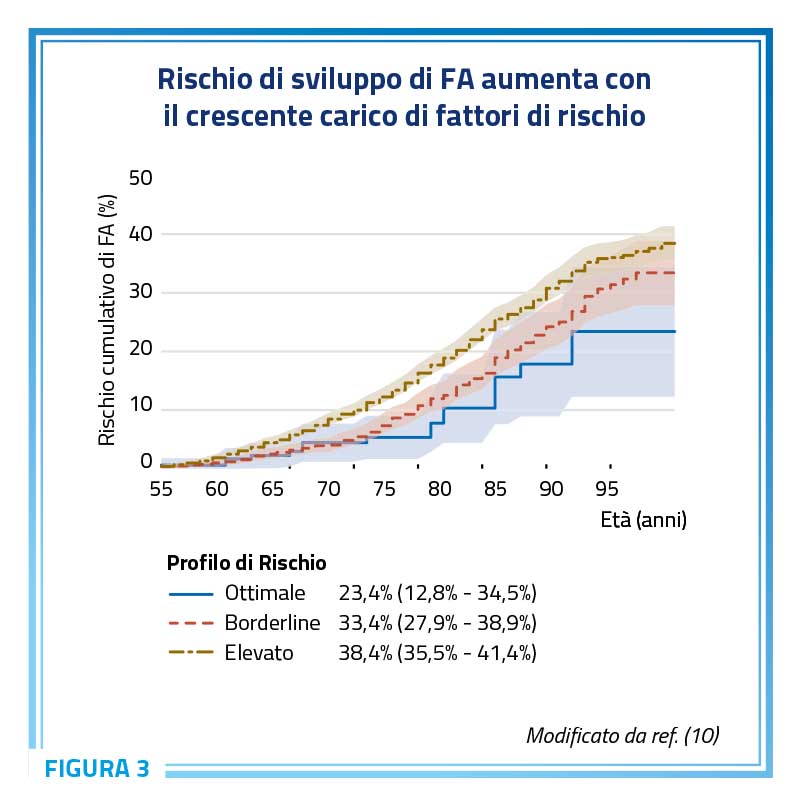
La fibrillazione atriale rappresenta spesso il portato della cronica esposizione nel corso della vita a diversi determinanti di rischio cardiovascolare (Figura 2), spesso simultaneamente presenti a condizionare un rischio incrementale di fibrillazione atriale (Figura 3) (10).
L’ipertensione arteriosa è il più comune fattore di rischio modificabile per l’insorgenza di fibrillazione atriale in ragione della sua elevata prevalenza nella popolazione e del suo importante ruolo fisiopatologico nella genesi delle alterazioni strutturali a livello cardiaco che tipicamente favoriscono l’insorgenza di fibrillazione atriale, quali l’ipertrofia ventricolare sinistra, la dilatazione ed il rimodellamento strutturale della parete atriale (11). Il rischio di sviluppare fibrillazione atriale nel paziente iperteso è aumentato di circa il 70% rispetto ai soggetti normotesi (12,13). È interessante notare come il rischio di sviluppare fibrillazione atriale sia aumentato anche nei pazienti con pressione normale-alta (14,15).
Non meno rilevante il ruolo del diabete mellito come determinante patogenetico della fibrillazione atriale. La prevalenza di questa aritmia è circa 2 volte maggiore nei pazienti diabetici rispetto ai soggetti non diabetici (16) e la sua incidenza aumenta progressivamente con la severità delle complicanze microvascolari del diabete (retinopatia e malattia renale) (17). Questa stretta associazione tra fibrillazione atriale e diabete mellito trova il suo substrato fisiopatologico nella frequente condivisione di alcuni determinanti di rischio, quali l’ipertensione e l’obesità (18,19) e nel ruolo predisponente del dismetabolismo glicidico sull’insorgenza di fibrillazione atriale, soprattutto nei soggetti giovani (20), favorita nella sua comparsa dalla presenza di disautonomia legata alla malattia diabetica (21).
L’obesità è un ulteriore determinante indipendente per lo sviluppo di fibrillazione atriale (22). I dati delle coorti di Framingham e del Women’s Health Study dimostrano una stretta relazione tra incremento del peso corporeo e rischio di sviluppare fibrillazione atriale (23,24,25). Nello studio Atherosclerosis Risk in Communities (ARIC) circa un quinto dei nuovi casi di fibrillazione atriale è risultato riconducibile alla presenza di un body mass index > 25 kg/m2 (26,27), dati che portano a identificare nell’eccedenza ponderale il più importante fattore di rischio modificabile per fibrillazione atriale dopo l’ipertensione arteriosa. A tale riguardo, è interessante notare come lo sviluppo in tempi brevi di eccedenza ponderale comporti un significativo incremento del rischio di fibrillazione atriale laddove la riduzione dell’eccedenza ponderale si associa ad una significativa riduzione del rischio di fibrillazione atriale (23). La relazione tra obesità e fibrillazione atriale è indipendente dalla presenza di fattori che tipicamente ad essa si associano, quali il diabete e l’ipertensione arteriosa, come pure dalla presenza di sindrome delle apnee ostruttive, condizione di frequente riscontro nel paziente obeso (28-30).
La presenza di problematiche cardiovascolari rappresenta una condizione altamente predisponente allo sviluppo di fibrillazione atriale. Scompenso cardiaco e fibrillazione atriale spesso coesistono e si influenzano reciprocamente dal punto di vista prognostico (10). Lo scompenso cardiaco, inoltre, è un importante determinante del rischio cardioembolico nel paziente con fibrillazione atriale. Nel paziente con sindrome coronarica acuta l’incidenza di fibrillazione atriale oscilla tra il 2 e il 23% (32), con un rischio di fibrillazione atriale di nuova insorgenza aumentato del 60-77% nei pazienti con infarto miocardico (33).
La fibrillazione atriale è piuttosto frequente anche nei pazienti con BPCO stabile, con una prevalenza che oscilla tra il 4,7% e il 15% nelle diverse casistiche e percentuali significativamente maggiori, pari a circa il 20-30%, nelle forme più severe di BPCO (34-37). Le ragioni di questa associazione tra BPCO e fibrillazione atriale vanno ricercate principalmente nella condivisione dei fattori di rischio. La BPCO, inoltre, può direttamente contribuire alla comparsa di fibrillazione atriale attraverso diversi meccanismi fisiopatologici (37).
La fibrillazione atriale è l’aritmia di più frequente riscontro anche in pazienti con malattia renale e la sua presenza si associa ad un aumento della mortalità (38). La prevalenza della fibrillazione atriale è del 15-20% nella popolazione generale di pazienti nefropatici, mentre nei pazienti in dialisi oscilla nelle diverse casistiche tra il 7 ed il 27% ed incrementa con l’età, anche se il rischio relativo appare più alto nei giovani (39). Un variabile grado di compromissione della funzione renale si osserva nel 40-50% dei pazienti con fibrillazione.
La frequente occorrenza dei diversi determinanti di rischio di fibrillazione atriale in età geriatrica rende ragione della grande diffusione di questa aritmia tra gli anziani. Studi di popolazione condotti in Europa hanno dimostrato, nel corso di quasi 13 anni di follow-up, una sua incidenza complessiva più alta negli uomini che nelle donne (6,4% vs 4,4%), con trend progressivamente crescente all’aumentare dell’età (40,41). Dopo i 50-60 anni, rispettivamente in uomini e donne, i nuovi casi di fibrillazione atriale sono sempre più numerosi, raggiungendo la massima incidenza oltre gli 80 anni (42). Negli ultratottantenni la prevalenza è di circa il 10% ma va considerata una quota non trascurabile di forme non diagnosticate. La particolare suscettibilità dell’anziano a sviluppare fibrillazione atriale è in parte da ricondurre anche ai fenomeni di rimodellamento elettrico e anatomico a carico dell’atrio sinistro legati in parte alle modificazioni fisiologiche o “parafisiologiche” del miocardio atriale dovute alla senescenza stessa. Infatti, dal punto di vista anatomico nel paziente anziano si osserva una progressiva e costante deposizione di tessuto amiloide in atrio, con conseguente perdita di elasticità e contrattilità del miocardio e dilatazione della cavità cardiaca (6). Dal punto di vista elettrico, invece, si verifica un diffuso rallentamento nella conduzione del potenziale elettrico e un aumento dei periodi refrattari dell’atrio associato ad una riduzione della frequenza di scarica del nodo del seno (7). Questi fenomeni involutivi, ovviamente, non sono sempre sufficienti ad innescare una fibrillazione atriale che, se così fosse, dovrebbe interessare tutti gli anziani. Invero, le succitate modificazioni del miocardio rappresentano per lo più condizioni predisponenti che vengono amplificate nelle loro potenzialità aritmogeniche dalla cronica esposizione nel corso della vita ai diversi fattori che aumentano significativamente il rischio di fibrillazione atriale connesso all’età quali l’eccedenza ponderale e la sindrome delle apnee ostruttive, l’ipertensione arteriosa, il diabete mellito e l’insufficienza renale. Le linee guida 2019 AHA/ACC/HRS suggeriscono infatti il controllo dei fattori di rischio come primo intervento per la gestione della fibrillazione atriale sottolineando i benefici della perdita di peso nei pazienti con fibrillazione atriale e body mass index > 27 kg/m2 (43).
Screening della fibrillazione atriale asintomatica
Le ultime Linee Guida della Società Europea di Cardiologia (ESC) e della Società Europea di Chirurgia Cardio Toracica (EACTS) (10) hanno sottolineato la necessità di implementare lo screening della fibrillazione atriale nella pratica clinica, in seguito a numerose considerazioni, tra le quali:
- l’aumento della prevalenza di fibrillazione atriale;
- la rilevazione di fibrillazione atriale precedentemente non nota in circa il 10% di tutti gli ictus ischemici;
- l’elevata prevalenza di fibrillazione atriale asintomatica;
- il potenziale di prevenzione degli ictus correlati alla fibrillazione atriale con un trattamento appropriato.
In questo scenario emerge chiaro l’obiettivo di unire la necessità clinica con i progressi della tecnologia che offre vantaggi economici e opzioni semplici ed utili per il rilevamento della fibrillazione atriale.
Come già accennato, in numerosi casi la fibrillazione atriale è del tutto asintomatica, lasciando esposto il paziente ad un rischio elevatissimo di complicanze, prima fra tutte l’ictus cerebrale ischemico, potenzialmente letale. In considerazione di questo, emerge del tutto ovvio il concetto dell’importanza di un riscontro il più precoce possibile della fibrillazione atriale da parte del paziente al fine di consentire al medico che lo ha in cura di porre in essere gli interventi diagnostici e terapeutici più appropriati. Una recente meta-analisi degli studi clinici disponibili ha dimostrato che lo screening sistematico della fibrillazione atriale è più efficace di quello opportunistico; inoltre, lo screening risulta più efficace se le misurazioni ECG sono ripetute (anche in registrazioni semplificate a meno di 12 derivazioni), rispetto a quelle isolate. In particolare, dall’analisi multivariata è emerso il dato che solo una maggiore frequenza di misurazione del ritmo cardiaco con ECG aveva una significatività statistica nel rilevare la fibrillazione atriale. Questa osservazione ha una certa rilevanza per l’applicazione di sistemi che possano rilevare la fibrillazione atriale in modo semplice. In quest’ottica, oltre ai sistemi ECG tradizionali, oggi sono disponibili numerosi sistemi che consentono di effettuare un soddisfacente screening della fibrillazione atriale, dotati di una elevata specificità e sensibilità rispetto al Gold Standard rappresentato dall’ECG a 12 derivazioni. In base a queste crescenti evidenze, anche le Linee Guida ESC per la diagnosi ed il management della fibrillazione atriale, pur ribadendo il concetto che per definire la diagnosi di FA è necessaria una evidenza elettrocardiografica (ECG), affermano che, oltre al Gold Standard dell’ECG a 12 derivazioni, si possa utilizzare anche un ECG a singola derivazione con un tracciato di almeno 30 secondi (Tabella 1) (10).
In questo nuovo scenario tecnologico, la European Heart Rhythm Association (EHRA) ha sviluppato nel 2022 un Position Paper dal titolo “How to use digital devices to detect and manage arrhythmias: an EHRA practical guide” (44) per fare il punto delle evidenze scientifiche a supporto delle nuove tecnologie; hanno inoltre sviluppato un diagramma di flusso che integra l’utilizzo delle varie tecnologie per lo screening della fibrillazione atriale, principalmente guidato in base alla fascia di età e alla storia clinica dei potenziali pazienti.
Indubbiamente la prospettiva di poter identificare l’enorme sommerso di fibrillazione ricorrendo ai moderni dispositivi che consentono di ottenere una registrazione elettrocardiografica della durata di 30 secondi, adeguata, secondo quanto indicato dalle linee guida, per lo screening della fibrillazione atriale (10) è estremamente interessante. Questi dispositivi, di dimensioni contenute, comodamente riponibili in una tasca, interfacciandosi con una App dedicata, consentono di registrare 1 o 6 derivazioni elettrocardiografiche al proprio domicilio. Invero, non solo molti i dispositivi che hanno ricevuto adeguate validazioni da consentirne l’approvazione da parte di enti regolatori quali la Food and Drug Administration (FDA) (10). Tra questi, il dispositivo KardiaMobile rappresenta un esempio di connubio assai ben riuscito tra i requisiti, entrambi fondamentali, di accuratezza diagnostica e semplicità d’uso. A tale riguardo, il dispositivo KardiaMobile si interfaccia direttamente con una App dedicata scaricabile sul proprio smartphone. Basta appoggiare i polpastrelli di una o due dita di ciascuna mano sui due elettrodi posti sulla parte superiore del dispositivo per avviare la registrazione di una traccia elettrocardiografica che si completa dopo 30 secondi. Esiste anche la possibilità, limitatamente a KardiaMobile 6L, di registrare 6 derivazioni appoggiando la parte inferiore del dispositivo sulla coscia sinistra, in prossimità del ginocchio, o sulla caviglia della stessa gamba, mentre si tengono i polpastrelli sui 2 elettrodi superiori.
Efficacia dello screening della fibrillazione atriale
La palpazione del polso per identificare il “delirium cordis”, tanto caro ai raffinati semeiologi di un tempo quale reperto patognomonico della fibrillazione atriale, ha oggi un significato soprattutto romantico, in ragione del carattere sovente accessionale della fibrillazione atriale che ne rende difficile lo screening in occasione della visita medica. Decisamente più sensibili i nuovi strumenti diagnostici. Meritevoli di menzione, a tale riguardo, i risultati dello studio SEARCH-AF, condotto in una popolazione di 1.000 ultrasessantacinquenni (età media 76 anni) utenti di farmacie, che hanno dimostrato le notevoli potenzialità diagnostiche dello screening mediante ECG su smartphone con una sensibilità nella identificazione della fibrillazione atriale del 98,5% (intervallo di confidenza, 92–100%) ed una specificità del 91,4% (intervallo di confidenza, 89–93%) (45). L’uso di questo dispositivo ha consentito di individuare una fibrillazione atriale misconosciuta nell’1,5% dei soggetti sottoposti a screening. Risultati analoghi sono stati ottenuti nello studio AF-SMART, condotto in una popolazione di 1.805 individui ultrasessantacinquenni seguiti in un contesto di primary care, nel corso del quale l’uso di KardiaMobile ha consentito di individuare una fibrillazione atriale misconosciuta nell’1,1% dei soggetti sottoposti a screening (46). In un ulteriore studio, che ha coinvolto 184 medici di medicina generale canadesi chiamati ad effettuare uno screening della fibrillazione atriale nei loro pazienti ultrasessantacinquenni in un arco temporale di 3 mesi, l’uso di questo tipo di dispositivo ha consentito di identificare 471 casi di fibrillazione atriale misconosciuta su un totale di 7.885 pazienti sottoposti a screening (47). La prevalenza del 6,2%, decisamente elevata, esprime probabilmente una particolare attenzione dei medici coinvolti nel ricercare la fibrillazione atriale nei loro pazienti a più alto rischio. La semplicità d’uso rappresenta indubitabilmente un valore aggiunto per ogni dispositivo che debba poter essere utilizzato prevalentemente in ambito domiciliare.
Meritevoli di menzione anche i risultati del trial SCREEN-AF che ha arruolato 856 soggetti con un’età superiore ai 75 anni e ipertesi, randomizzati a prendere parte a un programma sperimentale di screening per la fibrillazione atriale o a un programma di controllo standard (48). Lo screening prevedeva l’impiego continuativo di un sensore indossabile per la registrazione dell’elettrocardiogramma per due distinti periodi di due settimane a tre mesi di distanza l’uno dall’altro. Nel gruppo di controllo, invece, i soggetti sono stati sottoposti a due visite di controllo, al momento dell’arruolamento e dopo sei mesi. Sono stati individuati 23 casi (5,3%) di fibrillazione atriale nel gruppo sottoposto al programma di screening sperimentale e 2 (0,5%) nel gruppo di controllo (p = 0,001), per un number needed to screen di 21. Il 75% dei pazienti nei quali è stata identificata la fibrillazione atriale sono poi stati sottoposti a un trattamento anticoagulante. In generale, a sei mesi dall’inizio del trial questa strategia di prevenzione farmacologica ha interessato il 4,1% dei soggetti del programma di screening e lo 0,9% di quelli del gruppo di controllo. Questi risultati, indubbiamente interessanti, dimostrano chiaramente l’efficacia diagnostica dei moderni dispositivi per lo screening della fibrillazione atriale subclinica pur non producendo evidenze concrete in termini di possibili ricadute terapeutiche (49).
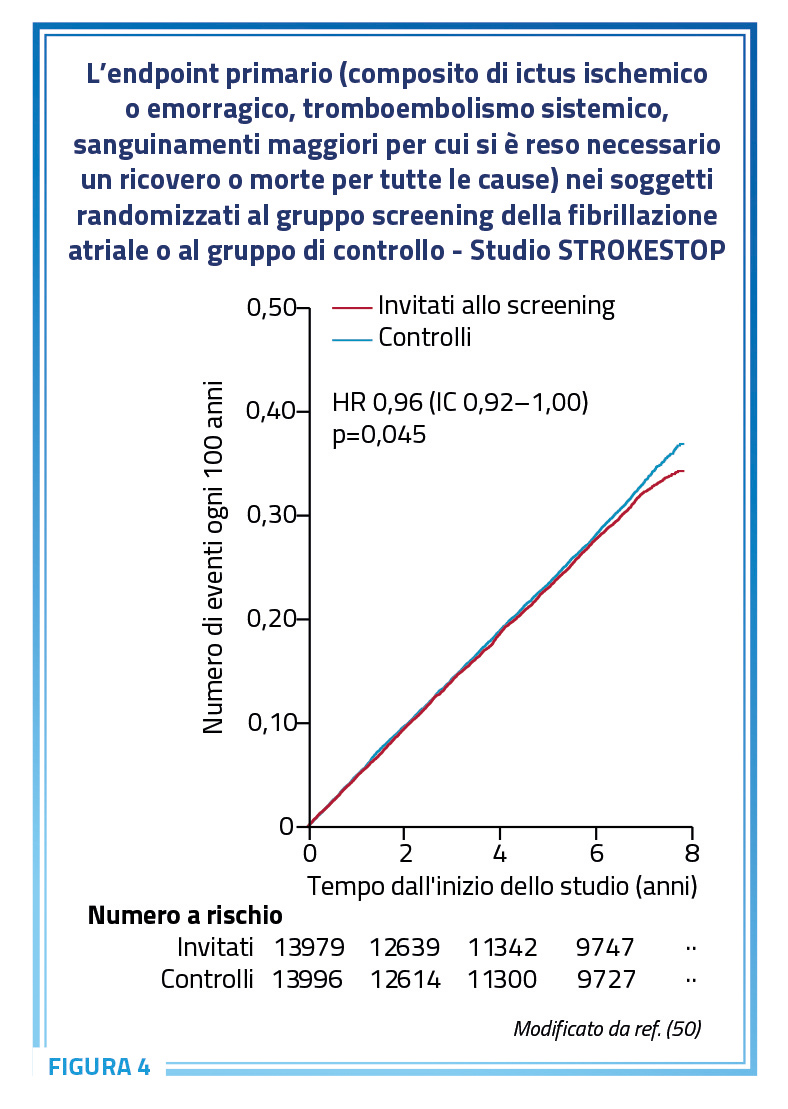
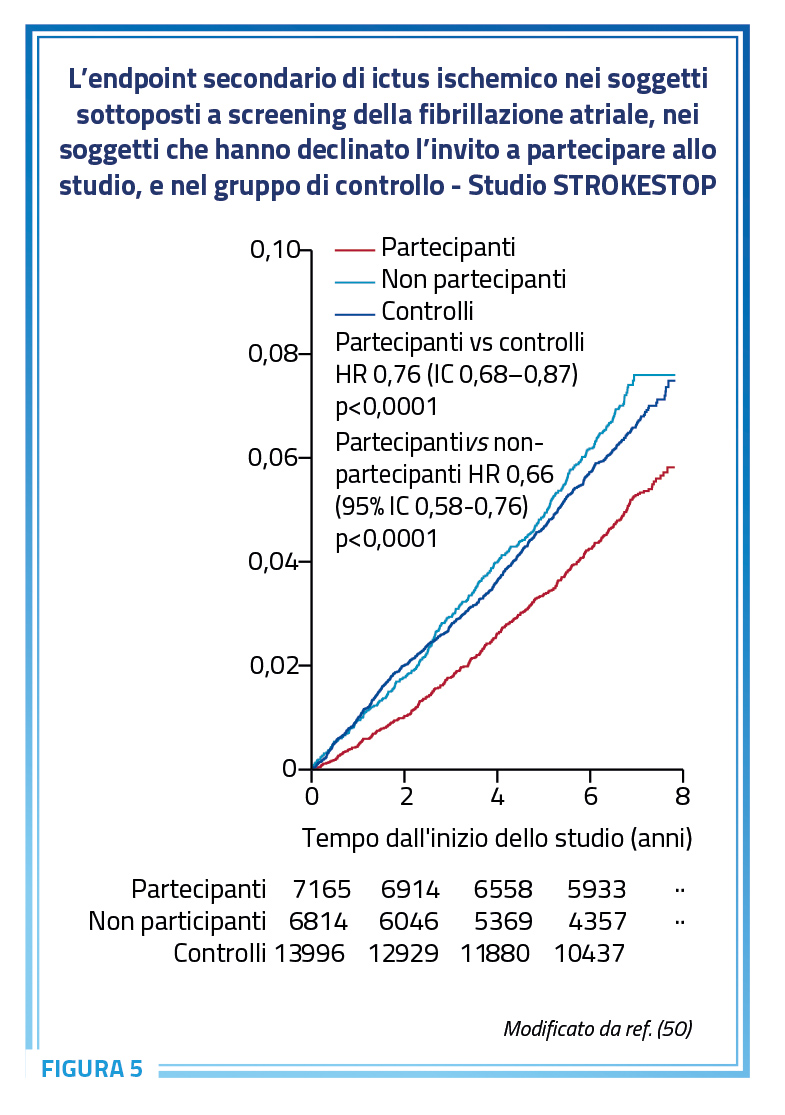
A tale riguardo, appaiono particolarmente interessanti i risultati dello studio randomizzato prospettico STROKESTOP, che mostrano per la prima volta un beneficio clinico associato a uno screening sistematico per la fibrillazione atriale in soggetti anziani asintomatici (50). Lo studio ha arruolato soggetti di 75-76 anni provenienti dalle contee di Stoccolma (n=23.888) e Halland (n=4.880) in Svezia. Il programma di screening prevedeva l’utilizzo a domicilio di un sistema ECG a singola derivazione 2 volte al giorno per un periodo di 2 settimane. In caso di riscontro di fibrillazione atriale i pazienti venivano inclusi in un programma di visite di follow-up e indirizzati a una terapia con anticoagulanti orali. L’endpoint primario era un composito di ictus ischemico o emorragico, tromboembolismo sistemico, sanguinamenti maggiori per cui si è reso necessario un ricovero o morte per tutte le cause. I risultati del follow-up a 7 anni hanno messo in evidenza nell’analisi intention-to-treat una riduzione del 4% della probabilità di incorrere nell’endpoint composito nel gruppo sottoposto a screening (p=0,045) rispetto al gruppo di controllo, per un numero di persone da invitare per lo screening pari a 91 (per evitare ogni singolo evento è necessario sottoporre a screening 91 persone) (Figura 4) (50).
Non meno interessanti i dati dell’analisi per-protocol che ha dimostrato l’evidenziazione di una fibrillazione atriale misconosciuta nel 5% dei partecipanti ed una riduzione del 24% dell’endpoint primario composito (p<0,001) al follow-up, guidata da un numero significativamente inferiore di ictus ischemici (p<0,001). I risultati dello studio STROKESTOP forniscono la dimostrazione di un beneficio clinico netto dello screening della fibrillazione atriale con la registrazione ECG domiciliare in soggetti anziani. Non appare inutile sottolineare la consistente differenza in termini di riduzione dell’outcome primario includendo nell’analisi anche i soggetti che avevano declinato l’invito a partecipare. Questi soggetti, infatti, hanno presentato un numero di eventi superiore a quanto osservato nei soggetti che avevano effettivamente partecipato allo studio, dato suggestivo di condizioni generali probabilmente peggiori (Figura 5) (50).
La significatività di quanto emerso dall’analisi più conservativa dei dati dimostra comunque un beneficio clinico netto della procedura di screening della fibrillazione atriale asintomatica.
Conclusioni
Lo screening della fibrillazione atriale rappresenta una tematica clinica di indiscutibile rilevanza. L’attuale disponibilità di moderni dispositivi che consentono di derivare, interfacciandosi con una App dedicata, una registrazione elettrocardiografica di 1 o più derivazioni della durata di 30 secondi, nel rispetto di quanto raccomandato dalle linee guida, rappresenta un importante passo in avanti nello screening di quella quota sommersa di fibrillazione atriale responsabile di una proporzione rilevante di eventi embolici a livello cerebrale e sistemico, soprattutto nei soggetti maggiormente a rischio quali gli anziani. Questi dispositivi, semplici da usare e di dimensioni contenute, rappresentano una preziosa opportunità per estendere con semplicità lo screening della fibrillazione atriale ad ampie fasce di popolazione, come i pazienti geriatrici o, più in generale, i soggetti ad aumentato rischio cardiovascolare tra i quali la fibrillazione atriale misconosciuta è una problematica assai frequente e condiziona ricadute cliniche spesso particolarmente rilevanti.
Bibliografia
- Chugh SS, et al. Worldwide epidemiology of atrial fibrillation: a Global Burden of Disease 2010 study. Circulation 2014;129:837–47.
- Dai H, et al. Global, regional, and national prevalence, incidence, mortality, and risk factors for atrial fibrillation, 1990–2017: results from the Global Burden of Disease Study 2017. Eur Heart J Qual Care Clin Outcomes 2021;7:574–82.
- Smyth B, et al. Opportunistic screening for atrial fibrillation in a rural area. QJM 2016;109:539–43.
- Weng L-C, et al. Genetic predisposition, clinical risk factor burden, and lifetime risk of atrial fibrillation. Circulation 2018;137:1027–38.
- Zoni-Berisso M, et al. Epidemiology of atrial fibrillation: European perspective. Clin Epidemiol 2014;6:213–20.
- Kirchhof P, et al. Comprehensive risk reduction in patients with atrial fibrillation: emerging diagnostic and therapeutic options. Executive summary of the report from the 3rd AFNET/EHRA consensus conference. Thromb Haemost. 2011;106:1012–1019.
- McIntyre WF, Healey J. Stroke prevention for patients with atrial fibrillation: beyond the guidelines. J Atr Fibrillation. 2017;9:1475. doi: 10.4022/jafib.147
- Chugh SS, et al. Global burden of atrial fibrillation in developed and developing nations. Glob Heart. 2014;9:113–119.
- Kirchhof P, et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur J Cardiothorac Surg. 2016;50:e1–e88.
- Hindricks G, et al; ESC Scientific Document Group. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J. 2021 Feb 1;42(5):373-498.
- Ha JT, et al. Benefits and harms of oral anticoagulant therapy in chronic kidney disease: a systematic review and meta-analysis. Ann Intern Med 2019;171:181-189.
- Lip GYH, et al. Hypertension and cardiac arrhythmias: a consensus document from the European Heart Rhythm Association (EHRA) and ESC Council on Hypertension, endorsed by the Heart Rhythm Society (HRS), Asia-Pacific Heart Rhythm Society (APHRS) and Sociedad Latinoamericana de Estimulacion Cardiaca y Electrofisiologia (SOLEACE). Europace 2017;19:891 911.
- Dzeshka MS, et al. Atrial fibrillation and hypertension. Hypertension 2017;70:854-861.
- Pokorney SD. RENal hemodialysis patients ALlocated apixaban versus warfarin in Atrial Fibrillation (RENAL-AF). Presentation at the American Heart Association Annual Scientific Sessions (AHA 2019), Philadelphia, PA, 16 November 2019.
- Violi F, et al. ARAPACIS Study Investigators. Prevalence of peripheral artery disease by abnormal ankle-brachial index in atrial fibrillation: implications for risk and therapy. J Am Coll Cardiol 2013;62:2255-2256.
- Movahed MR, et al. Diabetes mellitus is a strong, independent risk for atrial fibrillation and flutter in addition to other cardiovascular disease. Int J Cardiol 2005;105:315-318.
- Lee SR, et al. Evaluation of the association between diabetic retinopathy and the incidence of atrial fibrillation: a nationwide population-based study. Int J Cardiol 2016;223:953-957.
- Wang TJ, et al. Obesity and the risk of new-onset atrial fibrillation. JAMA 2004;292:2471-2477.
- Du X, et al. Risks of cardiovascular events and effects of routine blood pressure lowering among patients with type 2 diabetes and atrial fibrillation: results of the ADVANCE study. Eur Heart J 2009;30:1128 1135.
- Pallisgaard JL, et al. Risk of atrial fibrillation in diabetes mellitus: a nationwide cohort study. Eur J Prev Cardiol 2016;23:621-627.
- Rizzo MR, et al. Autonomic dysfunction is associated with brief episodes of atrial fibrillation in type 2 diabetes. J Diabetes Complications 2015;29:88-92.
- Javed S et al. Obesity and atrial fibrillation: making inroads through fat. Eur Heart J Cardiovasc Pharmacother 2021 Jan 16;7(1):59-67.
- Tedrow UB, et al. The long- and short-term impact of elevated body mass index on the risk of new atrial fibrillation the WHS (Women’s Health Study). J Am Coll Cardiol 2010;55:2319–2327.
- Echahidi N, et al. Obesity and metabolic syndrome are independent risk factors for atrial fibrillation after coronary artery bypass graft surgery. Circulation 2007;116:I213–I219.
- Wang TJ, et al. Obesity and the risk of new-onset atrial fibrillation. JAMA 2004;292:2471–2477.
- Morin DP, et al. The state of the art: atrial fibrillation epidemiology, prevention, and treatment. Mayo Clin Proc 2016;91:1778–1810.
- Huxley RR, et al. Absolute and attributable risks of atrial fibrillation in relation to optimal and borderline risk factors: the Atherosclerosis Risk in Communities (ARIC) study. Circulation 2011;123:1501–1508.
- Frost L, et al. Overweight and obesity as risk factors for atrial fibrillation or flutter: the Danish Diet, Cancer, and Health Study. Am J Med 2005;118:489–495.
- Tsang TS, et al. Obesity as a risk factor for the progression of paroxysmal to permanent atrial fibrillation: a longitudinal cohort study of 21 years. Eur Heart J 2008;29:2227–2233.
- Foy AJ, et al. Relation of obesity to new-onset atrial fibrillation and atrial flutter in adults. Am J Cardiol 2018;121:1072–1075.
- Karasoy D, et al. Obesity is a risk factor for atrial fibrillation among fertile young women: a nationwide cohort study. Europace 2013;15:781–786.
- Szekely P. Systemic embolism and anticoagulant prophylaxis in rheumatic heart disease. Br Med J 1964;1:1209-1212.
- Philippart R, et al. Oral anticoagulation, stroke and thromboembolism in patients with atrial fibrillation and valve bioprosthesis. The Loire Valley Atrial Fibrillation Project. Thromb Haemost 2016;115:1056-1063.
- Konecny T, et al. Relation of chronic obstructive pulmonary disease to atrial and ventricular arrhythmias. Am J Cardiol 2014;114:272–277.
- Liao KM, et al. Incidence and risk factors of atrial fibrillation in Asian COPD patients. Int J Chron Obstruct Pulmon Dis. 2017 Aug 23;12:2523-2530.
- Chen X, et al. The progression in atrial fibrillation patients with COPD: a systematic review and meta-analysis. Oncotarget. 2017 Oct 26;8(60):102420-102427.
- Simons SO, et al. Chronic obstructive pulmonary disease and atrial fibrillation: an interdisciplinary perspective. Eur Heart J. 2021 Feb 1;42(5):532-540.
- Zimmerman D, et al. Systematic review and meta-analysis of incidence, prevalence and outcomes of atrial fibrillation in patients on dialysis. Nephrol Dial Transplant 2012;27:3816-3822.
- Wetmore JB, et al. The prevalence of and factors associated with chronic atrial fibrillation in Medicare/Medicaid-eligible dialysis patients. Kidney Int 2012;81:469–76.
- Marchionni N, , et al. Percorso clinico decisionale nel paziente anziano fragile con fibrillazione atriale: la proposta di un gruppo di lavoro multidisciplinare. G Ital Cardiol (Rome). 2021 Feb;22(2 Suppl 1):e3-e27.
- Volgman AS, et al. Management of Atrial Fibrillation in Patients 75 Years and Older: JACC State-of-the-Art Review. J Am Coll Cardiol. 2022 Jan 18;79(2):166-179. doi: 10.1016/j.jacc.2021.10.037.
- Magnussen C, et al. Sex differences and similarities in atrial fibrillation epidemiology, risk factors, and mortality in community cohorts: results from the BiomarCaRE Consortium (Biomarker for Cardiovascular Risk Assessment in Europe). Circulation 2017;136:1588-97.
- January CT, Wann LS, Calkins H, et al. 2019 AHA/ACC/HRS focused update of the 2014 AHA/ ACC/HRS Guideline for the Management of Patients With Atrial Fibrillation: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm. Society. J Am Coll Cardiol. 2019;74:104–132.
- How to use digital devices to detect and manage arrhythmias: an EHRA practical guide. E. Svennberg et al. April 2022.
- Lowres N, et al. Feasibility and cost-effectiveness of stroke prevention through community screening for atrial fibrillation using iPhone ECG in pharmacies. The SEARCH-AF study. Thromb Haemost 2014;111:1167–1176.
- Orchard J, et al. eHealth tools to provide structured assistance for atrial fibrillation screening, management, and guideline-recommended therapy in metropolitan general practice: the AF—SMART study. J Am Heart Assoc 2019;8: e010959.
- Godin R, et al. Screening for atrial fibrillation using a mobile, single-lead electrocardiogram in Canadian Primary Care Clinics. Can J Cardiol 2019;35:840–845.
- Gladstone DJ, Wachter M, Schmalstieg-Bahr K, et al. Screening for Atrial Fibrillation in the Older Population. A Randomized Clinical Trial. JAMA Cardiology 2021; doi:10.1001/jamacardio.2021.0038.
- Sandhu RK, Albert C. Screening the Older Population for Atrial Fibrillation—Have We Moved the Needle Forward? JAMA Cardiology 2021; doi:10.1001/jamacardio.2021.0052
- Svennberg E, Friberg L, Frykman V, Al-Khalili F, Engdahl J, Rosenqvist M. Clinical outcomes in systematic screening for atrial fibrillation (STROKESTOP): a multicentre, parallel group, unmasked, randomised controlled trial. Lancet. 2021 Oct 23;398(10310):1498-1506. doi: 10.1016/S0140-6736(21)01637-8. Epub 2021 Aug 29. PMID: 34469764.
Related papers
La pubblicazione recente di alcuni lavori scientifici basati sulle risultanze di alcuni osservatori epidemiologi mondiali, ha riportato alla ribalta il ruolo chiave delle malattie cardiovascolari come prima causa di morte e disabilità, non solo nel presente, ma anche nel futuro proiettato oggi al 2050 con un incremento più o meno equamente distribuito tra le malattie [more info]
1) Lipoproteine ed aterosclerosi Le lipoproteine sono particelle composte da un nucleo ricco in esteri del colesterolo e trigliceridi (TG) circondati da colesterolo libero, fosfolipidi e apolipoproteine. Le lipoproteine plasmatiche vengono suddivise in varie classi (VLDL, IDL, LDL, HDL e chilomicroni) in base alle dimensioni, alla composizione lipidica e alle apolipoproteine presenti (Tabella 1). I [more info]
Introduzione Le malattie cardiovascolari rappresentano la principale causa di morbilità e mortalità a livello globale, nonostante i progressi nella prevenzione e nel trattamento farmacologico. In questo contesto, l’adozione di strategie terapeutiche efficaci per la gestione dei fattori di rischio cardiovascolare è fondamentale. La combinazione farmacologica di farmaci con meccanismi d’azione complementari è diventata una pratica [more info]