Abstract
Il prediabete rappresenta un rischio significativo per lo sviluppo di diabete mellito di tipo 2 e malattie cardiovascolari, con una prevalenza in crescita tra i giovani e gli adulti, soprattutto se obesi. Questo studio osservazionale multicentrico ha valutato l’efficacia di un nutraceutico a base di Ilex paraguarensis, Morus alba e cromo picolinato (Glicoset®) nel migliorare lo stato glicemico e il profilo lipidico nei pazienti con intolleranza al glucosio o alterata glicemia a digiuno. I risultati hanno dimostrato che l’uso di Glicoset® è associato a miglioramenti significativi nella glicemia a digiuno e nel profilo lipidico dopo tre e sei mesi di trattamento. È stata inoltre evidenziata una riduzione della uricemia dopo sei mesi di trattamento, sottolineando l’importanza di strategie terapeutiche integrate nel migliorare il profilo di rischio metabolico di questi pazienti. L’educazione continua dei clinici sulla gestione della disglicemia come rischio continuo, piuttosto che binario, e l’implementazione di interventi personalizzati sono cruciali per migliorare l’aderenza e ottimizzare gli esiti clinici. Questi risultati supportano l’uso di Glicoset® come parte di una strategia preventiva per ridurre il rischio di progressione verso il diabete mellito di tipo 2 e le relative complicanze cardiovascolari, migliorando la salute metabolica complessiva nei pazienti con prediabete.
Parole chiave: Disglicemia, Ilex paraguarensis, Morus alba, Cromo picolinato, Profilo glicemico, Rischio cardiometabolico
Introduzione
Il prediabete è una condizione caratterizzata da iperglicemia non diagnostica per diabete (disglicemia), associata ad un elevato rischio (>70%) di sviluppare diabete mellito di tipo 2 e malattie cardiovascolari (1,2). Dati recenti documentano anche un aumentato rischio di complicanze macro e microvascolari, associate a questa condizione (3,4). La prevalenza del prediabete è molto elevata nella popolazione occidentale, casistiche recenti degli USA indicano una prevalenza del 38% nella popolazione adulta, mentre in Europa colpisce più di un quinto della popolazione. Inoltre, questa condizione è diagnosticata sempre più spesso in giovani adulti o in adolescenti, soprattutto se obesi (5,6). In Italia è stato stimato che 2,6 milioni di persone, corrispondente al 4,3% della popolazione, soffrono di disglicemia, e che l’1,6% della popolazione soffrirebbe di diabete non ancora diagnosticato (7). Secondo l’American Diabetes Association (ADA) la diagnosi può essere posta in presenza di uno o più delle seguenti condizioni: glicemia a digiuno compresa tra 100 e 125 mg/dl (IFG); ridotta tolleranza al glucosio (IGT), definita come glicemia a due ore dal test di tolleranza al glucosio orale (OGTT), compresa tra 140 e 199 mg/dl; emoglobina glicata (HbA1c) compresa tra 39 e 47 mmol/mol (8). Va sottolineata, tuttavia, la scarsa concordanza tra la diagnosi di prediabete definito con la misurazione della glicemia o con la misurazione della HbA1c. Ad oggi, l’Organizzazione Mondiale della Sanità non ha ancora ratificato l’uso della HbA1c per la diagnosi di prediabete poiché le evidenze a supporto non sono sufficienti per dare raccomandazioni sull’interpretazione dei livelli di HbA1c < 48 mmol/mol (9).
La disglicemia si sviluppa tramite un processo fisiopatologico progressivo e persistente che inizia con una diminuzione della risposta biologica dei tessuti periferici all’insulina (10). Ciò determina un aumento della produzione epatica di glucosio (IFG), la riduzione dell’utilizzo del glucosio da parte del tessuto muscolare (IGT) e la resistenza all’azione anti-lipolitica dell’insulina negli adipociti con conseguente aumento degli acidi grassi liberi in circolo, i quali vengono utilizzati dal muscolo in via preferenziale rispetto al glucosio per produrre energia (10). Per compensare la resistenza periferica all’insulina, le b-cellule pancreatiche aumentano la produzione dell’ormone (10). Tuttavia, nel tempo, la capacità di compensazione delle b-cellule diminuisce, portando a una produzione insufficiente dello stesso. Questi meccanismi contribuiscono ad aumentare i livelli di glucosio circolante con conseguente iperglicemia. Nella prima fase di questa storia evolutiva, la perdita di risposta insulinica si manifesta principalmente come iperglicemia postprandiale, mentre i livelli di glicemia a digiuno rimangono normali (11). Sebbene il rischio associato di complicanze macrovascolari (i.e. infarto del miocardio, ictus e malattia vascolare periferica) sia già latente in questa fase, con il progressivo deterioramento delle b-cellule, anche la glicemia a digiuno inizia ad aumentare, portando ad una esacerbazione di complicanze microvascolari (i.e. retinopatia, neuropatia e nefropatia) (4). È fondamentale quindi intervenire precocemente al fine di riportare i valori di glicemia entro i limiti normali e prevenire la progressione della malattia. Evidenze recenti mostrano, tuttavia, come le complicanze cardiovascolari emergano prima che venga effettuata una diagnosi di disglicemia o diabete nelle popolazioni a rischio (12,13). Ciò denota una difficoltà nell’identificare quegli individui che potrebbero beneficiare di un approccio mirato alla normalizzazione del metabolismo glucidico e alla prevenzione del relativo rischio cardiovascolare. Secondo le linee guida ADA, la valutazione di screening dovrebbe essere svolta ogni anno nei pazienti con prediabete e ogni tre anni nelle donne con diabete gestazionale. Tuttavia, poiché l’età è di per sé un fattore di rischio, un test di screening dovrebbe essere comunque eseguito in tutti i soggetti al di sopra dei 35 anni, anche in assenza di specifici fattori di rischio (i.e. familiarità di grado I per il diabete, malattia cardiovascolare pregressa o in corso, ipertensione, ipercolesterolemia e/o ipertrigliceridemia, sindrome dell’ovaio policistico, altre condizioni cliniche associate a insulino-resistenza, IFG ≥ 100 mg/dL alla prima determinazione) (8). La valutazione di screening è fondamentale poiché la gestione dei fattori di rischio cardiovascolare ha maggior rilevanza in fase precoce. In questa fascia di individui l’intervento terapeutico si basa sulle modifiche dello stile di vita, quali lo svolgimento di regolare attività fisica aerobica di almeno 30 minuti al giorno, il mantenimento di un regime dietetico equilibrato, ricco di verdura, frutta e cereali integrali e il consumo moderato di insaccati, formaggi, dolciumi e olio d’oliva, nonché l’astensione dal consumo di superalcolici (14–16). Quando questo non è sufficiente, si può ricorrere all’uso di nutraceutici. Tuttavia, la disglicemia è una condizione biochimica asintomatica, il che rende più difficile riscontrare i benefici del trattamento rispetto a un paziente diabetico sintomatico. È dunque importante trovare nuovi indicatori di efficacia, focalizzandosi su meccanismi che vadano al di là di quelli indicati da glicemia ed emoglobina glicata e valutare gli aspetti di prevenzione cardiometabolica, compreso il profilo lipidico, il quale può essere influenzato positivamente dai cambiamenti dello stile di vita e dall’impiego di agenti nutraceutici. In questo contesto, l’intervento con un composto nutraceutico a base di Ilex paraguariensis, Morus alba e cromo picolinato, si configura come una strategia promettente, poiché associa l’azione antiossidante e di equilibrio del peso corporeo, all’effetto regolarizzante sul metabolismo dei lipidi e dei carboidrati (17–19). In questo ambito, tuttavia, esistono ancora delle lacune sia nell’identificazione dei pazienti che potrebbero beneficiare della terapia nutraceutica, che sulla compliance al trattamento proposto, nonché nel monitoraggio dei progressi del paziente.
L’obiettivo di questo studio osservazionale è stato quello di testare l’efficacia a tre e a sei mesi del nutraceutico Glicoset® nel migliorare lo stato glicemico e il profilo lipidico nei soggetti con IFG o IGT, al fine di valutare i benefici derivanti dalla terapia nutraceutica sul profilo cardiometabolico di questi pazienti.
Materiali e Metodi
Disegno dello studio e criteri di inclusione
Lo studio osservazionale, prospettico, multicentrico, in aperto è stato condotto in cinque Centri specialistici delle province di Padova, Bologna, Aosta, Seriate e Olbia. Sono stati arruolati pazienti con età ≥ 25 anni, di entrambi i sessi, con glicemia a digiuno alterata, compresa tra 100-125 mg/dl, con IFG o IGT (glicemia post-carico tra 140 e 199 mg/dl) diagnosticate tramite prelievo per glicemia a digiuno o OGTT.
Tra i criteri di esclusione rientrano: assunzione di farmaci o preparati con effetto ipoglicemizzante, diabete mellito di tipo 1 o 2, insufficienza epatica o renale, disturbi gastrointestinali, cardiopatia ischemica, insufficienza cardiaca o ictus, variazione ponderale > 3 kg durante i 3 mesi precedenti, neoplasie maligne o significativi disturbi neurologici o psichiatrici, compreso abuso di alcol o droghe.
Oltre ai dati anagrafici, sono stati raccolti, sia in fase di arruolamento (T0) che al monitoraggio di tre (T3) e sei (T6) mesi, dati clinici e strumentali, tra cui peso corporeo (Kg), indice di massa corporea (BMI) (Kg/m2), circonferenza vita (cm), glicemia a digiuno (mg/dL), emoglobina glicata (HbA1c) (mmol/mol), insulina (µU/ml), colesterolemia totale (mg/dL), HDL-C (mg/dL), LDL-C (mg/dL), non HDL-C (mg/dL), trigliceridi (mg/dL), ALT/GPT (U/L), AST/GOT (U/L), GGT (U/L), piastrine (unità/µL), emoglobina (g/dL), ematocrito (%), pressione arteriosa sistolica e diastolica (mmHg), uricemia (mg/dL) e creatinina (mg/dL).
Ai soggetti idonei, identificati sulla base del loro profilo clinico, è stato prescritto il prodotto nutraceutico Glicoset® alla dose di 1.000mg pro die, oltre che suggerimenti generali di miglioramento dello stile di vita (i.e. mantenimento di una dieta equilibrata e salutare, e di uno stile di vita attivo).
Endpoint primario dello studio è stato valutare al T3 e al T6 l’efficacia e la tollerabilità del nutraceutico sulla glicemia a digiuno. Come endpoint secondario è stato valutato invece il numero di pazienti con ritorno al valore di glicemia basale e con miglioramento dell’assetto lipidico.
È stata utilizzata la statistica descrittiva per analizzare le caratteristiche demografiche di base. Le variabili continue sono riportate tramite il numero di pazienti, la media e la deviazione standard (DS). I parametri clinici sono stati analizzati longitudinalmente utilizzando il test di Kruskal-Wallis con l’analisi post-hoc di Dunn. Tutte le analisi sono state eseguite utilizzando il linguaggio di programmazione Python tramite Jupyter Notebook all’interno del pacchetto di data science Anaconda3 per Windows. I valori di p < 0,05 sono stati considerati statisticamente significativi.
Risultati
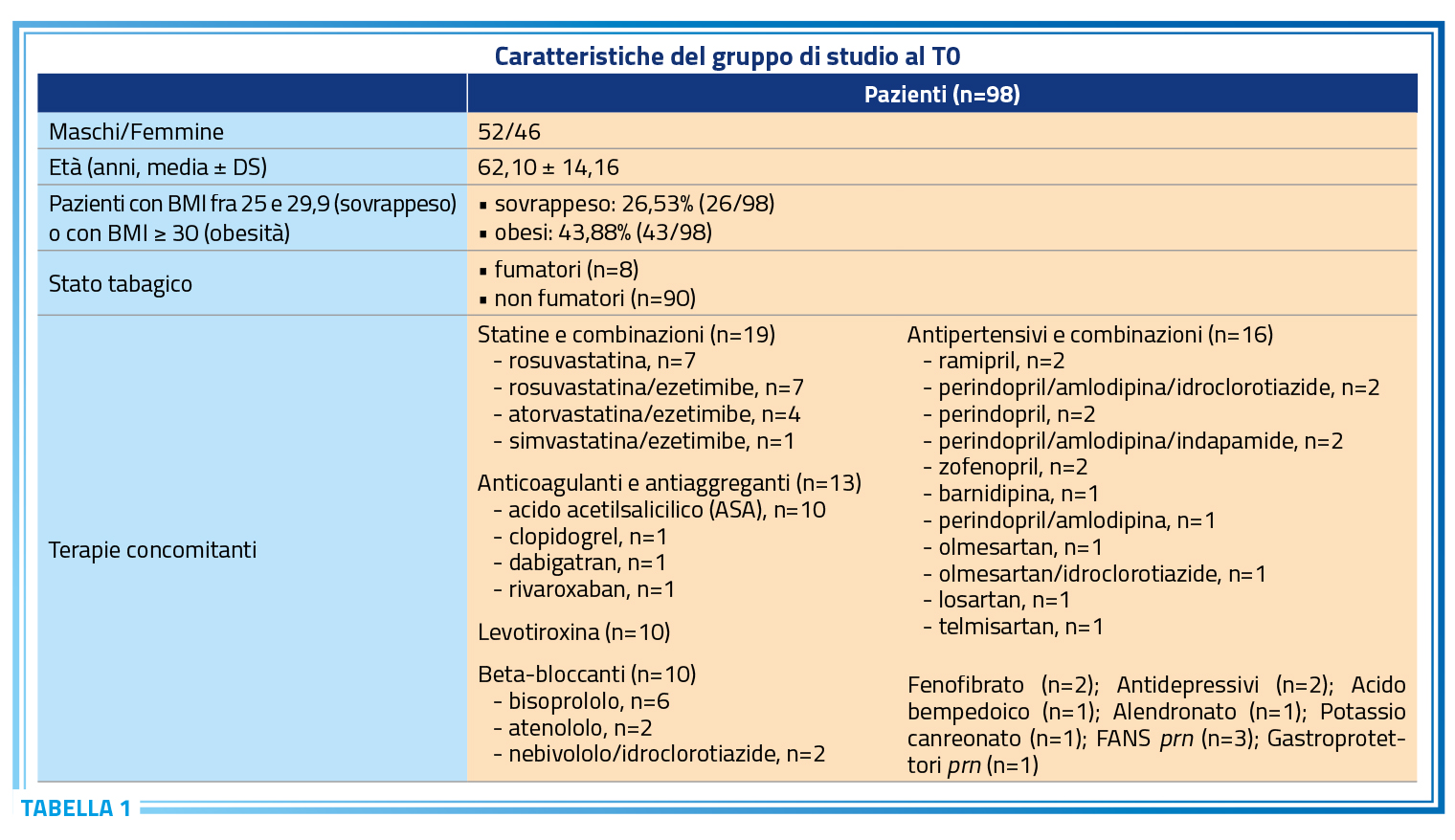
Il presente studio ha coinvolto 98 pazienti, 52 maschi e 45 femmine di età compresa tra 25 e 92 anni (età media 62,10 ± 14,16), tra cui otto fumatori. Al momento dell’arruolamento (T0), 45 su 98 partecipanti (il 46% del gruppo di studio) era già in terapia con uno o più farmaci per il controllo del loro rischio cardiometabolico (Tabella 1). Le caratteristiche del gruppo di studio al momento dell’arruolamento sono mostrate nella Tabella 1. Fra T0 e T3 e fra T3 e T6 nessun paziente ha iniziato o sospeso un trattamento ipolipemizzante e il dosaggio delle statine già assunte al basale è rimasto invariato. Durante tutto il periodo di monitoraggio, non sono stati segnalati eventi avversi all’utilizzo del prodotto.
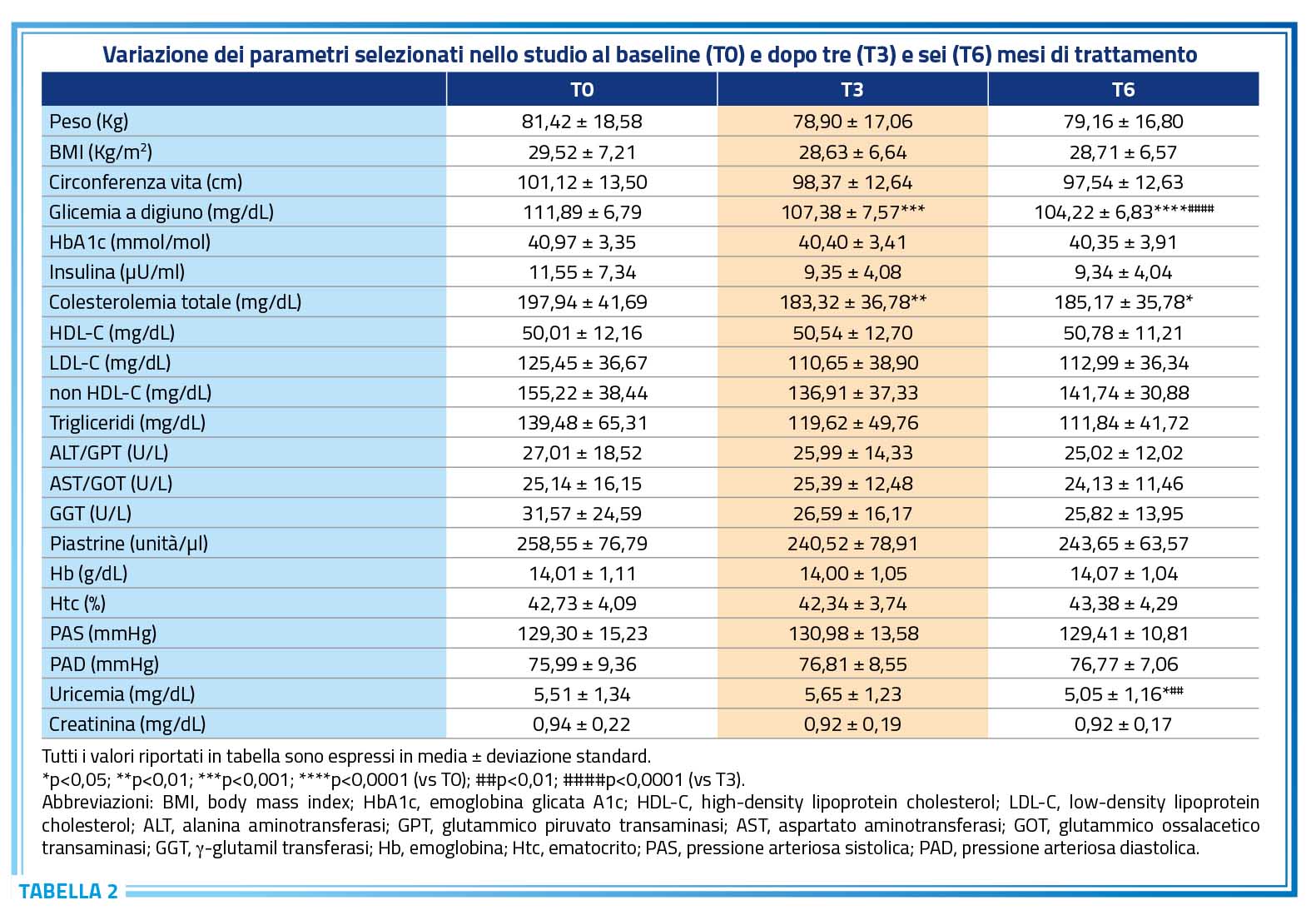
Nel periodo di studio, nonostante non sia stata osservata una riduzione significativa del peso e del BMI, è emerso un trend di riduzione della circonferenza vita (p=0,09). Quest’ultima è diminuita da 101,12 ± 13,50 cm al T0 a 98,37 ± 12,64 cm dopo 3 mesi e a 97,54 ± 12,63 cm dopo 6 mesi di trattamento (Tabella 2).
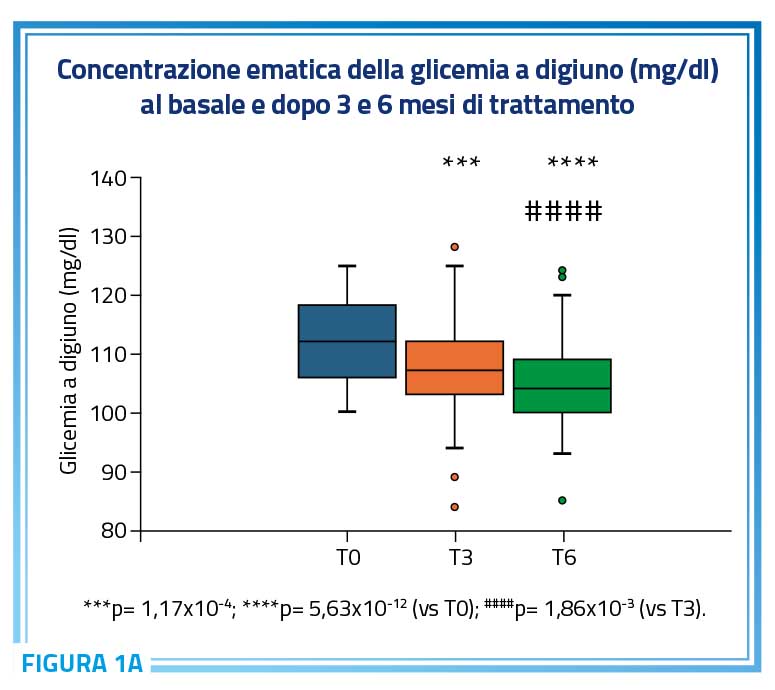
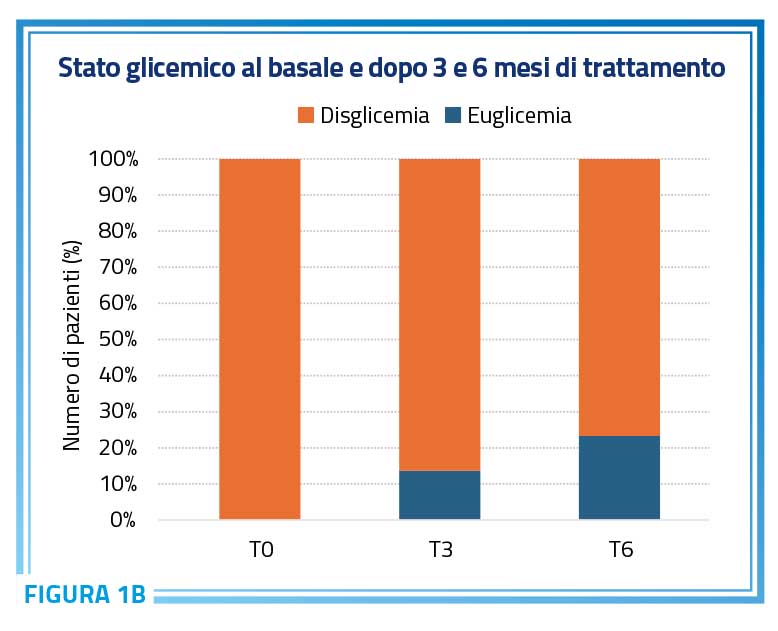
Tutti i partecipanti allo studio presentavano al momento dell’arruolamento un valore alterato di glicemia a digiuno, compreso tra 100 e 125 mg/dl. Dopo 3 mesi di trattamento, il valore medio della glicemia a digiuno è diminuito significativamente da 111,89 ± 6,79 mg/dL a 107,38 ± 7,57 mg/dL (p < 0,0001). Questa riduzione è rimasta persistente e significativa rispetto al baseline e ai valori registrati a 3 mesi, con il valore medio della glicemia a digiuno che ha raggiunto 104,22 ± 6,83 mg/dL dopo 6 mesi di trattamento (p < 0,0001) (Figura 1a). Di particolare interesse è l’osservazione che, dopo soli 3 mesi di trattamento con il nutraceutico, il 15% dei pazienti valutati (n = 13) è passato dallo stato di IFG a una condizione euglicemica. Questa percentuale è aumentata al 20% (n = 20) dopo 6 mesi di trattamento (Figura 1b).
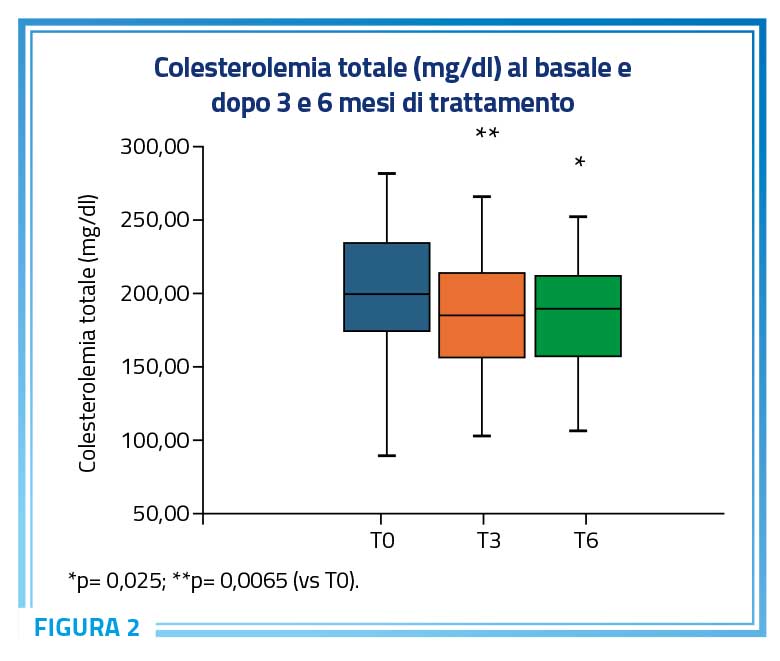
Per quanto riguarda il profilo lipidico dei pazienti, è stata osservata una significativa riduzione della colesterolemia totale durante il periodo di studio. Dopo 3 mesi di trattamento, l’81% dei pazienti (n=75) ha mostrato una riduzione della colesterolemia totale, passando da 197,94 ± 41,69 mg/dL a 183,32 ± 36,78 mg/dL (p < 0,01) (Figura 2). Questa diminuzione rispetto ai valori al T0 è rimasta significativa anche al termine dello studio (p < 0,05) (Figura 2); inoltre, circa il 50% dei pazienti valutati (n=47) ha evidenziato un ulteriore abbassamento della colesterolemia totale rispetto al valore a 3 mesi. È stato anche osservato un trend di riduzione (p = 0,09) della concentrazione ematica di colesterolo LDL, che è passata da 125,45 ± 36,67 mg/dL a 110,65 ± 38,90 mg/dL dopo 3 mesi di trattamento e ha mantenuto un valore costante dopo ulteriori 3 mesi di follow-up (Tabella 2).
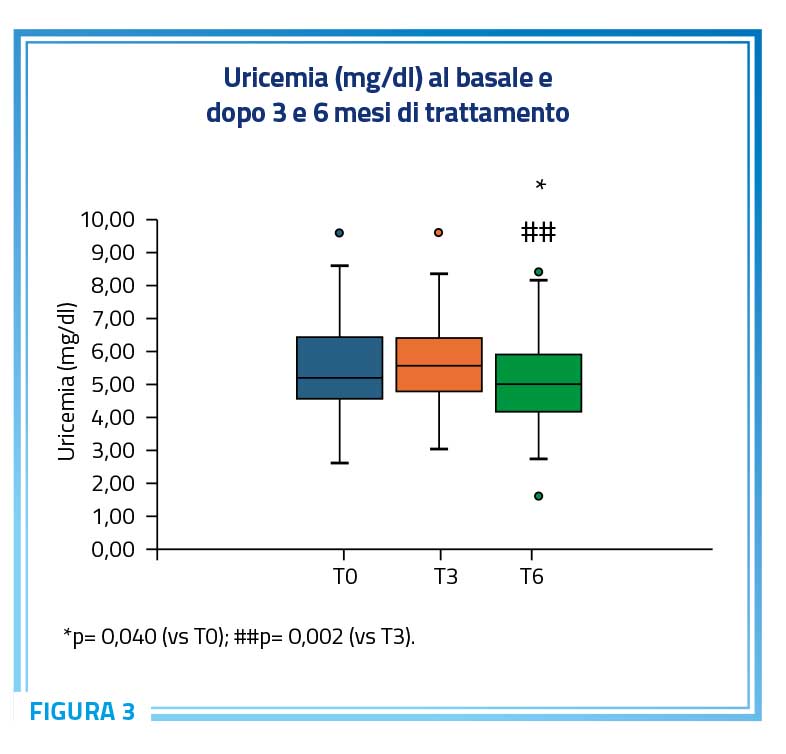
Nel presente studio, un altro importante parametro biochimico valutato per determinare il rischio metabolico dei pazienti con disglicemia è stato la concentrazione di acido urico nel sangue. Il valore medio di uricemia al T0 e al monitoraggio di 3 mesi era rispettivamente di 5,51 ± 1,34 mg/dL e di 5,65 ± 1,23 mg/dL, con circa il 17% (n = 17) dei partecipanti che presentava iperuricemia (valore di uricemia > 6,8 o > 7 mg/dL) (20) in entrambi i timepoint. Dopo 6 mesi di trattamento, è stata osservata una riduzione significativa dell’uricemia rispetto ai valori al T0 e ai livelli misurati a 3 mesi (p < 0,05) (Figura 3). Inoltre, al termine dello studio la percentuale di individui con iperuricemia è diminuita a meno del 10% (n = 8).
Discussione
Questo studio osservazionale fornisce una nuova prospettiva sull’applicazione nel mondo reale del prodotto nutraceutico Glicoset® in pazienti con IFG, mettendo in luce la sua efficacia nella normalizzazione dei parametri metabolici. Nel presente studio condotto in 98 pazienti di entrambi i sessi, con un’età media di 62 anni, il trattamento con il nutraceutico ha dimostrato un effetto positivo sulla glicemia a digiuno, la cui concentrazione ematica è risultata significativamente ridotta dopo 3 mesi di trattamento. Questa riduzione è risultata significativa anche al follow-up di 6 mesi. Inoltre, il nutraceutico ha dimostrato una notevole efficacia nel migliorare lo stato glicemico dei pazienti nel tempo. Dopo 3 mesi di trattamento, il 15% dei partecipanti ha raggiunto uno stato di euglicemia, percentuale che è aumentata al 20% dopo 6 mesi di assunzione.
Questi risultati sono in linea con le evidenze derivanti da un trial clinico randomizzato e controllato con placebo condotto da Derosa e colleghi nel 2021, che aveva lo scopo di valutare se la somministrazione di tre mesi del nutraceutico migliorasse lo stato glicemico in 148 pazienti adulti disglicemici non trattati con farmaci ipoglicemizzanti (19). Gli autori hanno dimostrato che l’utilizzo di Glicoset® in questa popolazione ha portato ad una riduzione significativa della glicemia a digiuno, postprandiale e dell’HbA1c rispetto al baseline e al placebo e che il 25% dei soggetti in trattamento è tornato ad uno stato euglicemico (19).
Nel presente studio il miglioramento del profilo glicemico è stato accompagnato anche da una riduzione significativa della colesterolemia totale e da un trend di riduzione del colesterolo LDL al follow-up di 3 mesi. Allo stesso modo un recente studio osservazionale multicentrico che ha arruolato 63 individui con IFG, ha mostrato un miglioramento dello stato glicemico e lipidico dei partecipanti, con una riduzione significativa del peso corporeo a seguito di 3 mesi di supplementazione con Glicoset® (21). Questi risultati non sorprendono in quanto è stato precedentemente dimostrato che il consumo dell’estratto di foglie standardizzato di Ilex paraguariensis (contenente 2% di I-deossinojirimcina (DNJ)) migliora il profilo glicemico in pazienti con diabete mellito di tipo 2 in trattamento con ipoglicemizzanti orali (22). Inoltre, il consumo di foglie di Morus alba (comunemente conosciuto come gelso bianco), una pianta multifunzionale contenente numerosi costituenti bioattivi come DNJ, fenoli e flavonoidi, si è dimostrato efficace nel ridurre i valori di glucosio plasmatico a digiuno e di HbA1c in pazienti con diabete mellito di tipo 2 non controllato (23). Infine, il cromo picolinato, un importante cofattore nel metabolismo dell’insulina, promuove la fosforilazione dei recettori dell’insulina nelle cellule target quali cellule muscolari, epatociti e adipociti, migliorando la tolleranza al glucosio (24). Una recente revisione ha riportato che la supplementazione con cromo picolinato è efficace nel prevenire o ritardare l’insorgenza del diabete di tipo 2, riducendo l’iperglicemia, i livelli di colesterolo totale e trigliceridi, il peso corporeo e la massa grassa (25). L’utilizzo dei nutraceutici si è dimostrato efficace nel migliorare il profilo lipidico, favorendo al contempo la riduzione del peso corporeo anche in soggetti normolipidemici, dislipidemici e ipercolesterolemici (26,27). Nel presente studio, non è stata osservata una riduzione significativa del peso corporeo e del BMI, probabilmente a causa della mancata associazione della supplementazione con il nutraceutico a un regime alimentare e un piano di attività fisica standardizzati. Tuttavia, la riduzione della circonferenza vita e dei parametrici biochimici, quali glicemia plasmatica a digiuno, colesterolemia e LDL-C, indica l’efficacia del prodotto nel migliorare il profilo metabolico dei pazienti. Un monitoraggio di soli 3 mesi non consente tuttavia una valutazione degli effetti a medio e lungo termine del trattamento nutraceutico.
Il presente lavoro mostra che gli effetti della supplementazione sul profilo glicemico e lipidico già presenti a 3 mesi sono stati mantenuti anche dopo 6 mesi di trattamento. Non appare inutile sottolineare che circa il 50% dei pazienti ha mostrato ulteriori miglioramenti della colesterolemia totale rispetto ai valori a 3 mesi, indicando che il trattamento prolungato può avere effetti benefici aggiuntivi. Simili risultati sono stati descritti da Derosa e colleghi in uno studio di follow-up condotto nel 2023 in 186 pazienti adulti con disglicemia, randomizzati in un gruppo di trattamento (dieta + Glicoset® 1000) e in un gruppo di controllo (28). Al termine dello studio, gli autori hanno mostrato come la supplementazione di 12 mesi con il prodotto nutraceutico abbia migliorato il profilo glicemico e lipidico dei pazienti, portando ad una riduzione significativa della glicemia a digiuno e postprandiale, dell’HbA1c e dell’Homa-IR, oltre che dei livelli di colesterolo totale, LDL-C e trigliceridi (28).
È interessante notare, inoltre, come 6 mesi di trattamento abbiano portato ad una significativa riduzione della uricemia e del numero di pazienti con iperuricemia rispetto ai timepoint precedenti. L’iperuricemia è considerata un marker di rischio metabolico per la sua capacità di ridurre i livelli di ossido nitrico, favorendo così la disfunzione endoteliale (29). Inoltre, la prevalenza della sindrome metabolica aumenta proporzionalmente con l’aumentare dei livelli di uricemia (30). Sebbene i meccanismi alla base di questa correlazione non siano ancora del tutto chiariti, è noto che i livelli sierici di acido urico siano associati ai valori di glicemia nella popolazione sana. È stato stimato che ogni aumento di 1 mg/dL di acido urico corrisponde a un aumento del 17% del rischio di sviluppare diabete di tipo 2 (31). Inoltre, i risultati di uno studio osservazionale di coorte, hanno mostrato l’associazione tra i livelli di acido urico e la morbilità cardiovascolare, anche dopo correzione per la funzionalità renale dei pazienti (32). È possibile ipotizzare che la riduzione della glicemia, con il conseguente miglioramento della sensibilità all’insulina, insieme al miglioramento del profilo lipidico e all’azione antiossidante e antinfiammatoria delle componenti del nutraceutico Glicoset®, già validate clinicamente (19,22,23,25,27,33), possano contribuire alla riduzione dell’uricemia nei pazienti in trattamento. In questo contesto, l’impatto metabolico significativo sulla concentrazione plasmatica di acido urico si manifesta successivamente alla riduzione dei parametri glicemici e lipidici, suggerendo che un trattamento a medio-lungo termine può avere un effetto additivo nel ridurre il rischio cardiometabolico dei pazienti.
Il presente studio non è esente da alcune limitazioni. Essendo un’indagine osservazionale, la mancanza di un gruppo di controllo randomizzato limita la certezza nell’attribuire gli effetti osservati esclusivamente al trattamento con il nutraceutico. Un gruppo di studio più ampio e una valutazione più approfondita dei fattori confondenti potrebbero rafforzare ulteriormente i risultati. Tuttavia, i dati raccolti confermano le evidenze preesistenti sull’efficacia di Glicoset® nel migliorare il profilo metabolico dei pazienti con disglicemia non trattati con ipoglicemizzanti. Inoltre, questo studio è il primo a evidenziare un effetto positivo del nutraceutico sulla concentrazione di acido urico nel sangue. Per consolidare queste evidenze e comprendere meglio l’efficacia a lungo termine di Glicoset®, sono necessari futuri studi con un disegno più rigoroso e un follow-up a lungo termine.
Conclusioni
In conclusione, la disglicemia è ancora un fattore di rischio sottostimato nella pratica clinica quotidiana ed è essenziale educare i clinici a considerare l’aumento della glicemia come un fattore di rischio continuo, piuttosto che binario (presente/assente) (34). Ne risulta che lo screening di routine del metabolismo glicemico può giocare un ruolo cruciale nell’identificare individui a rischio prima che si manifestino eventi cardiovascolari. L’implementazione di un programma pratico di suggerimenti sulla dieta e lo stile di vita è fondamentale per supportare i pazienti nel raggiungimento degli obiettivi metabolici raccomandati. Il miglioramento del controllo glicemico assume in quest’ottica un’importanza centrale, poiché anche una modesta riduzione dei livelli di glucosio può significativamente ridurre il rischio di sviluppare diabete mellito di tipo 2 e complicanze cardiovascolari. Questo studio evidenzia che il trattamento nutraceutico a medio-lungo termine, come dimostrato dall’uso di Glicoset®, può giocare un ruolo significativo nel migliorare il profilo metabolico dei pazienti e contemporaneamente ridurre il loro rischio cardiovascolare. Comprendere i determinanti dell’aderenza del paziente alla terapia è cruciale, così come generare motivazione per personalizzare l’intervento medico in modo da soddisfare le esigenze specifiche del paziente e massimizzare l’efficacia del trattamento.
Bibliografia
- Tabák AG, Herder C, Rathmann W, Brunner EJ, Kivimäki M. Prediabetes: a high-risk state for diabetes development. The Lancet. 2012 Jun;379(9833):2279–90.
- Cai X, Zhang Y, Li M, Wu JH, Mai L, Li J, et al. Association between prediabetes and risk of all cause mortality and cardiovascular disease: updated meta-analysis. BMJ. 2020 Jul 15;m2297.
- Brannick B, Wynn A, Dagogo-Jack S. Prediabetes as a toxic environment for the initiation of microvascular and macrovascular complications. Exp Biol Med. 2016 Jun 14;241(12):1323–31.
- Lamprou S, Koletsos N, Mintziori G, Anyfanti P, Trakatelli C, Kotsis V, et al. Microvascular and Endothelial Dysfunction in Prediabetes. Life. 2023 Feb 25;13(3):644.
- Menke A, Casagrande S, Geiss L, Cowie CC. Prevalence of and Trends in Diabetes Among Adults in the United States, 1988-2012. JAMA. 2015 Sep 8;314(10):1021.
- Shu Y, Wu X, Wang J, Ma X, Li H, Xiang Y. Associations of Dietary Inflammatory Index With Prediabetes and Insulin Resistance. Front Endocrinol (Lausanne). 2022 Feb 17;13.
- Istituto Nazionale di Statistica (Istat). Il diabete in Italia [Internet]. 2017 Jul [cited 2024 Jun 21]. Available from: https://www.istat.it/it/archivio/202600
- American Diabetes Association Professional Practice Committee. 2. Classification and Diagnosis of Diabetes: Standards of Medical Care in Diabetes-2022. Diabetes Care. 2022 Jan 1;45(Suppl 1):S17–38.
- International Expert Committee. International Expert Committee Report on the role of A1c assay in the diagnosis of Diabetes. Diabetes Care 32: 1327-1334, 2009.
- Ferrannini E, Gastaldelli A, Iozzo P. Pathophysiology of Prediabetes. Medical Clinics of North America. 2011 Mar;95(2):327–39.
- Walker M, Mari A, Jayapaul MK, Bennett SMA, Ferrannini E. Impaired beta cell glucose sensitivity and whole-body insulin sensitivity as predictors of hyperglycaemia in non-diabetic subjects. Diabetologia. 2005 Dec 1;48(12):2470–6.
- Cosic V, Jakab J, Pravecek M, Miskic B. The Importance of Prediabetes Screening in the Prevention of Cardiovascular Disease. Medical Archives. 2023;77(2):97.
- Ghany R, Tamariz L, Chen G, Dawkins E, Forbes E, Tajiri T, et al. Impact of Prediabetes on Cardiac Function Among Primary Care Patients. Metab Syndr Relat Disord. 2023 Aug 1;21(6):314–8.
- Chen Y, Chen Z, Pan L, Ma ZM, Zhang H, Li XJ, et al. Effect of Moderate and Vigorous Aerobic Exercise on Incident Diabetes in Adults With Obesity. JAMA Intern Med. 2023 Mar 1;183(3):272.
- Gorodeski Baskin R, Alfakara D. Root Cause for Metabolic Syndrome and Type 2 Diabetes. Endocrinol Metab Clin North Am. 2023 Mar;52(1):13–25.
- Cao Z, Li W, Wen CP, Li S, Chen C, Jia Q, et al. Risk of Death Associated With Reversion From Prediabetes to Normoglycemia and the Role of Modifiable Risk Factors. JAMA Netw Open. 2023 Mar 28;6(3):e234989.
- Broadhurst CL, Domenico P. Clinical Studies on Chromium Picolinate Supplementation in Diabetes Mellitus—A Review. Diabetes Technol Ther. 2006 Dec;8(6):677–87.
- Arçari DP, Santos JC, Gambero A, Ferraz LFC, Ribeiro ML. Modulatory effects of yerba maté (Ilex paraguariensis) on the PI3K-AKT signaling pathway. Mol Nutr Food Res. 2013 Oct;57(10):1882–5.
- Derosa G, D’Angelo A, Maffioli P. Metabolic Actions of a Supplement of Ilex Paraguariensis (An Extract of the Leaf Standardized to 2% I-Deoxinojirimcina), White Mulberry and Chromium Picolinate in Nondiabetic Subjects with Dysglycemia: A Randomized Trial. Life. 2021 Jul 18;11(7):709.
- Khanna D, Fitzgerald JD, Khanna PP, Bae S, Singh MK, Neogi T, et al. 2012 American College of Rheumatology guidelines for management of gout. Part 1: Systematic nonpharmacologic and pharmacologic therapeutic approaches to hyperuricemia. Arthritis Care Res (Hoboken). 2012 Oct 28;64(10):1431–46.
- Borsi A, Cabula R, Sangalli B, Curcu T, Massa MG, Murgia M, et al. Prevenzione dell’evoluzione da prediabete a diabete con l’uso di un nutraceutico a base di Ilex paraguariensis (Ilex L. spp. Aquifoliales), gelso bianco (Morus spp., Moraceae) e cromo picolinato. MD Digital Suppl 1/2024.
- Klein GA, Stefanuto A, Boaventura BCB, de Morais EC, Cavalcante L da S, de Andrade F, et al. Mate tea (Ilex paraguariensis) improves glycemic and lipid profiles of type 2 diabetes and pre-diabetes individuals: a pilot study. J Am Coll Nutr. 2011 Oct;30(5):320–32.
- Murata K, Yatsunami K, Fukuda E, Onodera S, Mizukami O, Hoshino G, et al. Antihyperglycemic effects of propolis mixed with mulberry leaf extract on patients with type 2 diabetes. Altern Ther Health Med. 2004;10(3):78–9.
- Anderson RA. Chromium, Glucose Intolerance and Diabetes. J Am Coll Nutr. 1998 Dec;17(6):548–55.
- Derosa G, D’Angelo A, Maffioli P. Ilex paraguariensis, white mulberry and chromium picolinate in patients with pre-diabetes. Phytother Res. 2020 Jun;34(6):1377–84.
- Andersen T, Fogh J. Weight loss and delayed gastric emptying following a South American herbal preparation in overweight patients. Journal of Human Nutrition and Dietetics. 2001 Jun 7;14(3):243–50.
- de Morais EC, Stefanuto A, Klein GA, Boaventura BCB, de Andrade F, Wazlawik E, et al. Consumption of Yerba Mate (Ilex paraguariensis) Improves Serum Lipid Parameters in Healthy Dyslipidemic Subjects and Provides an Additional LDL-Cholesterol Reduction in Individuals on Statin Therapy. J Agric Food Chem. 2009 Sep 23;57(18):8316–24.
- Derosa G, D’Angelo A, Maffioli P. Effects on Glyco-Metabolic Control after 12 Months of Treatment with a Supplement of Ilex Paraguariensis, White Mulberry and Chromium Picolinate in Non-Diabetic Patients with Dysglycemia. Journal of Food and Nutrition Research. 2023 Oct 16;11(4):319–24.
- Viazzi F, Leoncini G, Pontremoli R. Uric acid: bystander or active player in the development of cardiovascular and renal damage. Giornale di Tecniche Nefrologiche e Dialitiche. 2013;25(1):20–5.
- Lin SD, Tsai DH, Hsu SR. Association between serum uric acid level and components of the metabolic syndrome. J Chin Med Assoc. 2006 Nov;69(11):512–6.
- Kodama S, Saito K, Yachi Y, Asumi M, Sugawara A, Totsuka K, et al. Association Between Serum Uric Acid and Development of Type 2 Diabetes. Diabetes Care. 2009 Sep 1;32(9):1737–42.
- Neri L, Rocca Rey LA, Lentine KL, Hinyard LJ, Pinsky B, Xiao H, et al. Joint Association of Hyperuricemia and Reduced GFR on Cardiovascular Morbidity: A Historical Cohort Study Based on Laboratory and Claims Data From a National Insurance Provider. American Journal of Kidney Diseases. 2011 Sep;58(3):398–408.
- Thaipitakwong T, Numhom S, Aramwit P. Mulberry leaves and their potential effects against cardiometabolic risks: a review of chemical compositions, biological properties and clinical efficacy. Pharm Biol. 2018 Jan 1;56(1):109–18.
- Bloomgarden ZT. American College of Endocrinology Pre-Diabetes Consensus Conference: Part One. Diabetes Care. 2008 Oct 1;31(10):2062–9.
Abstract
Il prediabete rappresenta un rischio significativo per lo sviluppo di diabete mellito di tipo 2 e malattie cardiovascolari, con una prevalenza in crescita tra i giovani e gli adulti, soprattutto se obesi. Questo studio osservazionale multicentrico ha valutato l’efficacia di un nutraceutico a base di Ilex paraguarensis, Morus alba e cromo picolinato (Glicoset®) nel migliorare lo stato glicemico e il profilo lipidico nei pazienti con intolleranza al glucosio o alterata glicemia a digiuno. I risultati hanno dimostrato che l’uso di Glicoset® è associato a miglioramenti significativi nella glicemia a digiuno e nel profilo lipidico dopo tre e sei mesi di trattamento. È stata inoltre evidenziata una riduzione della uricemia dopo sei mesi di trattamento, sottolineando l’importanza di strategie terapeutiche integrate nel migliorare il profilo di rischio metabolico di questi pazienti. L’educazione continua dei clinici sulla gestione della disglicemia come rischio continuo, piuttosto che binario, e l’implementazione di interventi personalizzati sono cruciali per migliorare l’aderenza e ottimizzare gli esiti clinici. Questi risultati supportano l’uso di Glicoset® come parte di una strategia preventiva per ridurre il rischio di progressione verso il diabete mellito di tipo 2 e le relative complicanze cardiovascolari, migliorando la salute metabolica complessiva nei pazienti con prediabete.
Parole chiave: Disglicemia, Ilex paraguarensis, Morus alba, Cromo picolinato, Profilo glicemico, Rischio cardiometabolico
Introduzione
Il prediabete è una condizione caratterizzata da iperglicemia non diagnostica per diabete (disglicemia), associata ad un elevato rischio (>70%) di sviluppare diabete mellito di tipo 2 e malattie cardiovascolari (1,2). Dati recenti documentano anche un aumentato rischio di complicanze macro e microvascolari, associate a questa condizione (3,4). La prevalenza del prediabete è molto elevata nella popolazione occidentale, casistiche recenti degli USA indicano una prevalenza del 38% nella popolazione adulta, mentre in Europa colpisce più di un quinto della popolazione. Inoltre, questa condizione è diagnosticata sempre più spesso in giovani adulti o in adolescenti, soprattutto se obesi (5,6). In Italia è stato stimato che 2,6 milioni di persone, corrispondente al 4,3% della popolazione, soffrono di disglicemia, e che l’1,6% della popolazione soffrirebbe di diabete non ancora diagnosticato (7). Secondo l’American Diabetes Association (ADA) la diagnosi può essere posta in presenza di uno o più delle seguenti condizioni: glicemia a digiuno compresa tra 100 e 125 mg/dl (IFG); ridotta tolleranza al glucosio (IGT), definita come glicemia a due ore dal test di tolleranza al glucosio orale (OGTT), compresa tra 140 e 199 mg/dl; emoglobina glicata (HbA1c) compresa tra 39 e 47 mmol/mol (8). Va sottolineata, tuttavia, la scarsa concordanza tra la diagnosi di prediabete definito con la misurazione della glicemia o con la misurazione della HbA1c. Ad oggi, l’Organizzazione Mondiale della Sanità non ha ancora ratificato l’uso della HbA1c per la diagnosi di prediabete poiché le evidenze a supporto non sono sufficienti per dare raccomandazioni sull’interpretazione dei livelli di HbA1c < 48 mmol/mol (9).
La disglicemia si sviluppa tramite un processo fisiopatologico progressivo e persistente che inizia con una diminuzione della risposta biologica dei tessuti periferici all’insulina (10). Ciò determina un aumento della produzione epatica di glucosio (IFG), la riduzione dell’utilizzo del glucosio da parte del tessuto muscolare (IGT) e la resistenza all’azione anti-lipolitica dell’insulina negli adipociti con conseguente aumento degli acidi grassi liberi in circolo, i quali vengono utilizzati dal muscolo in via preferenziale rispetto al glucosio per produrre energia (10). Per compensare la resistenza periferica all’insulina, le b-cellule pancreatiche aumentano la produzione dell’ormone (10). Tuttavia, nel tempo, la capacità di compensazione delle b-cellule diminuisce, portando a una produzione insufficiente dello stesso. Questi meccanismi contribuiscono ad aumentare i livelli di glucosio circolante con conseguente iperglicemia. Nella prima fase di questa storia evolutiva, la perdita di risposta insulinica si manifesta principalmente come iperglicemia postprandiale, mentre i livelli di glicemia a digiuno rimangono normali (11). Sebbene il rischio associato di complicanze macrovascolari (i.e. infarto del miocardio, ictus e malattia vascolare periferica) sia già latente in questa fase, con il progressivo deterioramento delle b-cellule, anche la glicemia a digiuno inizia ad aumentare, portando ad una esacerbazione di complicanze microvascolari (i.e. retinopatia, neuropatia e nefropatia) (4). È fondamentale quindi intervenire precocemente al fine di riportare i valori di glicemia entro i limiti normali e prevenire la progressione della malattia. Evidenze recenti mostrano, tuttavia, come le complicanze cardiovascolari emergano prima che venga effettuata una diagnosi di disglicemia o diabete nelle popolazioni a rischio (12,13). Ciò denota una difficoltà nell’identificare quegli individui che potrebbero beneficiare di un approccio mirato alla normalizzazione del metabolismo glucidico e alla prevenzione del relativo rischio cardiovascolare. Secondo le linee guida ADA, la valutazione di screening dovrebbe essere svolta ogni anno nei pazienti con prediabete e ogni tre anni nelle donne con diabete gestazionale. Tuttavia, poiché l’età è di per sé un fattore di rischio, un test di screening dovrebbe essere comunque eseguito in tutti i soggetti al di sopra dei 35 anni, anche in assenza di specifici fattori di rischio (i.e. familiarità di grado I per il diabete, malattia cardiovascolare pregressa o in corso, ipertensione, ipercolesterolemia e/o ipertrigliceridemia, sindrome dell’ovaio policistico, altre condizioni cliniche associate a insulino-resistenza, IFG ≥ 100 mg/dL alla prima determinazione) (8). La valutazione di screening è fondamentale poiché la gestione dei fattori di rischio cardiovascolare ha maggior rilevanza in fase precoce. In questa fascia di individui l’intervento terapeutico si basa sulle modifiche dello stile di vita, quali lo svolgimento di regolare attività fisica aerobica di almeno 30 minuti al giorno, il mantenimento di un regime dietetico equilibrato, ricco di verdura, frutta e cereali integrali e il consumo moderato di insaccati, formaggi, dolciumi e olio d’oliva, nonché l’astensione dal consumo di superalcolici (14–16). Quando questo non è sufficiente, si può ricorrere all’uso di nutraceutici. Tuttavia, la disglicemia è una condizione biochimica asintomatica, il che rende più difficile riscontrare i benefici del trattamento rispetto a un paziente diabetico sintomatico. È dunque importante trovare nuovi indicatori di efficacia, focalizzandosi su meccanismi che vadano al di là di quelli indicati da glicemia ed emoglobina glicata e valutare gli aspetti di prevenzione cardiometabolica, compreso il profilo lipidico, il quale può essere influenzato positivamente dai cambiamenti dello stile di vita e dall’impiego di agenti nutraceutici. In questo contesto, l’intervento con un composto nutraceutico a base di Ilex paraguariensis, Morus alba e cromo picolinato, si configura come una strategia promettente, poiché associa l’azione antiossidante e di equilibrio del peso corporeo, all’effetto regolarizzante sul metabolismo dei lipidi e dei carboidrati (17–19). In questo ambito, tuttavia, esistono ancora delle lacune sia nell’identificazione dei pazienti che potrebbero beneficiare della terapia nutraceutica, che sulla compliance al trattamento proposto, nonché nel monitoraggio dei progressi del paziente.
L’obiettivo di questo studio osservazionale è stato quello di testare l’efficacia a tre e a sei mesi del nutraceutico Glicoset® nel migliorare lo stato glicemico e il profilo lipidico nei soggetti con IFG o IGT, al fine di valutare i benefici derivanti dalla terapia nutraceutica sul profilo cardiometabolico di questi pazienti.
Materiali e Metodi
Disegno dello studio e criteri di inclusione
Lo studio osservazionale, prospettico, multicentrico, in aperto è stato condotto in cinque Centri specialistici delle province di Padova, Bologna, Aosta, Seriate e Olbia. Sono stati arruolati pazienti con età ≥ 25 anni, di entrambi i sessi, con glicemia a digiuno alterata, compresa tra 100-125 mg/dl, con IFG o IGT (glicemia post-carico tra 140 e 199 mg/dl) diagnosticate tramite prelievo per glicemia a digiuno o OGTT.
Tra i criteri di esclusione rientrano: assunzione di farmaci o preparati con effetto ipoglicemizzante, diabete mellito di tipo 1 o 2, insufficienza epatica o renale, disturbi gastrointestinali, cardiopatia ischemica, insufficienza cardiaca o ictus, variazione ponderale > 3 kg durante i 3 mesi precedenti, neoplasie maligne o significativi disturbi neurologici o psichiatrici, compreso abuso di alcol o droghe.
Oltre ai dati anagrafici, sono stati raccolti, sia in fase di arruolamento (T0) che al monitoraggio di tre (T3) e sei (T6) mesi, dati clinici e strumentali, tra cui peso corporeo (Kg), indice di massa corporea (BMI) (Kg/m2), circonferenza vita (cm), glicemia a digiuno (mg/dL), emoglobina glicata (HbA1c) (mmol/mol), insulina (µU/ml), colesterolemia totale (mg/dL), HDL-C (mg/dL), LDL-C (mg/dL), non HDL-C (mg/dL), trigliceridi (mg/dL), ALT/GPT (U/L), AST/GOT (U/L), GGT (U/L), piastrine (unità/µL), emoglobina (g/dL), ematocrito (%), pressione arteriosa sistolica e diastolica (mmHg), uricemia (mg/dL) e creatinina (mg/dL).
Ai soggetti idonei, identificati sulla base del loro profilo clinico, è stato prescritto il prodotto nutraceutico Glicoset® alla dose di 1.000mg pro die, oltre che suggerimenti generali di miglioramento dello stile di vita (i.e. mantenimento di una dieta equilibrata e salutare, e di uno stile di vita attivo).
Endpoint primario dello studio è stato valutare al T3 e al T6 l’efficacia e la tollerabilità del nutraceutico sulla glicemia a digiuno. Come endpoint secondario è stato valutato invece il numero di pazienti con ritorno al valore di glicemia basale e con miglioramento dell’assetto lipidico.
È stata utilizzata la statistica descrittiva per analizzare le caratteristiche demografiche di base. Le variabili continue sono riportate tramite il numero di pazienti, la media e la deviazione standard (DS). I parametri clinici sono stati analizzati longitudinalmente utilizzando il test di Kruskal-Wallis con l’analisi post-hoc di Dunn. Tutte le analisi sono state eseguite utilizzando il linguaggio di programmazione Python tramite Jupyter Notebook all’interno del pacchetto di data science Anaconda3 per Windows. I valori di p < 0,05 sono stati considerati statisticamente significativi.
Risultati
Il presente studio ha coinvolto 98 pazienti, 52 maschi e 45 femmine di età compresa tra 25 e 92 anni (età media 62,10 ± 14,16), tra cui otto fumatori. Al momento dell’arruolamento (T0), 45 su 98 partecipanti (il 46% del gruppo di studio) era già in terapia con uno o più farmaci per il controllo del loro rischio cardiometabolico (Tabella 1). Le caratteristiche del gruppo di studio al momento dell’arruolamento sono mostrate nella Tabella 1. Fra T0 e T3 e fra T3 e T6 nessun paziente ha iniziato o sospeso un trattamento ipolipemizzante e il dosaggio delle statine già assunte al basale è rimasto invariato. Durante tutto il periodo di monitoraggio, non sono stati segnalati eventi avversi all’utilizzo del prodotto.
Nel periodo di studio, nonostante non sia stata osservata una riduzione significativa del peso e del BMI, è emerso un trend di riduzione della circonferenza vita (p=0,09). Quest’ultima è diminuita da 101,12 ± 13,50 cm al T0 a 98,37 ± 12,64 cm dopo 3 mesi e a 97,54 ± 12,63 cm dopo 6 mesi di trattamento (Tabella 2).
Tutti i partecipanti allo studio presentavano al momento dell’arruolamento un valore alterato di glicemia a digiuno, compreso tra 100 e 125 mg/dl. Dopo 3 mesi di trattamento, il valore medio della glicemia a digiuno è diminuito significativamente da 111,89 ± 6,79 mg/dL a 107,38 ± 7,57 mg/dL (p < 0,0001). Questa riduzione è rimasta persistente e significativa rispetto al baseline e ai valori registrati a 3 mesi, con il valore medio della glicemia a digiuno che ha raggiunto 104,22 ± 6,83 mg/dL dopo 6 mesi di trattamento (p < 0,0001) (Figura 1a). Di particolare interesse è l’osservazione che, dopo soli 3 mesi di trattamento con il nutraceutico, il 15% dei pazienti valutati (n = 13) è passato dallo stato di IFG a una condizione euglicemica. Questa percentuale è aumentata al 20% (n = 20) dopo 6 mesi di trattamento (Figura 1b).
Per quanto riguarda il profilo lipidico dei pazienti, è stata osservata una significativa riduzione della colesterolemia totale durante il periodo di studio. Dopo 3 mesi di trattamento, l’81% dei pazienti (n=75) ha mostrato una riduzione della colesterolemia totale, passando da 197,94 ± 41,69 mg/dL a 183,32 ± 36,78 mg/dL (p < 0,01) (Figura 2). Questa diminuzione rispetto ai valori al T0 è rimasta significativa anche al termine dello studio (p < 0,05) (Figura 2); inoltre, circa il 50% dei pazienti valutati (n=47) ha evidenziato un ulteriore abbassamento della colesterolemia totale rispetto al valore a 3 mesi. È stato anche osservato un trend di riduzione (p = 0,09) della concentrazione ematica di colesterolo LDL, che è passata da 125,45 ± 36,67 mg/dL a 110,65 ± 38,90 mg/dL dopo 3 mesi di trattamento e ha mantenuto un valore costante dopo ulteriori 3 mesi di follow-up (Tabella 2).
Nel presente studio, un altro importante parametro biochimico valutato per determinare il rischio metabolico dei pazienti con disglicemia è stato la concentrazione di acido urico nel sangue. Il valore medio di uricemia al T0 e al monitoraggio di 3 mesi era rispettivamente di 5,51 ± 1,34 mg/dL e di 5,65 ± 1,23 mg/dL, con circa il 17% (n = 17) dei partecipanti che presentava iperuricemia (valore di uricemia > 6,8 o > 7 mg/dL) (20) in entrambi i timepoint. Dopo 6 mesi di trattamento, è stata osservata una riduzione significativa dell’uricemia rispetto ai valori al T0 e ai livelli misurati a 3 mesi (p < 0,05) (Figura 3). Inoltre, al termine dello studio la percentuale di individui con iperuricemia è diminuita a meno del 10% (n = 8).
Discussione
Questo studio osservazionale fornisce una nuova prospettiva sull’applicazione nel mondo reale del prodotto nutraceutico Glicoset® in pazienti con IFG, mettendo in luce la sua efficacia nella normalizzazione dei parametri metabolici. Nel presente studio condotto in 98 pazienti di entrambi i sessi, con un’età media di 62 anni, il trattamento con il nutraceutico ha dimostrato un effetto positivo sulla glicemia a digiuno, la cui concentrazione ematica è risultata significativamente ridotta dopo 3 mesi di trattamento. Questa riduzione è risultata significativa anche al follow-up di 6 mesi. Inoltre, il nutraceutico ha dimostrato una notevole efficacia nel migliorare lo stato glicemico dei pazienti nel tempo. Dopo 3 mesi di trattamento, il 15% dei partecipanti ha raggiunto uno stato di euglicemia, percentuale che è aumentata al 20% dopo 6 mesi di assunzione.
Questi risultati sono in linea con le evidenze derivanti da un trial clinico randomizzato e controllato con placebo condotto da Derosa e colleghi nel 2021, che aveva lo scopo di valutare se la somministrazione di tre mesi del nutraceutico migliorasse lo stato glicemico in 148 pazienti adulti disglicemici non trattati con farmaci ipoglicemizzanti (19). Gli autori hanno dimostrato che l’utilizzo di Glicoset® in questa popolazione ha portato ad una riduzione significativa della glicemia a digiuno, postprandiale e dell’HbA1c rispetto al baseline e al placebo e che il 25% dei soggetti in trattamento è tornato ad uno stato euglicemico (19).
Nel presente studio il miglioramento del profilo glicemico è stato accompagnato anche da una riduzione significativa della colesterolemia totale e da un trend di riduzione del colesterolo LDL al follow-up di 3 mesi. Allo stesso modo un recente studio osservazionale multicentrico che ha arruolato 63 individui con IFG, ha mostrato un miglioramento dello stato glicemico e lipidico dei partecipanti, con una riduzione significativa del peso corporeo a seguito di 3 mesi di supplementazione con Glicoset® (21). Questi risultati non sorprendono in quanto è stato precedentemente dimostrato che il consumo dell’estratto di foglie standardizzato di Ilex paraguariensis (contenente 2% di I-deossinojirimcina (DNJ)) migliora il profilo glicemico in pazienti con diabete mellito di tipo 2 in trattamento con ipoglicemizzanti orali (22). Inoltre, il consumo di foglie di Morus alba (comunemente conosciuto come gelso bianco), una pianta multifunzionale contenente numerosi costituenti bioattivi come DNJ, fenoli e flavonoidi, si è dimostrato efficace nel ridurre i valori di glucosio plasmatico a digiuno e di HbA1c in pazienti con diabete mellito di tipo 2 non controllato (23). Infine, il cromo picolinato, un importante cofattore nel metabolismo dell’insulina, promuove la fosforilazione dei recettori dell’insulina nelle cellule target quali cellule muscolari, epatociti e adipociti, migliorando la tolleranza al glucosio (24). Una recente revisione ha riportato che la supplementazione con cromo picolinato è efficace nel prevenire o ritardare l’insorgenza del diabete di tipo 2, riducendo l’iperglicemia, i livelli di colesterolo totale e trigliceridi, il peso corporeo e la massa grassa (25). L’utilizzo dei nutraceutici si è dimostrato efficace nel migliorare il profilo lipidico, favorendo al contempo la riduzione del peso corporeo anche in soggetti normolipidemici, dislipidemici e ipercolesterolemici (26,27). Nel presente studio, non è stata osservata una riduzione significativa del peso corporeo e del BMI, probabilmente a causa della mancata associazione della supplementazione con il nutraceutico a un regime alimentare e un piano di attività fisica standardizzati. Tuttavia, la riduzione della circonferenza vita e dei parametrici biochimici, quali glicemia plasmatica a digiuno, colesterolemia e LDL-C, indica l’efficacia del prodotto nel migliorare il profilo metabolico dei pazienti. Un monitoraggio di soli 3 mesi non consente tuttavia una valutazione degli effetti a medio e lungo termine del trattamento nutraceutico.
Il presente lavoro mostra che gli effetti della supplementazione sul profilo glicemico e lipidico già presenti a 3 mesi sono stati mantenuti anche dopo 6 mesi di trattamento. Non appare inutile sottolineare che circa il 50% dei pazienti ha mostrato ulteriori miglioramenti della colesterolemia totale rispetto ai valori a 3 mesi, indicando che il trattamento prolungato può avere effetti benefici aggiuntivi. Simili risultati sono stati descritti da Derosa e colleghi in uno studio di follow-up condotto nel 2023 in 186 pazienti adulti con disglicemia, randomizzati in un gruppo di trattamento (dieta + Glicoset® 1000) e in un gruppo di controllo (28). Al termine dello studio, gli autori hanno mostrato come la supplementazione di 12 mesi con il prodotto nutraceutico abbia migliorato il profilo glicemico e lipidico dei pazienti, portando ad una riduzione significativa della glicemia a digiuno e postprandiale, dell’HbA1c e dell’Homa-IR, oltre che dei livelli di colesterolo totale, LDL-C e trigliceridi (28).
È interessante notare, inoltre, come 6 mesi di trattamento abbiano portato ad una significativa riduzione della uricemia e del numero di pazienti con iperuricemia rispetto ai timepoint precedenti. L’iperuricemia è considerata un marker di rischio metabolico per la sua capacità di ridurre i livelli di ossido nitrico, favorendo così la disfunzione endoteliale (29). Inoltre, la prevalenza della sindrome metabolica aumenta proporzionalmente con l’aumentare dei livelli di uricemia (30). Sebbene i meccanismi alla base di questa correlazione non siano ancora del tutto chiariti, è noto che i livelli sierici di acido urico siano associati ai valori di glicemia nella popolazione sana. È stato stimato che ogni aumento di 1 mg/dL di acido urico corrisponde a un aumento del 17% del rischio di sviluppare diabete di tipo 2 (31). Inoltre, i risultati di uno studio osservazionale di coorte, hanno mostrato l’associazione tra i livelli di acido urico e la morbilità cardiovascolare, anche dopo correzione per la funzionalità renale dei pazienti (32). È possibile ipotizzare che la riduzione della glicemia, con il conseguente miglioramento della sensibilità all’insulina, insieme al miglioramento del profilo lipidico e all’azione antiossidante e antinfiammatoria delle componenti del nutraceutico Glicoset®, già validate clinicamente (19,22,23,25,27,33), possano contribuire alla riduzione dell’uricemia nei pazienti in trattamento. In questo contesto, l’impatto metabolico significativo sulla concentrazione plasmatica di acido urico si manifesta successivamente alla riduzione dei parametri glicemici e lipidici, suggerendo che un trattamento a medio-lungo termine può avere un effetto additivo nel ridurre il rischio cardiometabolico dei pazienti.
Il presente studio non è esente da alcune limitazioni. Essendo un’indagine osservazionale, la mancanza di un gruppo di controllo randomizzato limita la certezza nell’attribuire gli effetti osservati esclusivamente al trattamento con il nutraceutico. Un gruppo di studio più ampio e una valutazione più approfondita dei fattori confondenti potrebbero rafforzare ulteriormente i risultati. Tuttavia, i dati raccolti confermano le evidenze preesistenti sull’efficacia di Glicoset® nel migliorare il profilo metabolico dei pazienti con disglicemia non trattati con ipoglicemizzanti. Inoltre, questo studio è il primo a evidenziare un effetto positivo del nutraceutico sulla concentrazione di acido urico nel sangue. Per consolidare queste evidenze e comprendere meglio l’efficacia a lungo termine di Glicoset®, sono necessari futuri studi con un disegno più rigoroso e un follow-up a lungo termine.
Conclusioni
In conclusione, la disglicemia è ancora un fattore di rischio sottostimato nella pratica clinica quotidiana ed è essenziale educare i clinici a considerare l’aumento della glicemia come un fattore di rischio continuo, piuttosto che binario (presente/assente) (34). Ne risulta che lo screening di routine del metabolismo glicemico può giocare un ruolo cruciale nell’identificare individui a rischio prima che si manifestino eventi cardiovascolari. L’implementazione di un programma pratico di suggerimenti sulla dieta e lo stile di vita è fondamentale per supportare i pazienti nel raggiungimento degli obiettivi metabolici raccomandati. Il miglioramento del controllo glicemico assume in quest’ottica un’importanza centrale, poiché anche una modesta riduzione dei livelli di glucosio può significativamente ridurre il rischio di sviluppare diabete mellito di tipo 2 e complicanze cardiovascolari. Questo studio evidenzia che il trattamento nutraceutico a medio-lungo termine, come dimostrato dall’uso di Glicoset®, può giocare un ruolo significativo nel migliorare il profilo metabolico dei pazienti e contemporaneamente ridurre il loro rischio cardiovascolare. Comprendere i determinanti dell’aderenza del paziente alla terapia è cruciale, così come generare motivazione per personalizzare l’intervento medico in modo da soddisfare le esigenze specifiche del paziente e massimizzare l’efficacia del trattamento.
Bibliografia
- Tabák AG, Herder C, Rathmann W, Brunner EJ, Kivimäki M. Prediabetes: a high-risk state for diabetes development. The Lancet. 2012 Jun;379(9833):2279–90.
- Cai X, Zhang Y, Li M, Wu JH, Mai L, Li J, et al. Association between prediabetes and risk of all cause mortality and cardiovascular disease: updated meta-analysis. BMJ. 2020 Jul 15;m2297.
- Brannick B, Wynn A, Dagogo-Jack S. Prediabetes as a toxic environment for the initiation of microvascular and macrovascular complications. Exp Biol Med. 2016 Jun 14;241(12):1323–31.
- Lamprou S, Koletsos N, Mintziori G, Anyfanti P, Trakatelli C, Kotsis V, et al. Microvascular and Endothelial Dysfunction in Prediabetes. Life. 2023 Feb 25;13(3):644.
- Menke A, Casagrande S, Geiss L, Cowie CC. Prevalence of and Trends in Diabetes Among Adults in the United States, 1988-2012. JAMA. 2015 Sep 8;314(10):1021.
- Shu Y, Wu X, Wang J, Ma X, Li H, Xiang Y. Associations of Dietary Inflammatory Index With Prediabetes and Insulin Resistance. Front Endocrinol (Lausanne). 2022 Feb 17;13.
- Istituto Nazionale di Statistica (Istat). Il diabete in Italia [Internet]. 2017 Jul [cited 2024 Jun 21]. Available from: https://www.istat.it/it/archivio/202600
- American Diabetes Association Professional Practice Committee. 2. Classification and Diagnosis of Diabetes: Standards of Medical Care in Diabetes-2022. Diabetes Care. 2022 Jan 1;45(Suppl 1):S17–38.
- International Expert Committee. International Expert Committee Report on the role of A1c assay in the diagnosis of Diabetes. Diabetes Care 32: 1327-1334, 2009.
- Ferrannini E, Gastaldelli A, Iozzo P. Pathophysiology of Prediabetes. Medical Clinics of North America. 2011 Mar;95(2):327–39.
- Walker M, Mari A, Jayapaul MK, Bennett SMA, Ferrannini E. Impaired beta cell glucose sensitivity and whole-body insulin sensitivity as predictors of hyperglycaemia in non-diabetic subjects. Diabetologia. 2005 Dec 1;48(12):2470–6.
- Cosic V, Jakab J, Pravecek M, Miskic B. The Importance of Prediabetes Screening in the Prevention of Cardiovascular Disease. Medical Archives. 2023;77(2):97.
- Ghany R, Tamariz L, Chen G, Dawkins E, Forbes E, Tajiri T, et al. Impact of Prediabetes on Cardiac Function Among Primary Care Patients. Metab Syndr Relat Disord. 2023 Aug 1;21(6):314–8.
- Chen Y, Chen Z, Pan L, Ma ZM, Zhang H, Li XJ, et al. Effect of Moderate and Vigorous Aerobic Exercise on Incident Diabetes in Adults With Obesity. JAMA Intern Med. 2023 Mar 1;183(3):272.
- Gorodeski Baskin R, Alfakara D. Root Cause for Metabolic Syndrome and Type 2 Diabetes. Endocrinol Metab Clin North Am. 2023 Mar;52(1):13–25.
- Cao Z, Li W, Wen CP, Li S, Chen C, Jia Q, et al. Risk of Death Associated With Reversion From Prediabetes to Normoglycemia and the Role of Modifiable Risk Factors. JAMA Netw Open. 2023 Mar 28;6(3):e234989.
- Broadhurst CL, Domenico P. Clinical Studies on Chromium Picolinate Supplementation in Diabetes Mellitus—A Review. Diabetes Technol Ther. 2006 Dec;8(6):677–87.
- Arçari DP, Santos JC, Gambero A, Ferraz LFC, Ribeiro ML. Modulatory effects of yerba maté (Ilex paraguariensis) on the PI3K-AKT signaling pathway. Mol Nutr Food Res. 2013 Oct;57(10):1882–5.
- Derosa G, D’Angelo A, Maffioli P. Metabolic Actions of a Supplement of Ilex Paraguariensis (An Extract of the Leaf Standardized to 2% I-Deoxinojirimcina), White Mulberry and Chromium Picolinate in Nondiabetic Subjects with Dysglycemia: A Randomized Trial. Life. 2021 Jul 18;11(7):709.
- Khanna D, Fitzgerald JD, Khanna PP, Bae S, Singh MK, Neogi T, et al. 2012 American College of Rheumatology guidelines for management of gout. Part 1: Systematic nonpharmacologic and pharmacologic therapeutic approaches to hyperuricemia. Arthritis Care Res (Hoboken). 2012 Oct 28;64(10):1431–46.
- Borsi A, Cabula R, Sangalli B, Curcu T, Massa MG, Murgia M, et al. Prevenzione dell’evoluzione da prediabete a diabete con l’uso di un nutraceutico a base di Ilex paraguariensis (Ilex L. spp. Aquifoliales), gelso bianco (Morus spp., Moraceae) e cromo picolinato. MD Digital Suppl 1/2024.
- Klein GA, Stefanuto A, Boaventura BCB, de Morais EC, Cavalcante L da S, de Andrade F, et al. Mate tea (Ilex paraguariensis) improves glycemic and lipid profiles of type 2 diabetes and pre-diabetes individuals: a pilot study. J Am Coll Nutr. 2011 Oct;30(5):320–32.
- Murata K, Yatsunami K, Fukuda E, Onodera S, Mizukami O, Hoshino G, et al. Antihyperglycemic effects of propolis mixed with mulberry leaf extract on patients with type 2 diabetes. Altern Ther Health Med. 2004;10(3):78–9.
- Anderson RA. Chromium, Glucose Intolerance and Diabetes. J Am Coll Nutr. 1998 Dec;17(6):548–55.
- Derosa G, D’Angelo A, Maffioli P. Ilex paraguariensis, white mulberry and chromium picolinate in patients with pre-diabetes. Phytother Res. 2020 Jun;34(6):1377–84.
- Andersen T, Fogh J. Weight loss and delayed gastric emptying following a South American herbal preparation in overweight patients. Journal of Human Nutrition and Dietetics. 2001 Jun 7;14(3):243–50.
- de Morais EC, Stefanuto A, Klein GA, Boaventura BCB, de Andrade F, Wazlawik E, et al. Consumption of Yerba Mate (Ilex paraguariensis) Improves Serum Lipid Parameters in Healthy Dyslipidemic Subjects and Provides an Additional LDL-Cholesterol Reduction in Individuals on Statin Therapy. J Agric Food Chem. 2009 Sep 23;57(18):8316–24.
- Derosa G, D’Angelo A, Maffioli P. Effects on Glyco-Metabolic Control after 12 Months of Treatment with a Supplement of Ilex Paraguariensis, White Mulberry and Chromium Picolinate in Non-Diabetic Patients with Dysglycemia. Journal of Food and Nutrition Research. 2023 Oct 16;11(4):319–24.
- Viazzi F, Leoncini G, Pontremoli R. Uric acid: bystander or active player in the development of cardiovascular and renal damage. Giornale di Tecniche Nefrologiche e Dialitiche. 2013;25(1):20–5.
- Lin SD, Tsai DH, Hsu SR. Association between serum uric acid level and components of the metabolic syndrome. J Chin Med Assoc. 2006 Nov;69(11):512–6.
- Kodama S, Saito K, Yachi Y, Asumi M, Sugawara A, Totsuka K, et al. Association Between Serum Uric Acid and Development of Type 2 Diabetes. Diabetes Care. 2009 Sep 1;32(9):1737–42.
- Neri L, Rocca Rey LA, Lentine KL, Hinyard LJ, Pinsky B, Xiao H, et al. Joint Association of Hyperuricemia and Reduced GFR on Cardiovascular Morbidity: A Historical Cohort Study Based on Laboratory and Claims Data From a National Insurance Provider. American Journal of Kidney Diseases. 2011 Sep;58(3):398–408.
- Thaipitakwong T, Numhom S, Aramwit P. Mulberry leaves and their potential effects against cardiometabolic risks: a review of chemical compositions, biological properties and clinical efficacy. Pharm Biol. 2018 Jan 1;56(1):109–18.
- Bloomgarden ZT. American College of Endocrinology Pre-Diabetes Consensus Conference: Part One. Diabetes Care. 2008 Oct 1;31(10):2062–9.
Related papers
La pubblicazione recente di alcuni lavori scientifici basati sulle risultanze di alcuni osservatori epidemiologi mondiali, ha riportato alla ribalta il ruolo chiave delle malattie cardiovascolari come prima causa di morte e disabilità, non solo nel presente, ma anche nel futuro proiettato oggi al 2050 con un incremento più o meno equamente distribuito tra le malattie [more info]
1) Lipoproteine ed aterosclerosi Le lipoproteine sono particelle composte da un nucleo ricco in esteri del colesterolo e trigliceridi (TG) circondati da colesterolo libero, fosfolipidi e apolipoproteine. Le lipoproteine plasmatiche vengono suddivise in varie classi (VLDL, IDL, LDL, HDL e chilomicroni) in base alle dimensioni, alla composizione lipidica e alle apolipoproteine presenti (Tabella 1). I [more info]
Introduzione Le malattie cardiovascolari rappresentano la principale causa di morbilità e mortalità a livello globale, nonostante i progressi nella prevenzione e nel trattamento farmacologico. In questo contesto, l’adozione di strategie terapeutiche efficaci per la gestione dei fattori di rischio cardiovascolare è fondamentale. La combinazione farmacologica di farmaci con meccanismi d’azione complementari è diventata una pratica [more info]