Introduzione
Nel corso degli ultimi anni un crescente interesse è stato rivolto da parte della letteratura scientifica al coinvolgimento del metabolismo dell’acido urico nella fisiopatologia dell’ipertensione e delle malattie cardiovascolari, renali e metaboliche (1) (Figura 1). Non sorprende, quindi, che le linee guida 2023 della European Society of Hypertension per la gestione dell’ipertensione arteriosa (2) abbiamo ripreso, ed ulteriormente enfatizzato, la raccomandazione proposta dalla edizione 2018 (3) e dalle linee guida della International Society of Hypertension (4) di monitorare sistematicamente i valori di uricemia in fase di inquadramento del paziente iperteso. Invero, la prevalenza dell’ipertensione nel paziente con malattia da depositi di urato – definizione fisiopatologica della gotta – è doppia rispetto a quanto si osserva nei soggetti con normale metabolismo dell’acido urico (36 vs 17%) mentre una condizione di iperuricemia, con o senza depositi di urato, si riscontra mediamente in un paziente iperteso su quattro (5,6). Peraltro, gli aumentati livelli circolanti di acido urico rappresentano un predittore indipendente della comparsa di ipertensione (7,8), ruolo predittivo che si osserva già nei bambini e negli adolescenti mentre si perde quasi completamente nei soggetti anziani ed in quelli con ipertensione secondaria e normale funzione renale (9). La malattia da depositi di urato è associata ad un aumentato rischio di eventi cardiovascolari (compreso l’infarto miocardico e l’ictus) (1,10,11) attraverso meccanismi fisiopatologici non dissimili da quelli coinvolti nella fisiopatologia dell’ipertensione e delle complicanze cardiovascolari e renali ad essa associate, principalmente rappresentati da infiammazione e stress ossidativo (12). La prevenzione della malattia da depositi di urato attraverso la riduzione dei livelli circolanti di acido urico con inibitori della xantina ossidasi si associa ad una riduzione di variabile entità della pressione arteriosa, evidenza che conferma ulteriormente l’ipotesi di un coinvolgimento del dismetabolismo dell’acido urico nella fisiopatologia dell’ipertensione e delle sue complicanze (13-15). A tale riguardo, le linee guida raccomandano il raggiungimento ed il mantenimento di livelli circolanti di acido urico <6 mg/dL nei pazienti con malattia da depositi di urato (16). Non appare inutile sottolineare che i farmaci di comune utilizzo per il trattamento delle riacutizzazioni gottose – colchicina, farmaci antinfiammatori non steroidei e corticosteroidi – possono influire negativamente sul controllo pressorio nei pazienti ipertesi, ragione per cui è importante intensificare il monitoraggio della pressione arteriosa in corso di riacutizzazioni infiammatorie (2). Alcune recenti evidenze suggeriscono un possibile effetto protettivo di colchicina nei confronti della malattia aterosclerotica (17), presumibilmente attraverso una riduzione dell’infiammazione e dei meccanismi sottesi allo sviluppo e alla progressione della aterosclerosi. Non meno interessanti appaiono le evidenze di un possibile effetto protettivo a livello cardiovascolare della terapia ipouricemizzante prodotte da alcuni studi (13,15), sia pur non del tutto in linea con altre osservazioni (18-20). L’opportunità di studiare sistematicamente il comportamento dei livelli circolanti di acido urico nel paziente iperteso trova una ulteriore motivazione, oltre che nella condivisione di alcuni meccanismi fisiopatologici, nella documentata influenza di alcuni trattamenti antipertensivi di uso comune sui livelli circolanti di questo prodotto finale del metabolismo purinico. I diuretici tiazidici/similtiazidici e dell’ansa aumentano i livelli circolanti di acido urico (21-23), mentre ACE-inibitori, sartani, calcio-antagonisti e beta bloccanti non hanno effetti rilevanti anche se per i beta bloccanti è stata suggerita una riduzione dell’escrezione renale di acido urico (21), effetto invero non evidente per nebivololo (24). Tra i sartani, losartan si è dimostrato efficace nel ridurre i livelli circolanti di acido urico attraverso un aumento della sua escrezione a livello renale, con alcune non trascurabili ricadute positive in termini di protezione cardiovascolare (22,23,25). Insieme ai calcio-antagonisti, losartan si è dimostrato efficace anche nel ridurre l’incidenza della malattia da depositi di urato nei pazienti ipertesi, indipendentemente dai valori pressori (21). Sulla base di queste evidenze le linee guida suggeriscono di usare con attenzione i diuretici nei pazienti con dismetabolismo dell’acido urico, ovviamente senza escluderne l’uso se necessario al raggiungimento del controllo pressorio, eventualmente considerando l’opportunità di usarne dosaggi ridotti visto che l’effetto di questi farmaci sui livelli di uricemia è dose dipendente (2,16).
Ipertensione, iperuricemia e malattie cardiovascolari
Le malattie cardiovascolari rappresentano la prima causa di morte nelle civiltà occidentali e la loro incidenza dipende in maniera prevalente dall’intervento integrato di una serie di fattori di rischio cardiovascolare che condizionano lo sviluppo della malattia aterosclerotica e promuovono le sue complicanze in conseguenza di meccanismi sovrapposti di trombosi vascolare.
L’ipertensione arteriosa rappresenta il più importante fattore di rischio cardiovascolare con una diretta responsabilità su una ampia quota della mortalità e morbosità cardiovascolare nel mondo. Secondo le stime dell’Organizzazione Mondiale della Sanità l’ipertensione arteriosa nel mondo interessa circa 1,28 miliardi di persone nella fascia di età 30-79 anni, due terzi dei quali in Paesi a basso-medio reddito. Nel 2019 la prevalenza globale dell’ipertensione arteriosa, standardizzata per età, nella fascia di età 30-79 anni era pari al 34% negli uomini e al 32% nelle donne (2). Questa rilevanza epidemiologica si traduce in un enorme impatto clinico e socioeconomico in ragione del considerevole aumento del rischio di malattie cardio-cerebrovascolari e renali legato agli aumentati livelli pressori (2). Il Global Burden of Diseases, Injuries , and Risk Factors Study (GBD) 2019, che ha stimato la quota di mortalità, anni di vita persi e anni di vita vissuta con disabilità attribuibili ad 87 fattori di rischio comportamentali, ambientali, occupazionali e metabolici, ha evidenziato come la quota preponderante di decessi nel mondo sia riconducibile a valori di pressione sistolica ≥110–115 mmHg con una stima di 10,8 milioni di decessi evitabili ogni anno e di 235 milioni di anni di vita persi o vissuti con disabilità ogni anno (26).
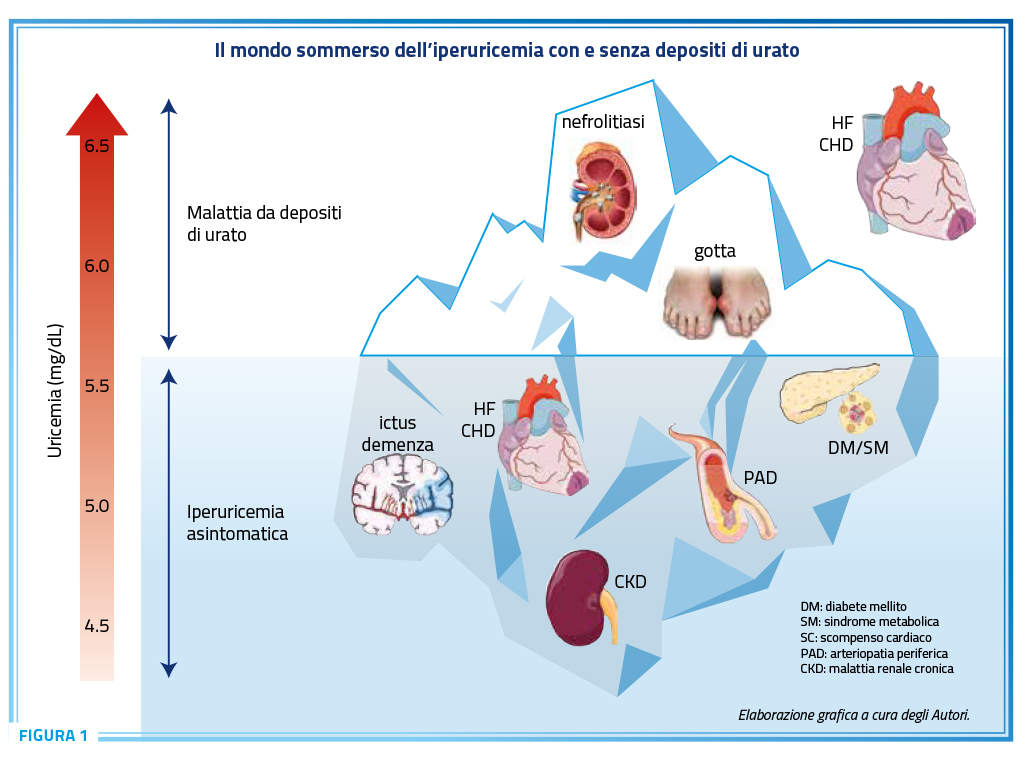
Uno degli aspetti che in questi ultimi anni è emerso in maniera preponderante è rappresentato dall’evidenza che il panorama del rischio cardiovascolare appare molto più ampio di quello prospettato dall’approccio proposto dalla tradizionale epidemiologia basata sullo studio di Framingham in ragione dell’intervento di una serie di ulteriori determinanti del rischio cardiovascolare, spesso ampiamente modificabili ed in grado di condizionare quello che viene conosciuto come “rischio cardiovascolare residuo” e che condiziona un’aumentata probabilità di complicanze cardiovascolari anche in presenza di un controllo adeguato dei principali fattori di rischio. A questo riguardo nel corso degli ultimi anni un numero impressionante di studi scientifici ha prepotentemente riacceso il dibattito scientifico sul problema dell’iperuricemia cronica e delle patologie correlate come determinanti del rischio cardiovascolare, tematica che ha attraversato in lungo ed in largo la letteratura epidemiologica degli ultimi 30-40 anni in ragione del frequente riscontro di una significativa associazione tra livelli di acido urico, presenza di malattia gottosa ed aumento del rischio relativo di complicanze cardiovascolari (27) (Figura 1). Le evidenze scientifiche attualmente disponibili, invero, attribuiscono all’iperuricemia, con e senza depositi di urato, una responsabilità fisiopatologica certamente non trascurabile in tutte le fasi del continuum cardio-cerebro-renale che va dell’esposizione ai vari fattori di rischio, allo sviluppo di danno d’organo e alla comparsa di eventi cardiaci, cerebrali e renali. L’iperuricemia, infatti, si comporta in modo non dissimile dai fattori di rischio cardiovascolare tradizionali con i quali spesso si associa in una relazione talmente stretta da lasciare supporre l’esistenza di un nesso patogenetico probabilmente di tipo bidirezionale in cui iperuricemia e fattori di rischio tradizionali – ipertensione e dismetabolismo glicidico in primis – interagiscono generando un circuito di amplificazione reciproca (27).
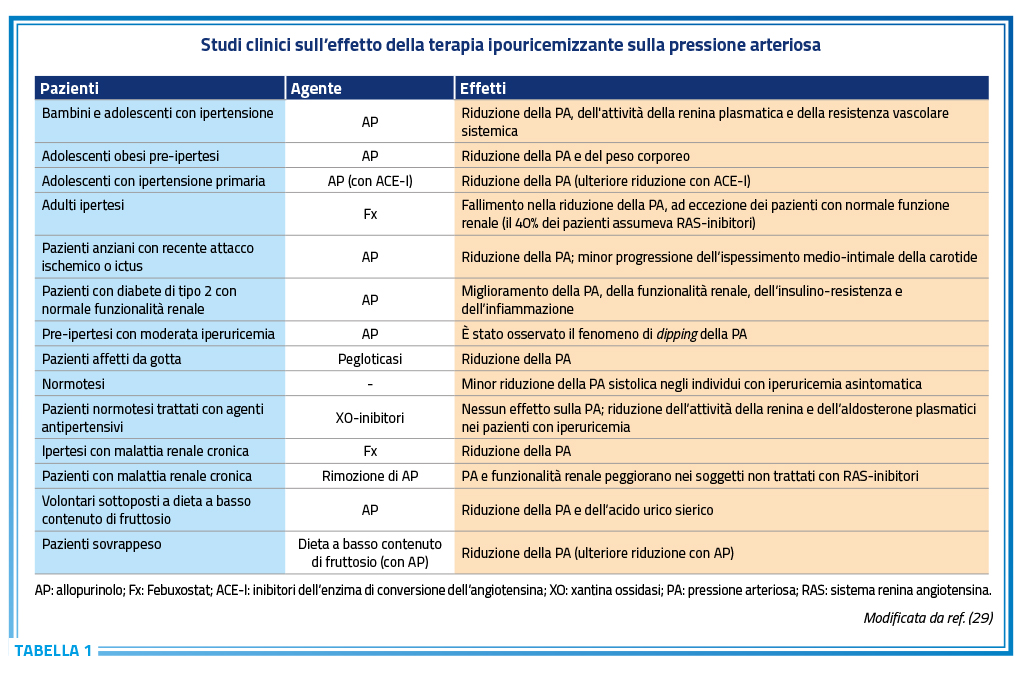
La relazione tra dismetabolismo dell’acido urico e ipertensione arteriosa è nota dal lontano 1870 quando un giovane studente di medicina, Frederick Akbar Mahomed, descrisse una associazione tra aumentati livelli circolanti di acido urico ed ipertensione arteriosa (28). Nel corso degli ultimi decenni una enorme mole di dati derivanti da evidenze sperimentali, osservazionali e di intervento ha confermato la brillante intuizione del giovane studente. In ambito sperimentale è ben noto come l’induzione di una condizione di iperuricemia nel ratto determini un aumento dei livelli di pressione arteriosa che vengono efficacemente ridotti dalla correzione della condizione di iperuricemia (21,29). Le evidenze epidemiologiche forniscono un robusto supporto all’ipotesi di un nesso fisiopatologico tra dismetabolismo dell’acido urico ed ipertensione arteriosa. L’iperuricemia è spesso presente nel paziente iperteso, soprattutto in quelle con forme più severe di ipertensione e nei casi di ipertensione ad esordio giovanile (29). L’iperuricemia, inoltre, è un potente predittore della comparsa di ipertensione, con un rischio a 5-10 anni aumentato di circa 2 volte (29). Alcune evidenze derivanti da studi di intervento, sia pur non molto numerose, forniscono una ulteriore dimostrazione dello stresso nesso fisiopatologico tra metabolismo dell’acido urico ed ipertensione arteriosa (Tabella 1) (29). In adolescenti con ipertensione di nuova diagnosi ed iperuricemia è stata dimostrata una significativa riduzione della pressione arteriosa in corso di terapia ipouricemizzante (29). Simili risultati sono stati osservati in adolescenti obesi con preipertensione nei quali la riduzione della uricemia con un inibitore della xantina ossidasi o con un agente uricosurico è risultata associata ad una riduzione dei livelli pressori (29). Peraltro, i benefici sui livelli pressori osservati negli adolescenti in corso di trattamento con l’inibitore della xantina ossidasi allopurinolo sembrano poter essere addizionali rispetto alla terapia con ACE-inibitori (29). In uno studio americano di fase 2, in doppio cieco, controllato con placebo e multicentrico l’inibitore della xantina ossidasi è stato valutato per il suo effetto sulla pressione arteriosa in soggetti ipertesi con iperuricemia, utilizzando misurazioni della pressione arteriosa ambulatoriale (ABPM) (30). I risultati complessivi non hanno mostrato differenze significative tra l’inibitore della xantina ossidasi e il placebo nel cambiamento della ABPM. Tuttavia, è emerso un lieve ma significativo decremento della pressione arteriosa sistolica alla settimana 6 nei soggetti con funzione renale normale trattati con l’inibitore della xantina ossidasi (30).
Una significativa riduzione della pressione arteriosa in corso di terapia ipouricemizzante è stata descritta anche in anziani ipertesi con recente attacco ischemico transitorio, in diabetici iperuricemici ed in pazienti con preipertensione e livelli di uricemia ai limiti alti della norma (6,0-6,2 mg/dl) nei quali il trattamento con allopurinolo ha anche determinato un miglioramento del profilo pressorio notturno (29). È interessante notare come questi benefici della terapia ipouricemizzante sulla pressione arteriosa non sono risultati evidenti nei soggetti normouricemici normotesi mentre una modesta riduzione della pressione arteriosa in corso di terapia ipouricemizzante è stata osservata in soggetti normotesi con iperuricemia asintomatica (29). Queste evidenze suggeriscono che la terapia con inibitori della xantina ossidasi non ha alcun effetto rilevante sulla pressione arteriosa di soggetti normotesi, soprattutto se questi sono anche normouricemici.
Indipendentemente dalla tendenza dell’iperuricemia a combinarsi con gli altri fattori di rischio cardiovascolare è di non poca rilevanza fisiopatologica la dimostrazione derivante da diversi studi epidemiologici che l’iperuricemia è un predittore indipendente di eventi cardiovascolari a conferma dell’ipotesi di una diretta lesività vascolare dell’iperuricemia suggerita dei modelli fisiopatologici.
Fisiopatologia del danno cardiovascolare da acido urico nel paziente iperteso
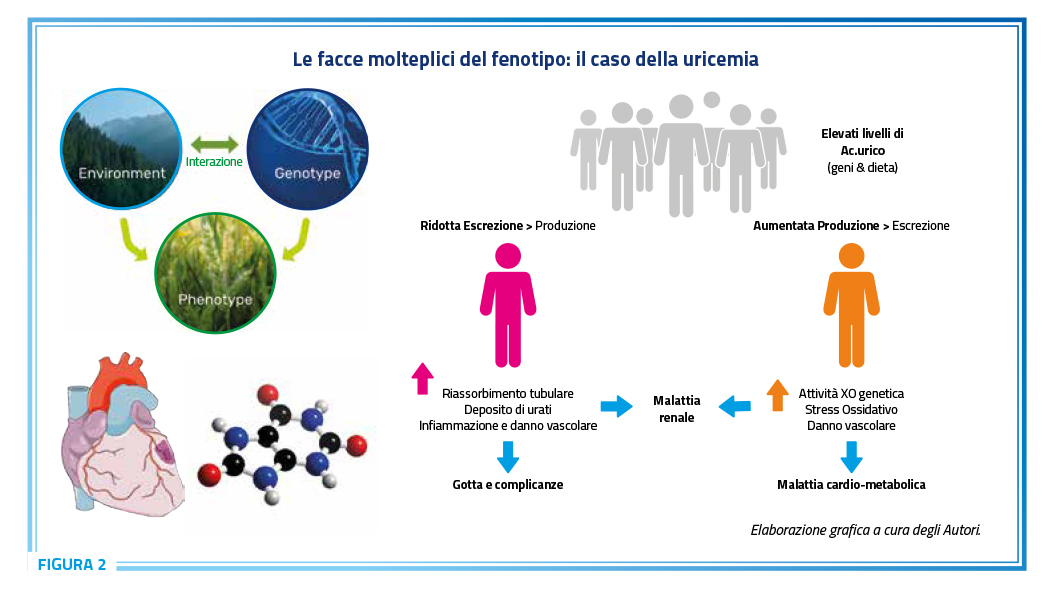
Nonostante le robuste evidenze suggestive di uno stretto nesso patogenetico tra iperuricemia con o senza depositi di urato e malattie cardiovascolari, la possibilità di poter derivare una protezione cardiovascolare attraverso la riduzione dei livelli circolanti di acido urico è ancora tema di discussione. Invero, a fronte di evidenze di studi osservazionali suggestive di un effetto protettivo derivante dalla riduzione dei livelli circolanti di acido urico, soprattutto se ottenuta con inibitori della xantina ossidasi, i risultati degli studi randomizzati controllati sono scarsi e piuttosto contradditori (21). Queste discrepanze, invero, potrebbero riflettere l’esistenza di fenotipi diversi di pazienti iperuricemici con una distribuzione non omogena dei benefici della terapia ipouricemizzante (Figura 2).
In principio c’erano i cristalli……
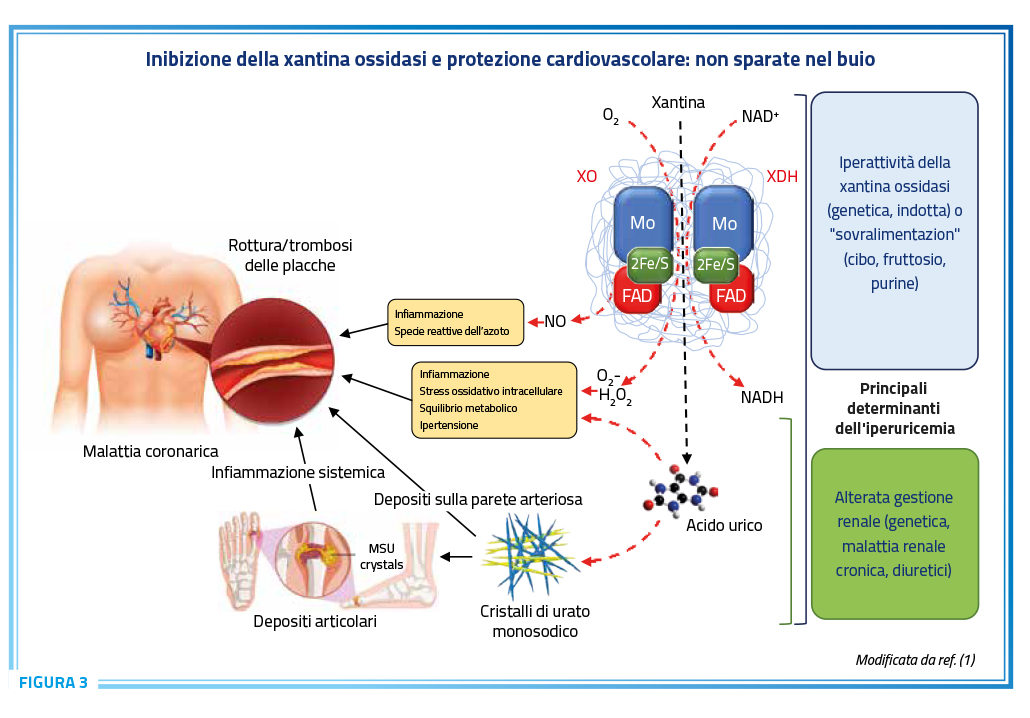
La relazione tra dismetabolismo dell’acido e malattie cardiovascolari è supportata da numerose evidenze epidemiologiche che dimostrano un aumento significativo del rischio di morte per malattie cardiovascolari e malattia coronarica nei pazienti con malattia da depositi di urato (21,31). Da un punto di vista fisiopatologico questa associazione potrebbe essere spiegata dalla precipitazione di cristalli di urato monosodico sia a livello articolare che extraarticolare, compresa la parete vascolare, da cui deriva un’infiammazione cronica a livello vascolare e sistemico, caratteristica fisiopatologica della malattia da depositi di urato sia nella fase subclinica che durante le riacutizzazioni (1,32,33). L’evidenza di una maggiore estensione della patologia aterosclerotica a livello coronarico nei pazienti con depositi di urato subclinici ben supporta questa interpretazione fisiologica suggestiva di un ruolo patogenetico importante dello stato infiammatorio legato alla presenza di depositi, non necessariamente sintomatici in chiave artritica, di cristalli di urato monosodico (Figura 3) (1).
Un primo fenotipo di paziente ad aumentato rischio di eventi cardiovascolari legato agli aumentati livelli circolanti di acido urico è rappresentato, quindi, dal paziente con malattia da depositi di urato sia subclinica che clinicamente manifesta.
La relazione fisiopatologica tra depositi di urato ed ipertensione arteriosa verosimilmente vede nel rene il protagonista principale. Nei modelli sperimentali di ipertensione iperuricemica, infatti, la risposta pressoria al trattamento ipouricemizzante si riduce progressivamente in relazione alla comparsa ed alla progressione della nefropatia gottosa (29). Nei pazienti con nefropatia gottosa, caratterizzata dalla formazione di depositi di cristalli di urato monosodico, infiammazione interstiziale cronica, danno arteriolare e fibrosi renale (34), le linee guida raccomandano la riduzione dei livelli circolanti di acido urico (16,35). Nei pazienti con gotta refrattaria la riduzione della uricemia ottenuta in corso di trattamento con pegloticasi, uricasi ricombinante coniugata con glicole polietilenico, è risultata associata ad una significativa riduzione della pressione arteriosa indipendentemente dalle variazioni della funzione renale (36).
È importante sottolineare come una quota non trascurabile di malattia da depositi di urato decorra in forma subclinica e non venga, quindi, diagnosticata. In oltre un quinto dei pazienti con iperuricemia sono evidenti depositi articolari di urato monosodico apprezzabili all’esame ecografico (37), percentuale che sale da un quarto usando Dual Energy CT (38). Questo aspetto appare di non trascurabile rilevanza in quanto la presenza di depositi di urato monosodico rappresenta una indicazione all’uso della terapia ipouricemizzante che deve mirare a raggiungere livelli di uricemia <6 mg/dL al fine di favorire la dissoluzione dei depositi già presenti e prevenirne la formazione di altri (16,35). In questi pazienti la terapia ipouricemizzante, raccomandata dalle linee guida, ha tutte le potenzialità biologiche per esercitare anche rilevanti effetti favorevoli a livello cardiovascolare.
….poi venne il momento dell’acido urico
L’infiammazione promossa dalla deposizione dei cristalli di urato monosodico non può spiegare interamente la relazione tra acido urico e malattie cardiovascolari in quanto tale relazione è già evidente per i livelli normali-alti di acido urico (5,0–5,5 mg/dL), ampiamente al di sotto della soglia di saturazione dell’urato monosodico (39,40). Invero, dal punto di vista fisiopatologico acido urico può modificare le proprie proprietà biologiche in base alle concentrazioni raggiunte nei fluidi biologici e alla presenza di condizioni ambientali concomitanti. In particolare, le proprietà antiossidanti descritte per bassi livelli sierici di acido urico possono trasformarsi in proprietà pro-ossidanti già per livelli sierici ai limiti alti della norma (21,40). I meccanismi cellulari sottesi all’aumento della pressione arteriosa nel paziente iperuricemico coinvolgono sia la produzione intracellulare di acido urico (via xantina ossidasi) che la captazione di acido urico circolante (41). L’accumulo di acido urico all’interno delle cellule della parete vascolare determina un aumento dello stress ossidativo che a sua volta induce disfunzione endoteliale ed attivazione proaterogena dell’endotelio vascolare (21,40).
Sulla base di queste evidenze dovremmo, quindi, considerare un secondo fenotipo di paziente nel quale l’aumento del rischio cardiovascolare da acido urico è direttamente riconducibile all’effetto proossidante di questa molecola, indipendentemente dalla presenza di depositi di cristalli di urato monosodico. Per questa tipologia di pazienti non vi è ancora una indicazione alla terapia ipouricemizzante anche se alcune interessanti evidenze epidemiologiche suggeriscono possibili benefici derivanti in questi pazienti dalla riduzione dei livelli circolanti di acido urico.
Alla fine arrivò la xantina ossidasi a chiudere il cerchio
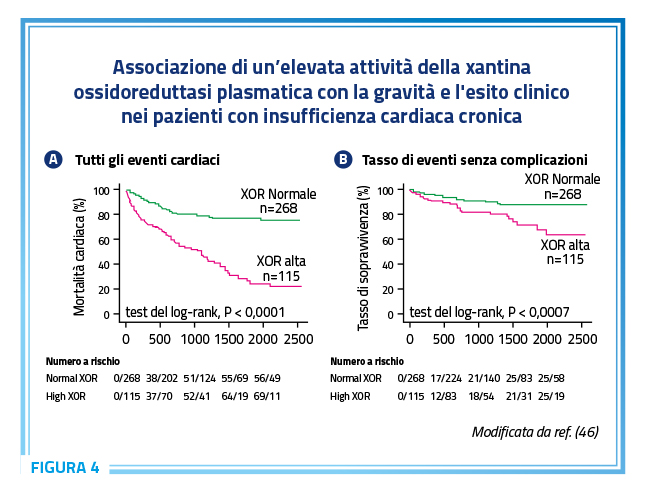
Evidenze derivanti da studi di randomizzazione mendeliana indicano che livelli sierici di acido urico geneticamente elevati per effetto della riduzione dell’attività dei sistemi di trasporto a livello renale sono associati ad un aumento del rischio di presentare malattia da depositi di urato ma non del rischio di sviluppare malattie cardiovascolari o disturbi metabolici (40). All’opposto, i polimorfismi genetici della xantina ossidasi, la principale attività enzimatica responsabile della generazione di acido urico, sono associati a variazioni incrementali della pressione arteriosa e ad un aumentato rischio di sviluppare ipertensione (42). In linea con queste evidenze, una aumentata prevalenza di ipertensione arteriosa è stata osservata nei pazienti con aumentati livelli di attività della xantina ossidasi (43). Da un punto di vista fisiopatologico, la xantina ossidasi ha tutta la capacità biologica di influenzare profondamente lo sviluppo di malattie cardiovascolari e metaboliche (44). Infatti, l’attività della xantina ossidasi è associata alla produzione sia di specie reattive dell’ossigeno che di acido urico con importanti ricadute fisiopatologiche, inclusa una risposta proinfiammatoria e protrombotica a livello endoteliale. Inoltre, l’aumentata attività della xantina ossidasi circolante è associata ad ipertensione, dislipidemia, diabete e può contribuire alla patogenesi dell’aterosclerosi. È interessante notare un più evidente effetto predittivo dei livelli circolanti di acido urico nei confronti degli eventi cardiovascolari nelle pazienti di sesso femminile nelle quali la presenza di estrogeni, noti per esercitare un potente effetto uricosurico, tenderebbe a condizionare più bassi livelli circolanti di acido urico (1,45). Queste evidenze possono suggerire una predominanza della generazione di acido urico da parte della xantina ossidasi nelle donne che supera i pur rilevanti effetti uricosurici degli estrogeni (1,45). È interessante notare che più elevati livelli di attività della xantina ossidasi plasmatica sono associati ad un aumento del rischio di eventi cardiovascolari e di mortalità cardiaca nei pazienti con insufficienza cardiaca cronica nei quali, tuttavia, anche una bassa attività plasmatica della xantina ossidasi è associata ad una prognosi sfavorevole (Figura 4) (46). Ciò suggerisce la possibilità di una relazione a “curva J” tra attività plasmatica della xantina ossidasi e outcome clinico, con una associazione dei livelli sia bassi che alti di attività della xantina ossidasi con un aumento del rischio di eventi cardiovascolari (46). Questi risultati non sono sorprendenti considerando i molteplici effetti fisiologici derivanti dall’attività della xantina ossidasi, potenzialmente protettivi a livello cardiovascolare, tra cui la modulazione dell’immunità innata, dell’equilibrio redox, dell’attivazione endoteliale, del tono vascolare, della pressione sanguigna, dell’accumulo di grasso e del rilascio di ossido nitrico (44). Questa ambivalenza di effetti biologici della xantina ossidasi potrebbe rappresentare un punto critico nel processo decisionale sul possibile utilizzo degli inibitori della xantina ossidasi in prevenzione cardiovascolare. Teoricamente, i pazienti con un’elevata attività della xantina ossidasi dovrebbero essere i candidati ideale per una strategia di prevenzione cardiovascolare attraverso l’inibizione della xantina ossidasi, mentre questo trattamento potrebbe non avere successo, o essere potenzialmente dannoso, nei pazienti con una bassa attività della xantina ossidasi. A supporto di questa ipotesi, alcune evidenze epidemiologiche suggeriscono come l’uso di allopurinolo si associ a un ridotto rischio di eventi cardiovascolari, ma questa associazione non è evidente nei pazienti che assumono alte dosi di farmaco (>300 mg/die) (47). Questa potenziale dualità di effetti potrebbe spiegare la mancata evidenza di un effetto protettivo di alte dosi di allopurinolo in pazienti con insufficienza cardiaca e frazione di eiezione ridotta arruolati nello studio Xanthine Oxidase Inhibition for Hyperuricemic Heart Failure Patients – EXACT-HF (48). In questo studio i risultati deludenti potrebbero essere la conseguenza di un bilanciamento tra l’effetto protettivo associato all’inibizione della xantina ossidasi in alcuni pazienti e il risultato potenzialmente negativo in altri. Invero, è lecito ipotizzare che l’effetto protettivo della terapia ipouricemizzante, segnatamente con inibitori della xantina ossidasi, possa essere efficace laddove il sistema metabolico che genera acido urico sia adeguatamente attivo. Questo potrebbe essere la chiave interpretativa più plausibile per spiegare l’assenza di un effetto protettivo della inibizione della xantina ossidasi con allopurinolo nei pazienti con malattia coronarica stabile arruolati nello studio ALL-HEART che nella generalità dei casi non erano iperuricemici (19). Nella loro globalità questi risultati suggeriscono la possibilità che sia l’inibizione della xantina ossidasi più che il controllo dei livelli circolanti di acido urico il determinante principale di una eventuale protezione cardiovascolare, probabilmente in ragione del fatto che questo approccio gestionale consente di ridurre i livelli circolanti di acido urico e, quindi, di prevenire la formazione di depositi di cristalli di urato monosodico e l’accumulo intracellulare di acido urico, ma al tempo stesso attenua anche la produzione di specie reattive dell’ossigeno (1,21,40). Un terzo e probabilmente più rilevante fenotipo fisiopatologico potrebbe essere, quindi, rappresentato da pazienti con iperattività della xantina ossidasi dovuta a fattori genetici o acquisiti o all’eccesso di substrato, ad esempio a causa di un aumentato apporto dietetico di fruttosio o alimenti ricchi di purine (1).
Ipertensione ed iperuricemia: risvolti terapeutici
La mole di evidenze che legano il metabolismo dell’acido urico all’aumento dei valori pressori e, più in generale, alle problematiche cardio-nefro-metaboliche (21,27,40) è tale da giustificare appieno la crescente attenzione posta dalle linee guida al monitoraggio dell’uricemia nel paziente iperteso (2-4). A tale riguardo non appare inutile richiamare l’attenzione sulla definizione di iperuricemia in quanto fino ad un recente passato regnava una certa confusione intorno al valore desiderabile di uricemia in ragione della individuazione di due distinti intervalli di riferimento per l’uricemia: 3,5-7,2 mg/dL nei maschi adulti e nelle donne in postmenopausa e 2,6-6,0 mg/dL nelle donne in età premenopausale (49). Questa differenziazione dipendeva dal fatto che nelle donne in età fertile l’uricemia tende ad essere più bassa per l’effetto uricosurico degli estrogeni. Attualmente l’orientamento prevalente è quello di individuare il limite superiore dell’intervallo di riferimento dell’uricemia negli esseri umani sostanzialmente nel limite di solubilità della molecola, in quanto la sua lesività articolare di acido urico dipende proprio dalla precipitazione dell’urato monosodico con formazione di cristalli (49,50). A conferma di ciò, le linee guida internazionali per la gestione della iperuricemia cronica con deposito di urato raccomandano di mantenere i livelli circolanti di acido urico al limite minimo di 6 mg/dL (o <5mg/dL nelle forme più severe di gotta) al fine di prevenire la formazione di depositi di urato, promuovere la dissoluzione dei depositi già presenti e prevenire le riacutizzazioni artritiche (16,35). È interessante notare che l’influenza dell’acido urico sulla fisiopatologia cardiovascolare comincia ad estrinsecarsi per livelli circolanti di 5,0-5,5 mg/dl, inferiori al limite di solubilità della molecola e, quindi, largamente indipendenti dalla precipitazione di cristalli di urato monosodico, essenza fisiopatologica della gotta (39,49-51). Anche la relazione tra uricemia, dismetabolismo glicidico (52) e sindrome metabolica (53) sembra concretizzarsi per valori di uricemia inferiori, o al massimo prossimi, al limite di solubilità della molecola. Alla luce delle evidenze scientifiche la soglia di normalità per l’uricemia non può che corrispondere a quei 6 mg/dL che le raccomandazioni internazionali già suggeriscono come obiettivo da raggiungere per il paziente con iperuricemia cronica con deposito di urato (16,35). Questo livello desiderabile è senza dubbio quello che ha le maggiori possibilità di intercettare la totalità della lesività dell’acido urico, obiettivo che sempre ci si dovrebbe prefiggere nella definizione di ogni intervallo di normalità (49).
I risvolti applicativi del riscontro di aumentati livelli circolanti di acido urico nel paziente iperteso sono rappresentati in primo luogo dalla correzione dei determinanti causali, ove evidenti, per poi considerare interventi specifici in caso di risposta non adeguata. Si è già detto della possibilità che alcuni farmaci di uso comune nell’ipertensione arteriosa, i diuretici tiazidici e dell’ansa, possano incrementare in varia misura i livelli circolanti di acido urico mentre per altri è noto un effetto neutro, come per calcio antagonisti, ACE-inibitori e inibitori recettoriali dell’angiotesina II (21,23). Nel caso in cui il paziente iperteso iperuricemico stiano assumendo farmaci potenzialmente iperuricemizzanti appare evidente l’opportunità di rimodulare, ove possibile la terapia (2). In ambito cardiovascolare merita menzione l’evidenza di un effetto favorevole sull’uricemia dei farmaci SGLT2 inibitori le cui potenzialità protettive a livello cardiovascolare potrebbero almeno in parte dipendere proprio da una riduzione dell’uricemia (54,55). Nel caso in cui il paziente presenti un variabile grado di eccedenza ponderale la riduzione del peso corporeo appare mandatoria per i suoi ben documentati effetti benefici sia sulla pressione arteriosa che sui livelli circolanti di acido urico (35). Le diete completamente apuriniche sono poco palatabili e, conseguentemente, non molto gradite da parte dei pazienti anche in ragione dell’efficacia piuttosto modesta nel ridurre l’uricemia a meno che i pazienti non seguano una alimentazione particolarmente iperuricemizzante, ad esempio per un eccesso di cibi carnei o di fruttosio.
La terapia ipouricemizzante trova una specifica indicazione in presenza di depositi di urato, condizione invero ben più frequente di quanto si possa immaginare in quanto l’attacco artritico acuto che caratterizza la gotta rappresenta solo la punta dell’iceberg della malattia da deposito di urato. Una quota non trascurabile di pazienti iperuricemici presentano depositi subclinici di urato monosodico che nel tempo determinano un variabile grado di danno a livello articolare, pur senza raggiungere l’estrinsecazione clinica tipica dell’attacco gottoso acuto (37,38,56). Questi depositi articolari di urato monosodico si riducono fino a scomparire in corso di terapia ipouricemizzante (57). L’assenza di aspetti clinici di artrite acuta non esclude certamente la presenza di un danno articolare sottostante, evidenza che suggerisce l’opportunità di una rivisitazione del concetto di “iperuricemia asintomatica”. Peraltro, lo stato infiammatorio cronico associato a questi depositi subclinici può favorire lo sviluppo e la progressione del danno vascolare aterosclerotico (58). A ciò si aggiunga che non di rado l’artrite gottosa, sia pur sintomatica, decorre misconosciuta perché confusa con una condizione di osteoartrite in ragione di un decorso spesso paucisintomatico, soprattutto negli anziani, e con un interessamento poliarticolare al posto del classico attacco di “podagra” a carico della prima articolazione metatarso-falangea.
Il corretto inquadramento del paziente iperteso iperuricemico è, quindi, di notevole rilevanza pratica in quanto la presenza di depositi tissutali di urato monosodico rappresenta una chiara indicazione alla terapia ipouricemizzante il cui obbiettivo deve essere il raggiungimento del target minimo di 6 mg/dL che deve poi essere mantenuto nel tempo per evitare che si formino nuovi depositi di urato e favorire la dissoluzione dei depositi già presenti (16,35). La presenza di tali depositi va sospettata in tutti i pazienti con iperuricemia sostenuta, soprattutto se di lunga durata, in quanto il raggiungimento della soglia di saturazione dell’acido – 6,8 mg/dL a 37° e a temperatura e pH fisiologici – comporta la frequente precipitazione di cristalli di urato monosodico (59).
Sicurezza e maneggevolezza della terapia ipouricemizzante
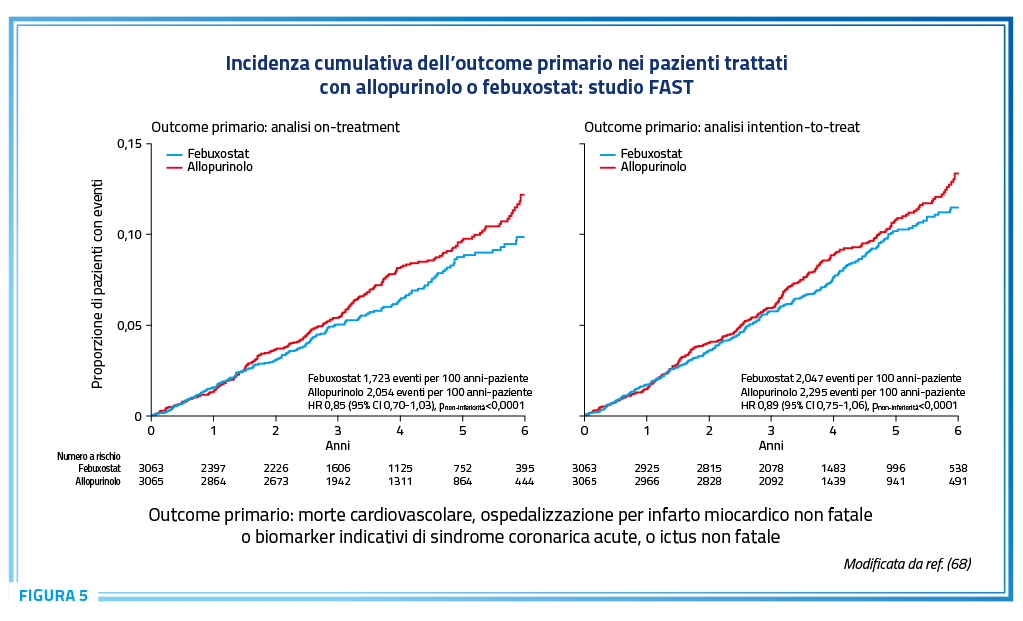
La terapia ipouricemizzante di riferimento nei pazienti con malattia da depositi di urato è rappresentata dagli inibitori della xantina-ossidasi, allopurinolo e febuxostat (35). Allopurinolo chimicamente è un analogo purinico, originariamente sintetizzato nell’ambito di un programma di sviluppo di farmaci antibatterici e chemioterapici (60). Questo farmaco è un inibitore relativamente debole della xantina ossidasi che a basse dosi agisce come substrato per questo enzima (“inibitore suicida”) mentre ad alte dosi si comporta come un inibitore non competitivo (61,62). Allopurinolo viene metabolizzato ad ossipurinolo, metabolita attivo che viene eliminato dal rene. A differenza di allopurinolo e del suo metabolita attivo ossipurinolo, febuxostat non è un composto purino-simile ma è un derivato dell’acido tiazolidin-carbossilico che ha la peculiare capacità di inibire selettivamente sia la forma ridotta che la forma ossidata della xantina ossidasi (63-65) con una potenza da 10 a 30 volte superiore rispetto a quella di allopurinolo (66). Febuxostat presenta una doppia via di eliminazione, epatica e renale, ragione per cui non ne è richiesto alcun aggiustamento posologico nei pazienti con insufficienza renale di grado I-III (67), condizione non infrequente nei pazienti iperuricemici e/o gottosi (49). Queste caratteristiche di febuxostat ne rendono particolarmente vantaggioso l’uso nei pazienti che non raggiungono il target terapeutico in corso di trattamento con allopurinolo o che non tollerano questo farmaco, invero non scevro di effetti indesiderati. La sicurezza cardiovascolare di questi 2 inibitori della xantina ossidasi è stata oggetto di un confronto diretto nel Febuxostat versus Allopurinol Streamlined Trial (FAST), recentemente pubblicato (68). Lo studio era stato specificatamente richiesto dalla European Union Risk Management Plan per verificare la sicurezza cardiovascolare di febuxostat rispetto al trattamento standard con allopurinolo. Lo studio, prospettico, randomizzato, in aperto con valutazione in cieco degli endpoint, ha confrontato febuxostat (80-120 mg/die) e allopurinolo con disegno di non-inferiorità, ha arruolato 6.128 pazienti con gotta (85,3% di sesso maschile) ed almeno un fattore di rischio cardiovascolare aggiuntivo, precedentemente trattati con allopurinolo. I pazienti sono stati seguiti nel corso di un tempo mediano di 1.467 giorni (range interquartile 1.029-2.052 giorni) con un periodo mediano di follow-up in trattamento di 1.324 giorni (range interquartile 870-1.919 giorni, 3,63 anni). Febuxostat è risultato non inferiore ad allopurinolo per l’endpoint primario (un composito di ospedalizzazione per infarto miocardico non fatale o riscontro di un aumento dei biomarker sindrome coronarica acuta, ictus non fatale o morte cardiovascolare) nell’analisi on-treatment (hazard ratio aggiustato pari a 0,85, intervallo di confidenza al 95% compreso tra 0,70 e 1,03, limite di non inferiorità pari a 1,3), risultato confermato nell’analisi intention-to-treat (Figura 5) (68). La non inferiorità di febuxostat è risultata evidente anche per vari outcome secondari compresa la morte per cause cardiovascolari (hazard ratio aggiustato pari a 0,91, intervallo di confidenza al 95% compreso tra 0,66 e 1,27) e per tutte le cause (hazard ratio aggiustato pari a 0,75, intervallo di confidenza al 95% compreso tra 0,59 e 0,95). L’elemento di maggiore solidità dello studio FAST è rappresentato dalla qualità del follow-up (68). Soltanto il 5,5% dei pazienti nel gruppo allopurinolo ed il 6,2% dei pazienti nel gruppo febuxostat sono stati persi nel corso del follow-up. La percentuale di discontinuazione del trattamento è risultata pari a 16,5% nel braccio allopurinolo e 32,4% nel gruppo febuxostat.
I risultati dello studio FAST, decisamente robusti, forniscono una possibile chiave interpretativa dei risultati di un precedente studio di confronto tra allopurinolo e febuxostat in tema di sicurezza cardiovascolare, lo studio Cardiovascular Safety of Febuxostat and Allopurinol in Patients with Gout and Cardiovascular Morbidities (CARES), che aveva evidenziato una frequenza di eventi cardiovascolari simile nei due bracci di trattamento, ma con un rischio di mortalità cardiovascolare e totale risultato, nell’analisi intention-to-treat, marginalmente più elevato nei pazienti trattati con febuxostat rispetto a quanto osservato nei pazienti trattati con allopurinolo (69). Nell’interpretazione di questi risultati va sottolineato come lo studio CARES, con disegno di non inferiorità, non prevedesse un braccio placebo. Conseguentemente, la succitata differente frequenza di mortalità nei 2 bracci di trattamento poteva esprimere, al massimo, una minore efficacia protettiva di febuxostat nei confronti di allopurinolo (69). Invero, lo studio CARES presenta molte limitazioni che ne minano non poco la solidità dei risultati. La cosa che più immediatamente balza agli occhi è la prematura discontinuazione del trattamento, soprattutto entro i primi 24 mesi dalla randomizzazione, da parte della larga maggioranza dei pazienti (55,9% per allopurinolo e 57,3 per febuxostat). Questo aspetto assume particolare significato in relazione alla constatazione che la quota maggiore dell’eccesso di mortalità osservato nei pazienti trattati con febuxostat è stata registrata dopo la discontinuazione dei trattamenti mentre nella fase antecedente il picco della discontinuazione medesima (2 anni) il trend della mortalità è stato esattamente l’opposto, con un possibile vantaggio di febuxostat (69). È evidente che una analisi intention-to-treat, certamente vantaggiosa nel replicare un contesto di mondo reale, perde molta della sua validità intrinseca in presenza di un tasso di discontinuazione così elevato e soprattutto per una valutazione della sicurezza, in cui l’analisi “on-treatment” è assai probabilmente da preferire. Peraltro, i pazienti arruolati nello studio CARES, in ragione del loro elevato profilo di rischio cardiovascolare, erano trattati con farmaci ipolipidemizzanti, antiaggreganti, ipoglicemizzanti ed antipertensivi, che in varia misura potrebbero avere modificato da un lato il profilo di rischio dei pazienti e dall’altro i livelli di uricemia (69). Nello studio, tuttavia, non viene fatta menzione del profilo lipidico dei pazienti o dei concomitanti trattamenti assunti dai pazienti.
Le conclusioni dello studio CARES differiscono sostanzialmente da quelle dello studio FAST per ciò che riguarda gli outcome secondari, nonostante le dimensioni simili dei due studi. Lo studio CARES, infatti, aveva evidenziato nei pazienti trattati con febuxostat un eccesso di mortalità cardiovascolare (hazard ratio pari a 1,34, intervallo di confidenza al 95% compreso tra 1,03 e 1,73) e per tutte le cause (hazard ratio pari a 1,22, intervallo di confidenza al 95% compreso tra 1,01 e 1,47) durante un periodo di osservazione esteso a 30 giorni dopo la fine del periodo di trattamento. Questo eccesso di eventi non è stato osservato nello studio FAST, anche in una analisi di sensibilità estesa a 90 giorni dopo il termine di trattamento. L’osservazione estesa oltre la fine del trattamento farmacologico nello studio FAST, inoltre, ha consentito di intercettare i decessi di quei pazienti che avevano interrotto il trattamento dopo un evento cardiovascolare e che erano deceduti successivamente. Il numero di pazienti nei quali si sono verificati gli eventi fatali non è ben chiaro nello studio CARES perché il 45,0% dei partecipanti avevano interrotto il follow-up. Tuttavia, l’eccesso di mortalità non è più risultato significativo quando sono stati contati dai database pubblici i decessi inizialmente non aggiudicati. Comunque, è bene sottolineare come sia lo studio CARES che lo studio FAST abbiano entrambi mostrato la non inferiorità di febuxostat vs allopurinolo per l’outcome primario. Risulta pertinente sottolineare come i pazienti arruolati negli studi CARES e FAST presentassero alcune differenze non trascurabili. I pazienti arruolati nello studio CARES, infatti, avevano una gotta più severa di quelli arruolati nello studio FAST con il 72% dei pazienti arruolati nel CARES che non avevano mai ricevuto un trattamento ipouricemizzante. Ma, soprattutto, i pazienti arruolati nel CARES avevano tutti una storia di malattia cardiovascolare mentre nel FAST poco più di un terzo dei pazienti riferiva storia di eventi cardiovascolari pregressi (2.046 su 6.128, 33,4%). In questo sottogruppo di pazienti arruolati nello studio FAST non è stato osservato, tuttavia, un eccesso di mortalità anche se il numero di pazienti potrebbe essere stato insufficiente a definire con certezza il potenziale rischio legato all’uso di febuxostat in pazienti con patologia cardiovascolare severa. Lo studio CARES ha incluso anche una quota di pazienti con scompenso cardiaco (il 20% dei partecipanti) mentre nello studio FAST sono stati esclusi i pazienti con scompenso cardiaco in classe NYHA III-IV, di cui è ben noto l’alto rischio di morte. Le dosi giornaliere di febuxostat utilizzate nello studio FAST (80 mg/die o 120 mg/die) sono risultate più alte rispetto a quelle usate nel CARES (40 mg/die o 80 mg/die) ed il range di dose di allopurinolo è risultato più ampio nel FAST (100-900 mg/die) rispetto al CARES (200-600 mg/die).
I risultati dello studio FAST appaiono robusti e rassicuranti in merito alla sicurezza cardiovascolare di febuxostat nella larga maggioranza dei pazienti affetti da malattia da depositi di urato. Invero, i risultati dello studio CARES sembrano rappresentare una sorta di voce fuori dal coro. Una meta-analisi di 25 studi non ha mostrato, infatti, differenze tra febuxostat ed allopurinolo in termini di occorrenza di eventi cardiovascolari (rischio relativo pari a 1,69 con un intervallo di confidenza al 95 compreso tra 0,54 e 5,34, p = 0,37) (70).
Conclusioni
La particolare attenzione rivolta dalle linee guida 2023 della European Society of Hypertension esprime il crescente interesse che la letteratura sta rivolgendo da alcuni anni a questa parte all’acido urico come determinante di una quota non trascurabile di rischio cardiovascolare. Questa “relazione pericolosa” tra acido urico e malattie cardiovascolari sembra cominci a delinearsi già per valori di uricemia al di sotto della soglia di 6 mg/dL che le raccomandazioni internazionali suggeriscono come target terapeutico per i pazienti con iperuricemia cronica con depositi di urato. Inoltre, esiste la possibilità che ciò che si vede, i livelli di acido urico, siano solo la parte emersa di un più ampio meccanismo di danno vascolare che potrebbe risiedere nella produzione esagerata o nella mancata clearance di alcuni prodotti intermedi della sintesi dello stesso con attività pro-ossidante la cui capacità di nuocere sarebbe proporzionale allo stato ossidativo di base del soggetto o alla efficienza del sistema anti-ossidante. È possibile, quindi, che analoghi livelli di acido urico circolante possano svolgere una diversa azione nociva in ragione della labilità del substrato vascolare nei confronti degli stessi o del meccanismo biochimico che ha contributo a generarli. Invero, le evidenze attualmente disponibili suggeriscono la possibilità che dietro gli stessi livelli di acido urico si debbano immaginare fenotipi diversi, identificabili in base a meccanismi fisiopatologici prevalenti, individualmente coinvolti nella relazione tra metabolismo dell’acido urico e malattia cardiovascolare. In particolare, per prima cosa dovremmo considerare l’infiammazione sistemica correlata ai depositi di urato monosodico, sia subclinici che clinicamente manifesti. Questo percorso fisiopatologico è probabilmente responsabile di quota rilevante del carico di malattie cardiovascolari legate al metabolismo dell’acido urico. Una quota ancor più rilevante del rischio cardiovascolare legato all’acido urico è probabilmente da ascrivere al livello di attività della xantina ossidasi, enzima chiave del metabolismo dell’acido urico e target ideale di una ipotetica strategia di prevenzione cardiovascolare nei pazienti iperuricemici. I diversi fenotipi fisiopatologici potrebbero essere parzialmente embricati ma con un impatto diverso in vari sottogruppi di pazienti. Ovviamente, questa fenotipizzazione è meno rilevante nei pazienti con depositi di urato monosodico, sia subclinici che clinicamente manifesti, per i quali comunque esiste una chiara indicazione alla terapia con inibitori della xantina ossidasi, farmaci che, vale la pena ribadirlo, attualmente restano indicati per il trattamento dell’iperuricemia cronica con deposito di urato.
Bibliografia
- Desideri G, Borghi C. Xanthine oxidase inhibition and cardiovascular protection: Don’t shoot in the dark. Eur J Intern Med. 2023 Jul;113:10-12.
- Mancia G, Kreutz R, Brunström M, Burnier M, Grassi G, Januszewicz A, Muiesan ML, Tsioufis K, Agabiti-Rosei E, Algharably EAE, Azizi M, Benetos A, Borghi C, Hitij JB, Cifkova R, Coca A, Cornelissen V, Cruickshank JK, Cunha PG, Danser AHJ, Pinho RM, Delles C, Dominiczak AF, Dorobantu M, Doumas M, Fernández-Alfonso MS, Halimi JM, Járai Z, Jelaković B, Jordan J, Kuznetsova T, Laurent S, Lovic D, Lurbe E, Mahfoud F, Manolis A, Miglinas M, Narkiewicz K, Niiranen T, Palatini P, Parati G, Pathak A, Persu A, Polonia J, Redon J, Sarafidis P, Schmieder R, Spronck B, Stabouli S, Stergiou G, Taddei S, Thomopoulos C, Tomaszewski M, Van de Borne P, Wanner C, Weber T, Williams B, Zhang ZY, Kjeldsen SE. 2023 ESH Guidelines for the management of arterial hypertension The Task Force for the management of arterial hypertension of the European Society of Hypertension: Endorsed by the International Society of Hypertension (ISH) and the European Renal Association (ERA). J Hypertens. 2023 Dec 1;41(12):1874-2071.
- Williams B, Mancia G, Spiering W, Agabiti Rosei E, Azizi M, Burnier M, Clement DL, Coca A, de Simone G, Dominiczak A, Kahan T, Mahfoud F, Redon J, Ruilope L, Zanchetti A, Kerins M, Kjeldsen SE, Kreutz R, Laurent S, Lip GYH, McManus R, Narkiewicz K, Ruschitzka F, Schmieder RE, Shlyakhto E, Tsioufis C, Aboyans V, Desormais I; Authors/Task Force Members:. 2018 ESC/ESH Guidelines for the management of arterial hypertension: The Task Force for the management of arterial hypertension of the European Society of Cardiology and the European Society of Hypertension: The Task Force for the management of arterial hypertension of the European Society of Cardiology and the European Society of Hypertension. J Hypertens. 2018 Oct;36(10):1953-2041.
- Unger T, Borghi C, Charchar F, Khan NA, Poulter NR, Prabhakaran D, Ramirez A, Schlaich M, Stergiou GS, Tomaszewski M, Wainford RD, Williams B, Schutte AE. 2020 International Society of Hypertension Global Hypertension Practice Guidelines. Hypertension. 2020 Jun;75(6):1334-1357.
- Yang YL, Xiang ZJ, Yang JH, Wang WJ, Xu ZC, Xiang RL. Association of β-blocker use with survival and pulmonary function in patients with chronic obstructive pulmonary and cardiovascular disease: a systematic review and meta-analysis. Eur Heart J. 2020 Dec 7;41(46):4415-4422.
- Hansildaar R, Vedder D, Baniaamam M, Tausche AK, Gerritsen M, Nurmohamed MT. Cardiovascular risk in inflammatory arthritis: rheumatoid arthritis and gout. Lancet Rheumatol. 2021 Jan;3(1):e58-e70.
- Krishnan E, Kwoh CK, Schumacher HR, Kuller L. Hyperuricemia and incidence of hypertension among men without metabolic syndrome. Hypertension. 2007 Feb;49(2):298-303.
- Bombelli M, Ronchi I, Volpe M, Facchetti R, Carugo S, Dell’oro R, Cuspidi C, Grassi G, Mancia G. Prognostic value of serum uric acid: new-onset in and out-of-office hypertension and long-term mortality. J Hypertens. 2014 Jun;32(6):1237-44.
- Cicero AF, Salvi P, D’Addato S, Rosticci M, Borghi C; Brisighella Heart Study group. Association between serum uric acid, hypertension, vascular stiffness and subclinical atherosclerosis: data from the Brisighella Heart Study. J Hypertens. 2014 Jan;32(1):57-64.
- Borghi C, Agnoletti D, Cicero AFG, Lurbe E, Virdis A. Uric Acid and Hypertension: a Review of Evidence and Future Perspectives for the Management of Cardiovascular Risk. Hypertension. 2022 Sep;79(9):1927-1936.
- Bhole V, Krishnan E. Gout and the heart. Rheum Dis Clin North Am. 2014 Feb;40(1):125-43.
- Ndrepepa G. Uric acid and cardiovascular disease. Clin Chim Acta. 2018 Sep;484:150-163.
- Agarwal V, Hans N, Messerli FH. Effect of allopurinol on blood pressure: a systematic review and meta-analysis. J Clin Hypertens (Greenwich). 2013 Jun;15(6):435-42.
- Chen JH, Lan JL, Cheng CF, Liang WM, Lin HY, Tsay GJ, Yeh WT, Pan WH. Effect of Urate-lowering Therapy on the Risk of Cardiovascular Disease and All-cause Mortality in Patients with Gout: A Case-matched Cohort Study. J Rheumatol. 2015 Sep;42(9):1694-701.
- Gill D, Cameron AC, Burgess S, Li X, Doherty DJ, Karhunen V, Abdul-Rahim AH, Taylor-Rowan M, Zuber V, Tsao PS, Klarin D; VA Million Veteran Program; Evangelou E, Elliott P, Damrauer SM, Quinn TJ, Dehghan A, Theodoratou E, Dawson J, Tzoulaki I. Urate, Blood Pressure, and Cardiovascular Disease: Evidence From Mendelian Randomization and Meta-Analysis of Clinical Trials. Hypertension. 2021 Feb;77(2):383-392.
- Drosos GC, Vedder D, Houben E, Boekel L, Atzeni F, Badreh S, Boumpas DT, Brodin N, Bruce IN, González-Gay MÁ, Jacobsen S, Kerekes G, Marchiori F, Mukhtyar C, Ramos-Casals M, Sattar N, Schreiber K, Sciascia S, Svenungsson E, Szekanecz Z, Tausche AK, Tyndall A, van Halm V, Voskuyl A, Macfarlane GJ, Ward MM, Nurmohamed MT, Tektonidou MG. EULAR recommendations for cardiovascular risk management in rheumatic and musculoskeletal diseases, including systemic lupus erythematosus and antiphospholipid syndrome. Ann Rheum Dis. 2022 Jun;81(6):768-779.
- Cebollada J, Buisan C. Therapeutic role of colchicine in reducing cardiovascular risk associated with inflammation. Endocrinol Diabetes Nutr (Engl Ed). 2022 Oct;69(8):551-553.
- Burnier M. Gout and hyperuricaemia: modifiable cardiovascular risk factors? Front Cardiovasc Med. 2023 May 25;10:1190069.
- Mackenzie IS, Hawkey CJ, Ford I, Greenlaw N, Pigazzani F, Rogers A, Struthers AD, Begg AG, Wei L, Avery AJ, Taggar JS, Walker A, Duce SL, Barr RJ, Dumbleton JS, Rooke ED, Townend JN, Ritchie LD, MacDonald TM; ALL-HEART Study Group. Allopurinol versus usual care in UK patients with ischaemic heart disease (ALL-HEART): a multicentre, prospective, randomised, open-label, blinded-endpoint trial. Lancet. 2022 Oct 8;400(10359):1195-1205.
- White WB, Saag KG, Becker MA, Borer JS, Gorelick PB, Whelton A, Hunt B, Castillo M, Gunawardhana L; CARES Investigators. Cardiovascular Safety of Febuxostat or Allopurinol in Patients with Gout. N Engl J Med. 2018 Mar 29;378(13):1200-1210.
- Borghi C, Agabiti-Rosei E, Johnson RJ, Kielstein JT, Lurbe E, Mancia G, Redon J, Stack AG, Tsioufis KP. Hyperuricaemia and gout in cardiovascular, metabolic and kidney disease. Eur J Intern Med. 2020 Oct;80:1-11.
- Choi HK, Soriano LC, Zhang Y, Rodríguez LA. Antihypertensive drugs and risk of incident gout among patients with hypertension: population based case-control study. BMJ. 2012 Jan 12;344:d8190.
- Moriwaki, Y. Effects on uric acid metabolism of the drugs except the antihyperuricemics. J. Bioequivalence Bioavailab. 2014,6, 010–017.
- Taneja AK, Gaze D, Coats AJ, Dumitrascu D, Spinarova L, Collinson P, Roughton M, Flather MD; SENIORS Investigators. Effects of nebivolol on biomarkers in elderly patients with heart failure. Int J Cardiol. 2014 Aug 1;175(2):253-60.
- Høieggen A, Alderman MH, Kjeldsen SE, Julius S, Devereux RB, De Faire U, Fyhrquist F, Ibsen H, Kristianson K, Lederballe-Pedersen O, Lindholm LH, Nieminen MS, Omvik P, Oparil S, Wedel H, Chen C, Dahlöf B; LIFE Study Group. The impact of serum uric acid on cardiovascular outcomes in the LIFE study. Kidney Int. 2004 Mar;65(3):1041-9.
- GBD 2019 Risk Factors Collaborators. Global burden of 87 risk factors in 204 countries and territories, 1990-2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet. 2020 Oct 17;396(10258):1223-1249.
- Borghi C, et al. ConsideRazionI Su goTta, Acido urico e rischio cardiovascoLare.Evidenze, aspetti controversi e prospettive future-CRISTAL. Sinergie Edizioni Scientifiche. 2012.
- Mahomed FA. On chronic Bright’s disease, and its essential symptoms. Lancet 1879; I:398–404.
- Sanchez-Lozada LG, Rodriguez-Iturbe B, Kelley EE, Nakagawa T, Madero M, Feig DI, Borghi C, Piani F, Cara-Fuentes G, Bjornstad P, Lanaspa MA, Johnson RJ. Uric Acid and Hypertension: An Update With Recommendations. Am J Hypertens. 2020 Jul 18;33(7):583-594.
- Gunawardhana L, McLean L, Punzi HA, Hunt B, Palmer RN, Whelton A, et al. Effect of Febuxostat on Ambulatory Blood Pressure in Subjects With Hyperuricemia and Hypertension: A Phase 2 Randomized Placebo-Controlled Study. J Am Heart Assoc. 2017 Nov 4;6(11).
- Clarson LE, Chandratre P, Hider SL, Belcher J, Heneghan C, Roddy E, Mallen CD. Increased cardiovascular mortality associated with gout: a systematic review and meta-analysis. Eur J Prev Cardiol. 2015 Mar;22(3):335-43.
- Klauser AS, Halpern EJ, Strobl S, Gruber J, Feuchtner G, Bellmann-Weiler R, Weiss G, Stofferin H, Jaschke W. Dual-Energy Computed Tomography Detection of Cardiovascular Monosodium Urate Deposits in Patients With Gout. JAMA Cardiol. 2019 Oct 1;4(10):1019-1028.
- Diaz-Torne C, Ortiz MA, Garcia-Guillen A, Jeria-Navarro S, Sainz L, Fernandez-Sanchez S, Corominas H, Vidal S. The inflammatory role of silent urate crystal deposition in intercritical gout. Rheumatology (Oxford). 2021 Nov 3;60(11):5463-5472.
- Wang L, Zhang X, Shen J, Wei Y, Zhao T, Xiao N, Lv X, Qin D, Xu Y, Zhou Y, Xie J, Li Z, Xie Z. Models of gouty nephropathy: exploring disease mechanisms and identifying potential therapeutic targets. Front Med (Lausanne). 2024 Feb 29;11:1305431.
- Richette P, Doherty M, Pascual E, Barskova V, Becce F, Castañeda-Sanabria J, Coyfish M, Guillo S, Jansen TL, Janssens H, Lioté F, Mallen C, Nuki G, Perez-Ruiz F, Pimentao J, Punzi L, Pywell T, So A, Tausche AK, Uhlig T, Zavada J, Zhang W, Tubach F, Bardin T. 2016 updated EULAR evidence-based recommendations for the management of gout. Ann Rheum Dis. 2017 Jan;76(1):29-42.
- Johnson RJ, Choi HK, Yeo AE, Lipsky PE. Pegloticase Treatment Significantly Decreases Blood Pressure in Patients With Chronic Gout. Hypertension. 2019 Jul;74(1):95-101.
- Shao Q, Wang J. The Role of Ultrasound Semi-Quantitative Scoring in the Diagnosis and Assessment of Gout and Hyperuricemia. J Ultrasound Med. 2024 Feb;43(2):281-291.
- Dalbeth N, House ME, Aati O, Tan P, Franklin C, Horne A, Gamble GD, Stamp LK, Doyle AJ, McQueen FM. Urate crystal deposition in asymptomatic hyperuricaemia and symptomatic gout: a dual energy CT study. Ann Rheum Dis. 2015 May;74(5):908-11.
- Virdis A, Masi S, Casiglia E, Tikhonoff V, Cicero AFG, Ungar A, Rivasi G, Salvetti M, Barbagallo CM, Bombelli M, Dell’Oro R, Bruno B, Lippa L, D’Elia L, Verdecchia P, Mallamaci F, Cirillo M, Rattazzi M, Cirillo P, Gesualdo L, Mazza A, Giannattasio C, Maloberti A, Volpe M, Tocci G, Georgiopoulos G, Iaccarino G, Nazzaro P, Parati G, Palatini P, Galletti F, Ferri C, Desideri G, Viazzi F, Pontremoli R, Muiesan ML, Grassi G, Borghi C; from the Working Group on Uric Acid and Cardiovascular Risk of the Italian Society of Hypertension. Identification of the Uric Acid Thresholds Predicting an Increased Total and Cardiovascular Mortality Over 20 Years. Hypertension. 2020 Feb;75(2):302-308.
- Johnson RJ, Bakris GL, Borghi C, Chonchol MB, Feldman D, Lanaspa MA, Merriman TR, Moe OW, Mount DB, Sanchez Lozada LG, Stahl E, Weiner DE, Chertow GM. Hyperuricemia, Acute and Chronic Kidney Disease, Hypertension, and Cardiovascular Disease: Report of a Scientific Workshop Organized by the National Kidney Foundation. Am J Kidney Dis. 2018 Jun;71(6):851-865.
- Borghi C, Desideri G. Urate-Lowering Drugs and Prevention of Cardiovascular Disease: The Emerging Role of Xanthine Oxidase Inhibition. Hypertension. 2016 Mar;67(3):496-8.
- Scheepers LE, Wei FF, Stolarz-Skrzypek K, Malyutina S, Tikhonoff V, Thijs L, Salvi E, Barlassina C, Filipovský J, Casiglia E, Nikitin Y, Kawecka-Jaszcz K, Manunta P, Cusi D, Boonen A, Staessen JA, Arts IC. Xanthine oxidase gene variants and their association with blood pressure and incident hypertension: a population study. J Hypertens. 2016 Nov;34(11):2147-54.
- Miah R, Fariha KA, Sony SA, Ahmed S, Hasan M, Mou AD, Barman Z, Hasan A, Mohanto NC, Ali N. Association of serum xanthine oxidase levels with hypertension: a study on Bangladeshi adults. Sci Rep. 2022 Dec 16;12(1):21727.
- Polito L, Bortolotti M, Battelli MG, Bolognesi A. Xanthine oxidoreductase: A leading actor in cardiovascular disease drama. Redox Biol. 2021 Nov 24;48:102195.
- Casiglia E, Tikhonoff V, Virdis A, Masi S, Barbagallo CM, Bombelli M, Bruno B, Cicero AFG, Cirillo M, Cirillo P, Desideri G, D’Elia L, Ferri C, Galletti F, Gesualdo L, Giannattasio C, Iaccarino G, Lippa L, Mallamaci F, Maloberti A, Mazza A, Muiesan ML, Nazzaro P, Palatini P, Parati G, Pontremoli R, Quarti-Trevano F, Rattazzi M, Rivasi G, Salvetti M, Tocci G, Ungar A, Verdecchia P, Viazzi F, Volpe M, Grassi G, Borghi C; Working Group on Uric Acid and Cardiovascular Risk of the Italian Society of Hypertension (SIIA). Serum uric acid and fatal myocardial infarction: detection of prognostic cut-off values: The URRAH (Uric Acid Right for Heart Health) study. J Hypertens. 2020 Mar;38(3):412-419.
- Otaki Y, Watanabe T, Kinoshita D, Yokoyama M, Takahashi T, Toshima T, Sugai T, Murase T, Nakamura T, Nishiyama S, Takahashi H, Arimoto T, Shishido T, Miyamoto T, Kubota I. Association of plasma xanthine oxidoreductase activity with severity and clinical outcome in patients with chronic heart failure. Int J Cardiol. 2017 Feb 1;228:151-157.
- Bredemeier M, Lopes LM, Eisenreich MA, Hickmann S, Bongiorno GK, d’Avila R, Morsch ALB, da Silva Stein F, Campos GGD. Xanthine oxidase inhibitors for prevention of cardiovascular events: a systematic review and meta-analysis of randomized controlled trials. BMC Cardiovasc Disord. 2018 Feb 7;18(1):24.
- Givertz MM, Anstrom KJ, Redfield MM, Deswal A, Haddad H, Butler J, Tang WH, Dunlap ME, LeWinter MM, Mann DL, Felker GM, O’Connor CM, Goldsmith SR, Ofili EO, Saltzberg MT, Margulies KB, Cappola TP, Konstam MA, Semigran MJ, McNulty SE, Lee KL, Shah MR, Hernandez AF; NHLBI Heart Failure Clinical Research Network. Effects of Xanthine Oxidase Inhibition in Hyperuricemic Heart Failure Patients: The Xanthine Oxidase Inhibition for Hyperuricemic Heart Failure Patients (EXACT-HF) Study. Circulation. 2015 May 19;131(20):1763-71.
- Desideri G, Castaldo G, Lombardi A, Mussap M, Testa A, Pontremoli R, Punzi L, Borghi C. Is it time to revise the normal range of serum uric acid levels? Eur Rev Med Pharmacol Sci. 2014;18(9):1295-306.
- Bardin T. Hyperuricemia starts at 360 micromoles (6 mg/dL). Joint Bone Spine. 2015 May;82(3):141-3.
- Feig DI, Kang DH, Johnson RJ. Uric acid and cardiovascular risk. N Engl J Med. 2008 Oct 23;359(17):1811-21.
- Viazzi F, Leoncini G, Vercelli M, Deferrari G, Pontremoli R. Serum uric acid levels predict new-onset type 2 diabetes in hospitalized patients with primary hypertension: the MAGIC study. Diabetes Care. 2011 Jan;34(1):126-8.
- Sui X, Church TS, Meriwether RA, Lobelo F, Blair SN. Uric acid and the development of metabolic syndrome in women and men. Metabolism. 2008 Jun;57(6):845-52.
- Diallo A, Diallo MF, Carlos-Bolumbu M, Galtier F. Uric acid-lowering effects of sodium-glucose cotransporter 2 inhibitors for preventing cardiovascular events and mortality: A systematic review and meta-analysis. Diabetes Obes Metab. 2024 Feb 5.
- Selvaraj S, Claggett BL, Pfeffer MA, Desai AS, Mc Causland FR, McGrath MM, Anand IS, van Veldhuisen DJ, Kober L, Janssens S, Cleland JGF, Pieske B, Rouleau JL, Zile MR, Shi VC, Lefkowitz MP, McMurray JJV, Solomon SD. Serum uric acid, influence of sacubitril-valsartan, and cardiovascular outcomes in heart failure with preserved ejection fraction: PARAGON-HF. Eur J Heart Fail. 2020 Nov;22(11):2093-2101.
- Keen HI, Davis WA, Latkovic E, Drinkwater JJ, Nossent J, Davis TME. Ultrasonographic assessment of joint pathology in type 2 diabetes and hyperuricemia: The Fremantle Diabetes Study Phase II. J Diabetes Complications. 2018 Apr;32(4):400-405.
- Ottaviani S, Bardin T, Richette P. Usefulness of ultrasonography for gout. Joint Bone Spine. 2012 Oct;79(5):441-5.
- Andrés M, Quintanilla MA, Sivera F, Sánchez-Payá J, Pascual E, Vela P, Ruiz-Nodar JM. Silent Monosodium Urate Crystal Deposits Are Associated With Severe Coronary Calcification in Asymptomatic Hyperuricemia: An Exploratory Study. Arthritis Rheumatol. 2016 Jun;68(6):1531-9.
- Chhana A, Lee G, Dalbeth N. Factors influencing the crystallization of monosodium urate: a systematic literature review. BMC Musculoskelet Disord. 2015 Oct 14;16:296.
- Elion GB, Callahan SW, Nathan HC, Bieber S, Rundles RW, Hitchings GH. Potentiation by inhibition of drug degradation: 6-substituted purines and xanthine oxidase. Biochemical Pharmacology. 1963;12, 85-93.
- Pacher P, Nivorozhkin A, Szabó C. Therapeutic effects of xanthine oxidase inhibitors: renaissance half a century after the discovery of allopurinol. Pharmacol Rev. 2006 Mar;58(1):87-114.
- Takano Y, Hase-Aoki K, Horiuchi H, Zhao L, Kasahara Y, Kondo S, Becker MA. Selectivity of febuxostat, a novel non-purine inhibitor of xanthine oxidase/xanthine dehydrogenase. Life Sci. 2005 Mar 4;76(16):1835-47.
- Terkeltaub R. Update on gout: new therapeutic strategies and options. Nat Rev Rheumatol. 2010 Jan;6(1):30-8.
- Becker MA, Schumacher HR Jr, Wortmann RL, MacDonald PA, Eustace D, Palo WA, Streit J, Joseph-Ridge N. Febuxostat compared with allopurinol in patients with hyperuricemia and gout. N Engl J Med. 2005 Dec 8;353(23):2450-61.
- Schumacher HR Jr, Becker MA, Wortmann RL, Macdonald PA, Hunt B, Streit J, Lademacher C, Joseph-Ridge N. Effects of febuxostat versus allopurinol and placebo in reducing serum urate in subjects with hyperuricemia and gout: a 28-week, phase III, randomized, double-blind, parallel-group trial. Arthritis Rheum. 2008 Nov 15;59(11):1540-8.
- Horiuchi H, Ota M, Kobayashi M, Kaneko H, Kasahara Y, Nishimura S, Kondo S, Komoriya K. A comparative study on the hypouricemic activity and potency in renal xanthine calculus formation of two xanthine oxidase/xanthine dehydrogenase inhibitors: TEI-6720 and allopurinol in rats. Res Commun Mol Pathol Pharmacol. 1999;104(3):307-19.
- Mayer MD, Khosravan R, Vernillet L, Wu JT, Joseph-Ridge N, Mulford DJ. Pharmacokinetics and pharmacodynamics of febuxostat, a new non-purine selective inhibitor of xanthine oxidase in subjects with renal impairment. Am J Ther. 2005 Jan-Feb;12(1):22-34.
- Mackenzie IS, Ford I, Nuki G, Hallas J, Hawkey CJ, Webster J, Ralston SH, Walters M, Robertson M, De Caterina R, Findlay E, Perez-Ruiz F, McMurray JJV, MacDonald TM; FAST Study Group. Long-term cardiovascular safety of febuxostat compared with allopurinol in patients with gout (FAST): a multicentre, prospective, randomised, open-label, non-inferiority trial. Lancet. 2020 Nov 28;396(10264):1745-1757.
- White WB, Saag KG, Becker MA, Borer JS, Gorelick PB, Whelton A, Hunt B, Castillo M, Gunawardhana L; CARES Investigators. Cardiovascular Safety of Febuxostat or Allopurinol in Patients with Gout. N Engl J Med. 2018 Mar 29;378(13):1200-1210.
- Zhang T, Pope JE. Cardiovascular effects of urate-lowering therapies in patients with chronic gout: a systematic review and meta-analysis. Rheumatology (Oxford). 2017 Jul 1;56(7):1144-1153.
Introduzione
Nel corso degli ultimi anni un crescente interesse è stato rivolto da parte della letteratura scientifica al coinvolgimento del metabolismo dell’acido urico nella fisiopatologia dell’ipertensione e delle malattie cardiovascolari, renali e metaboliche (1) (Figura 1). Non sorprende, quindi, che le linee guida 2023 della European Society of Hypertension per la gestione dell’ipertensione arteriosa (2) abbiamo ripreso, ed ulteriormente enfatizzato, la raccomandazione proposta dalla edizione 2018 (3) e dalle linee guida della International Society of Hypertension (4) di monitorare sistematicamente i valori di uricemia in fase di inquadramento del paziente iperteso. Invero, la prevalenza dell’ipertensione nel paziente con malattia da depositi di urato – definizione fisiopatologica della gotta – è doppia rispetto a quanto si osserva nei soggetti con normale metabolismo dell’acido urico (36 vs 17%) mentre una condizione di iperuricemia, con o senza depositi di urato, si riscontra mediamente in un paziente iperteso su quattro (5,6). Peraltro, gli aumentati livelli circolanti di acido urico rappresentano un predittore indipendente della comparsa di ipertensione (7,8), ruolo predittivo che si osserva già nei bambini e negli adolescenti mentre si perde quasi completamente nei soggetti anziani ed in quelli con ipertensione secondaria e normale funzione renale (9). La malattia da depositi di urato è associata ad un aumentato rischio di eventi cardiovascolari (compreso l’infarto miocardico e l’ictus) (1,10,11) attraverso meccanismi fisiopatologici non dissimili da quelli coinvolti nella fisiopatologia dell’ipertensione e delle complicanze cardiovascolari e renali ad essa associate, principalmente rappresentati da infiammazione e stress ossidativo (12). La prevenzione della malattia da depositi di urato attraverso la riduzione dei livelli circolanti di acido urico con inibitori della xantina ossidasi si associa ad una riduzione di variabile entità della pressione arteriosa, evidenza che conferma ulteriormente l’ipotesi di un coinvolgimento del dismetabolismo dell’acido urico nella fisiopatologia dell’ipertensione e delle sue complicanze (13-15). A tale riguardo, le linee guida raccomandano il raggiungimento ed il mantenimento di livelli circolanti di acido urico <6 mg/dL nei pazienti con malattia da depositi di urato (16). Non appare inutile sottolineare che i farmaci di comune utilizzo per il trattamento delle riacutizzazioni gottose – colchicina, farmaci antinfiammatori non steroidei e corticosteroidi – possono influire negativamente sul controllo pressorio nei pazienti ipertesi, ragione per cui è importante intensificare il monitoraggio della pressione arteriosa in corso di riacutizzazioni infiammatorie (2). Alcune recenti evidenze suggeriscono un possibile effetto protettivo di colchicina nei confronti della malattia aterosclerotica (17), presumibilmente attraverso una riduzione dell’infiammazione e dei meccanismi sottesi allo sviluppo e alla progressione della aterosclerosi. Non meno interessanti appaiono le evidenze di un possibile effetto protettivo a livello cardiovascolare della terapia ipouricemizzante prodotte da alcuni studi (13,15), sia pur non del tutto in linea con altre osservazioni (18-20). L’opportunità di studiare sistematicamente il comportamento dei livelli circolanti di acido urico nel paziente iperteso trova una ulteriore motivazione, oltre che nella condivisione di alcuni meccanismi fisiopatologici, nella documentata influenza di alcuni trattamenti antipertensivi di uso comune sui livelli circolanti di questo prodotto finale del metabolismo purinico. I diuretici tiazidici/similtiazidici e dell’ansa aumentano i livelli circolanti di acido urico (21-23), mentre ACE-inibitori, sartani, calcio-antagonisti e beta bloccanti non hanno effetti rilevanti anche se per i beta bloccanti è stata suggerita una riduzione dell’escrezione renale di acido urico (21), effetto invero non evidente per nebivololo (24). Tra i sartani, losartan si è dimostrato efficace nel ridurre i livelli circolanti di acido urico attraverso un aumento della sua escrezione a livello renale, con alcune non trascurabili ricadute positive in termini di protezione cardiovascolare (22,23,25). Insieme ai calcio-antagonisti, losartan si è dimostrato efficace anche nel ridurre l’incidenza della malattia da depositi di urato nei pazienti ipertesi, indipendentemente dai valori pressori (21). Sulla base di queste evidenze le linee guida suggeriscono di usare con attenzione i diuretici nei pazienti con dismetabolismo dell’acido urico, ovviamente senza escluderne l’uso se necessario al raggiungimento del controllo pressorio, eventualmente considerando l’opportunità di usarne dosaggi ridotti visto che l’effetto di questi farmaci sui livelli di uricemia è dose dipendente (2,16).
Ipertensione, iperuricemia e malattie cardiovascolari
Le malattie cardiovascolari rappresentano la prima causa di morte nelle civiltà occidentali e la loro incidenza dipende in maniera prevalente dall’intervento integrato di una serie di fattori di rischio cardiovascolare che condizionano lo sviluppo della malattia aterosclerotica e promuovono le sue complicanze in conseguenza di meccanismi sovrapposti di trombosi vascolare.
L’ipertensione arteriosa rappresenta il più importante fattore di rischio cardiovascolare con una diretta responsabilità su una ampia quota della mortalità e morbosità cardiovascolare nel mondo. Secondo le stime dell’Organizzazione Mondiale della Sanità l’ipertensione arteriosa nel mondo interessa circa 1,28 miliardi di persone nella fascia di età 30-79 anni, due terzi dei quali in Paesi a basso-medio reddito. Nel 2019 la prevalenza globale dell’ipertensione arteriosa, standardizzata per età, nella fascia di età 30-79 anni era pari al 34% negli uomini e al 32% nelle donne (2). Questa rilevanza epidemiologica si traduce in un enorme impatto clinico e socioeconomico in ragione del considerevole aumento del rischio di malattie cardio-cerebrovascolari e renali legato agli aumentati livelli pressori (2). Il Global Burden of Diseases, Injuries , and Risk Factors Study (GBD) 2019, che ha stimato la quota di mortalità, anni di vita persi e anni di vita vissuta con disabilità attribuibili ad 87 fattori di rischio comportamentali, ambientali, occupazionali e metabolici, ha evidenziato come la quota preponderante di decessi nel mondo sia riconducibile a valori di pressione sistolica ≥110–115 mmHg con una stima di 10,8 milioni di decessi evitabili ogni anno e di 235 milioni di anni di vita persi o vissuti con disabilità ogni anno (26).
Uno degli aspetti che in questi ultimi anni è emerso in maniera preponderante è rappresentato dall’evidenza che il panorama del rischio cardiovascolare appare molto più ampio di quello prospettato dall’approccio proposto dalla tradizionale epidemiologia basata sullo studio di Framingham in ragione dell’intervento di una serie di ulteriori determinanti del rischio cardiovascolare, spesso ampiamente modificabili ed in grado di condizionare quello che viene conosciuto come “rischio cardiovascolare residuo” e che condiziona un’aumentata probabilità di complicanze cardiovascolari anche in presenza di un controllo adeguato dei principali fattori di rischio. A questo riguardo nel corso degli ultimi anni un numero impressionante di studi scientifici ha prepotentemente riacceso il dibattito scientifico sul problema dell’iperuricemia cronica e delle patologie correlate come determinanti del rischio cardiovascolare, tematica che ha attraversato in lungo ed in largo la letteratura epidemiologica degli ultimi 30-40 anni in ragione del frequente riscontro di una significativa associazione tra livelli di acido urico, presenza di malattia gottosa ed aumento del rischio relativo di complicanze cardiovascolari (27) (Figura 1). Le evidenze scientifiche attualmente disponibili, invero, attribuiscono all’iperuricemia, con e senza depositi di urato, una responsabilità fisiopatologica certamente non trascurabile in tutte le fasi del continuum cardio-cerebro-renale che va dell’esposizione ai vari fattori di rischio, allo sviluppo di danno d’organo e alla comparsa di eventi cardiaci, cerebrali e renali. L’iperuricemia, infatti, si comporta in modo non dissimile dai fattori di rischio cardiovascolare tradizionali con i quali spesso si associa in una relazione talmente stretta da lasciare supporre l’esistenza di un nesso patogenetico probabilmente di tipo bidirezionale in cui iperuricemia e fattori di rischio tradizionali – ipertensione e dismetabolismo glicidico in primis – interagiscono generando un circuito di amplificazione reciproca (27).
La relazione tra dismetabolismo dell’acido urico e ipertensione arteriosa è nota dal lontano 1870 quando un giovane studente di medicina, Frederick Akbar Mahomed, descrisse una associazione tra aumentati livelli circolanti di acido urico ed ipertensione arteriosa (28). Nel corso degli ultimi decenni una enorme mole di dati derivanti da evidenze sperimentali, osservazionali e di intervento ha confermato la brillante intuizione del giovane studente. In ambito sperimentale è ben noto come l’induzione di una condizione di iperuricemia nel ratto determini un aumento dei livelli di pressione arteriosa che vengono efficacemente ridotti dalla correzione della condizione di iperuricemia (21,29). Le evidenze epidemiologiche forniscono un robusto supporto all’ipotesi di un nesso fisiopatologico tra dismetabolismo dell’acido urico ed ipertensione arteriosa. L’iperuricemia è spesso presente nel paziente iperteso, soprattutto in quelle con forme più severe di ipertensione e nei casi di ipertensione ad esordio giovanile (29). L’iperuricemia, inoltre, è un potente predittore della comparsa di ipertensione, con un rischio a 5-10 anni aumentato di circa 2 volte (29). Alcune evidenze derivanti da studi di intervento, sia pur non molto numerose, forniscono una ulteriore dimostrazione dello stresso nesso fisiopatologico tra metabolismo dell’acido urico ed ipertensione arteriosa (Tabella 1) (29). In adolescenti con ipertensione di nuova diagnosi ed iperuricemia è stata dimostrata una significativa riduzione della pressione arteriosa in corso di terapia ipouricemizzante (29). Simili risultati sono stati osservati in adolescenti obesi con preipertensione nei quali la riduzione della uricemia con un inibitore della xantina ossidasi o con un agente uricosurico è risultata associata ad una riduzione dei livelli pressori (29). Peraltro, i benefici sui livelli pressori osservati negli adolescenti in corso di trattamento con l’inibitore della xantina ossidasi allopurinolo sembrano poter essere addizionali rispetto alla terapia con ACE-inibitori (29). In uno studio americano di fase 2, in doppio cieco, controllato con placebo e multicentrico l’inibitore della xantina ossidasi è stato valutato per il suo effetto sulla pressione arteriosa in soggetti ipertesi con iperuricemia, utilizzando misurazioni della pressione arteriosa ambulatoriale (ABPM) (30). I risultati complessivi non hanno mostrato differenze significative tra l’inibitore della xantina ossidasi e il placebo nel cambiamento della ABPM. Tuttavia, è emerso un lieve ma significativo decremento della pressione arteriosa sistolica alla settimana 6 nei soggetti con funzione renale normale trattati con l’inibitore della xantina ossidasi (30).
Una significativa riduzione della pressione arteriosa in corso di terapia ipouricemizzante è stata descritta anche in anziani ipertesi con recente attacco ischemico transitorio, in diabetici iperuricemici ed in pazienti con preipertensione e livelli di uricemia ai limiti alti della norma (6,0-6,2 mg/dl) nei quali il trattamento con allopurinolo ha anche determinato un miglioramento del profilo pressorio notturno (29). È interessante notare come questi benefici della terapia ipouricemizzante sulla pressione arteriosa non sono risultati evidenti nei soggetti normouricemici normotesi mentre una modesta riduzione della pressione arteriosa in corso di terapia ipouricemizzante è stata osservata in soggetti normotesi con iperuricemia asintomatica (29). Queste evidenze suggeriscono che la terapia con inibitori della xantina ossidasi non ha alcun effetto rilevante sulla pressione arteriosa di soggetti normotesi, soprattutto se questi sono anche normouricemici.
Indipendentemente dalla tendenza dell’iperuricemia a combinarsi con gli altri fattori di rischio cardiovascolare è di non poca rilevanza fisiopatologica la dimostrazione derivante da diversi studi epidemiologici che l’iperuricemia è un predittore indipendente di eventi cardiovascolari a conferma dell’ipotesi di una diretta lesività vascolare dell’iperuricemia suggerita dei modelli fisiopatologici.
Fisiopatologia del danno cardiovascolare da acido urico nel paziente iperteso
Nonostante le robuste evidenze suggestive di uno stretto nesso patogenetico tra iperuricemia con o senza depositi di urato e malattie cardiovascolari, la possibilità di poter derivare una protezione cardiovascolare attraverso la riduzione dei livelli circolanti di acido urico è ancora tema di discussione. Invero, a fronte di evidenze di studi osservazionali suggestive di un effetto protettivo derivante dalla riduzione dei livelli circolanti di acido urico, soprattutto se ottenuta con inibitori della xantina ossidasi, i risultati degli studi randomizzati controllati sono scarsi e piuttosto contradditori (21). Queste discrepanze, invero, potrebbero riflettere l’esistenza di fenotipi diversi di pazienti iperuricemici con una distribuzione non omogena dei benefici della terapia ipouricemizzante (Figura 2).
In principio c’erano i cristalli……
La relazione tra dismetabolismo dell’acido e malattie cardiovascolari è supportata da numerose evidenze epidemiologiche che dimostrano un aumento significativo del rischio di morte per malattie cardiovascolari e malattia coronarica nei pazienti con malattia da depositi di urato (21,31). Da un punto di vista fisiopatologico questa associazione potrebbe essere spiegata dalla precipitazione di cristalli di urato monosodico sia a livello articolare che extraarticolare, compresa la parete vascolare, da cui deriva un’infiammazione cronica a livello vascolare e sistemico, caratteristica fisiopatologica della malattia da depositi di urato sia nella fase subclinica che durante le riacutizzazioni (1,32,33). L’evidenza di una maggiore estensione della patologia aterosclerotica a livello coronarico nei pazienti con depositi di urato subclinici ben supporta questa interpretazione fisiologica suggestiva di un ruolo patogenetico importante dello stato infiammatorio legato alla presenza di depositi, non necessariamente sintomatici in chiave artritica, di cristalli di urato monosodico (Figura 3) (1).
Un primo fenotipo di paziente ad aumentato rischio di eventi cardiovascolari legato agli aumentati livelli circolanti di acido urico è rappresentato, quindi, dal paziente con malattia da depositi di urato sia subclinica che clinicamente manifesta.
La relazione fisiopatologica tra depositi di urato ed ipertensione arteriosa verosimilmente vede nel rene il protagonista principale. Nei modelli sperimentali di ipertensione iperuricemica, infatti, la risposta pressoria al trattamento ipouricemizzante si riduce progressivamente in relazione alla comparsa ed alla progressione della nefropatia gottosa (29). Nei pazienti con nefropatia gottosa, caratterizzata dalla formazione di depositi di cristalli di urato monosodico, infiammazione interstiziale cronica, danno arteriolare e fibrosi renale (34), le linee guida raccomandano la riduzione dei livelli circolanti di acido urico (16,35). Nei pazienti con gotta refrattaria la riduzione della uricemia ottenuta in corso di trattamento con pegloticasi, uricasi ricombinante coniugata con glicole polietilenico, è risultata associata ad una significativa riduzione della pressione arteriosa indipendentemente dalle variazioni della funzione renale (36).
È importante sottolineare come una quota non trascurabile di malattia da depositi di urato decorra in forma subclinica e non venga, quindi, diagnosticata. In oltre un quinto dei pazienti con iperuricemia sono evidenti depositi articolari di urato monosodico apprezzabili all’esame ecografico (37), percentuale che sale da un quarto usando Dual Energy CT (38). Questo aspetto appare di non trascurabile rilevanza in quanto la presenza di depositi di urato monosodico rappresenta una indicazione all’uso della terapia ipouricemizzante che deve mirare a raggiungere livelli di uricemia <6 mg/dL al fine di favorire la dissoluzione dei depositi già presenti e prevenirne la formazione di altri (16,35). In questi pazienti la terapia ipouricemizzante, raccomandata dalle linee guida, ha tutte le potenzialità biologiche per esercitare anche rilevanti effetti favorevoli a livello cardiovascolare.
….poi venne il momento dell’acido urico
L’infiammazione promossa dalla deposizione dei cristalli di urato monosodico non può spiegare interamente la relazione tra acido urico e malattie cardiovascolari in quanto tale relazione è già evidente per i livelli normali-alti di acido urico (5,0–5,5 mg/dL), ampiamente al di sotto della soglia di saturazione dell’urato monosodico (39,40). Invero, dal punto di vista fisiopatologico acido urico può modificare le proprie proprietà biologiche in base alle concentrazioni raggiunte nei fluidi biologici e alla presenza di condizioni ambientali concomitanti. In particolare, le proprietà antiossidanti descritte per bassi livelli sierici di acido urico possono trasformarsi in proprietà pro-ossidanti già per livelli sierici ai limiti alti della norma (21,40). I meccanismi cellulari sottesi all’aumento della pressione arteriosa nel paziente iperuricemico coinvolgono sia la produzione intracellulare di acido urico (via xantina ossidasi) che la captazione di acido urico circolante (41). L’accumulo di acido urico all’interno delle cellule della parete vascolare determina un aumento dello stress ossidativo che a sua volta induce disfunzione endoteliale ed attivazione proaterogena dell’endotelio vascolare (21,40).
Sulla base di queste evidenze dovremmo, quindi, considerare un secondo fenotipo di paziente nel quale l’aumento del rischio cardiovascolare da acido urico è direttamente riconducibile all’effetto proossidante di questa molecola, indipendentemente dalla presenza di depositi di cristalli di urato monosodico. Per questa tipologia di pazienti non vi è ancora una indicazione alla terapia ipouricemizzante anche se alcune interessanti evidenze epidemiologiche suggeriscono possibili benefici derivanti in questi pazienti dalla riduzione dei livelli circolanti di acido urico.
Alla fine arrivò la xantina ossidasi a chiudere il cerchio
Evidenze derivanti da studi di randomizzazione mendeliana indicano che livelli sierici di acido urico geneticamente elevati per effetto della riduzione dell’attività dei sistemi di trasporto a livello renale sono associati ad un aumento del rischio di presentare malattia da depositi di urato ma non del rischio di sviluppare malattie cardiovascolari o disturbi metabolici (40). All’opposto, i polimorfismi genetici della xantina ossidasi, la principale attività enzimatica responsabile della generazione di acido urico, sono associati a variazioni incrementali della pressione arteriosa e ad un aumentato rischio di sviluppare ipertensione (42). In linea con queste evidenze, una aumentata prevalenza di ipertensione arteriosa è stata osservata nei pazienti con aumentati livelli di attività della xantina ossidasi (43). Da un punto di vista fisiopatologico, la xantina ossidasi ha tutta la capacità biologica di influenzare profondamente lo sviluppo di malattie cardiovascolari e metaboliche (44). Infatti, l’attività della xantina ossidasi è associata alla produzione sia di specie reattive dell’ossigeno che di acido urico con importanti ricadute fisiopatologiche, inclusa una risposta proinfiammatoria e protrombotica a livello endoteliale. Inoltre, l’aumentata attività della xantina ossidasi circolante è associata ad ipertensione, dislipidemia, diabete e può contribuire alla patogenesi dell’aterosclerosi. È interessante notare un più evidente effetto predittivo dei livelli circolanti di acido urico nei confronti degli eventi cardiovascolari nelle pazienti di sesso femminile nelle quali la presenza di estrogeni, noti per esercitare un potente effetto uricosurico, tenderebbe a condizionare più bassi livelli circolanti di acido urico (1,45). Queste evidenze possono suggerire una predominanza della generazione di acido urico da parte della xantina ossidasi nelle donne che supera i pur rilevanti effetti uricosurici degli estrogeni (1,45). È interessante notare che più elevati livelli di attività della xantina ossidasi plasmatica sono associati ad un aumento del rischio di eventi cardiovascolari e di mortalità cardiaca nei pazienti con insufficienza cardiaca cronica nei quali, tuttavia, anche una bassa attività plasmatica della xantina ossidasi è associata ad una prognosi sfavorevole (Figura 4) (46). Ciò suggerisce la possibilità di una relazione a “curva J” tra attività plasmatica della xantina ossidasi e outcome clinico, con una associazione dei livelli sia bassi che alti di attività della xantina ossidasi con un aumento del rischio di eventi cardiovascolari (46). Questi risultati non sono sorprendenti considerando i molteplici effetti fisiologici derivanti dall’attività della xantina ossidasi, potenzialmente protettivi a livello cardiovascolare, tra cui la modulazione dell’immunità innata, dell’equilibrio redox, dell’attivazione endoteliale, del tono vascolare, della pressione sanguigna, dell’accumulo di grasso e del rilascio di ossido nitrico (44). Questa ambivalenza di effetti biologici della xantina ossidasi potrebbe rappresentare un punto critico nel processo decisionale sul possibile utilizzo degli inibitori della xantina ossidasi in prevenzione cardiovascolare. Teoricamente, i pazienti con un’elevata attività della xantina ossidasi dovrebbero essere i candidati ideale per una strategia di prevenzione cardiovascolare attraverso l’inibizione della xantina ossidasi, mentre questo trattamento potrebbe non avere successo, o essere potenzialmente dannoso, nei pazienti con una bassa attività della xantina ossidasi. A supporto di questa ipotesi, alcune evidenze epidemiologiche suggeriscono come l’uso di allopurinolo si associ a un ridotto rischio di eventi cardiovascolari, ma questa associazione non è evidente nei pazienti che assumono alte dosi di farmaco (>300 mg/die) (47). Questa potenziale dualità di effetti potrebbe spiegare la mancata evidenza di un effetto protettivo di alte dosi di allopurinolo in pazienti con insufficienza cardiaca e frazione di eiezione ridotta arruolati nello studio Xanthine Oxidase Inhibition for Hyperuricemic Heart Failure Patients – EXACT-HF (48). In questo studio i risultati deludenti potrebbero essere la conseguenza di un bilanciamento tra l’effetto protettivo associato all’inibizione della xantina ossidasi in alcuni pazienti e il risultato potenzialmente negativo in altri. Invero, è lecito ipotizzare che l’effetto protettivo della terapia ipouricemizzante, segnatamente con inibitori della xantina ossidasi, possa essere efficace laddove il sistema metabolico che genera acido urico sia adeguatamente attivo. Questo potrebbe essere la chiave interpretativa più plausibile per spiegare l’assenza di un effetto protettivo della inibizione della xantina ossidasi con allopurinolo nei pazienti con malattia coronarica stabile arruolati nello studio ALL-HEART che nella generalità dei casi non erano iperuricemici (19). Nella loro globalità questi risultati suggeriscono la possibilità che sia l’inibizione della xantina ossidasi più che il controllo dei livelli circolanti di acido urico il determinante principale di una eventuale protezione cardiovascolare, probabilmente in ragione del fatto che questo approccio gestionale consente di ridurre i livelli circolanti di acido urico e, quindi, di prevenire la formazione di depositi di cristalli di urato monosodico e l’accumulo intracellulare di acido urico, ma al tempo stesso attenua anche la produzione di specie reattive dell’ossigeno (1,21,40). Un terzo e probabilmente più rilevante fenotipo fisiopatologico potrebbe essere, quindi, rappresentato da pazienti con iperattività della xantina ossidasi dovuta a fattori genetici o acquisiti o all’eccesso di substrato, ad esempio a causa di un aumentato apporto dietetico di fruttosio o alimenti ricchi di purine (1).
Ipertensione ed iperuricemia: risvolti terapeutici
La mole di evidenze che legano il metabolismo dell’acido urico all’aumento dei valori pressori e, più in generale, alle problematiche cardio-nefro-metaboliche (21,27,40) è tale da giustificare appieno la crescente attenzione posta dalle linee guida al monitoraggio dell’uricemia nel paziente iperteso (2-4). A tale riguardo non appare inutile richiamare l’attenzione sulla definizione di iperuricemia in quanto fino ad un recente passato regnava una certa confusione intorno al valore desiderabile di uricemia in ragione della individuazione di due distinti intervalli di riferimento per l’uricemia: 3,5-7,2 mg/dL nei maschi adulti e nelle donne in postmenopausa e 2,6-6,0 mg/dL nelle donne in età premenopausale (49). Questa differenziazione dipendeva dal fatto che nelle donne in età fertile l’uricemia tende ad essere più bassa per l’effetto uricosurico degli estrogeni. Attualmente l’orientamento prevalente è quello di individuare il limite superiore dell’intervallo di riferimento dell’uricemia negli esseri umani sostanzialmente nel limite di solubilità della molecola, in quanto la sua lesività articolare di acido urico dipende proprio dalla precipitazione dell’urato monosodico con formazione di cristalli (49,50). A conferma di ciò, le linee guida internazionali per la gestione della iperuricemia cronica con deposito di urato raccomandano di mantenere i livelli circolanti di acido urico al limite minimo di 6 mg/dL (o <5mg/dL nelle forme più severe di gotta) al fine di prevenire la formazione di depositi di urato, promuovere la dissoluzione dei depositi già presenti e prevenire le riacutizzazioni artritiche (16,35). È interessante notare che l’influenza dell’acido urico sulla fisiopatologia cardiovascolare comincia ad estrinsecarsi per livelli circolanti di 5,0-5,5 mg/dl, inferiori al limite di solubilità della molecola e, quindi, largamente indipendenti dalla precipitazione di cristalli di urato monosodico, essenza fisiopatologica della gotta (39,49-51). Anche la relazione tra uricemia, dismetabolismo glicidico (52) e sindrome metabolica (53) sembra concretizzarsi per valori di uricemia inferiori, o al massimo prossimi, al limite di solubilità della molecola. Alla luce delle evidenze scientifiche la soglia di normalità per l’uricemia non può che corrispondere a quei 6 mg/dL che le raccomandazioni internazionali già suggeriscono come obiettivo da raggiungere per il paziente con iperuricemia cronica con deposito di urato (16,35). Questo livello desiderabile è senza dubbio quello che ha le maggiori possibilità di intercettare la totalità della lesività dell’acido urico, obiettivo che sempre ci si dovrebbe prefiggere nella definizione di ogni intervallo di normalità (49).
I risvolti applicativi del riscontro di aumentati livelli circolanti di acido urico nel paziente iperteso sono rappresentati in primo luogo dalla correzione dei determinanti causali, ove evidenti, per poi considerare interventi specifici in caso di risposta non adeguata. Si è già detto della possibilità che alcuni farmaci di uso comune nell’ipertensione arteriosa, i diuretici tiazidici e dell’ansa, possano incrementare in varia misura i livelli circolanti di acido urico mentre per altri è noto un effetto neutro, come per calcio antagonisti, ACE-inibitori e inibitori recettoriali dell’angiotesina II (21,23). Nel caso in cui il paziente iperteso iperuricemico stiano assumendo farmaci potenzialmente iperuricemizzanti appare evidente l’opportunità di rimodulare, ove possibile la terapia (2). In ambito cardiovascolare merita menzione l’evidenza di un effetto favorevole sull’uricemia dei farmaci SGLT2 inibitori le cui potenzialità protettive a livello cardiovascolare potrebbero almeno in parte dipendere proprio da una riduzione dell’uricemia (54,55). Nel caso in cui il paziente presenti un variabile grado di eccedenza ponderale la riduzione del peso corporeo appare mandatoria per i suoi ben documentati effetti benefici sia sulla pressione arteriosa che sui livelli circolanti di acido urico (35). Le diete completamente apuriniche sono poco palatabili e, conseguentemente, non molto gradite da parte dei pazienti anche in ragione dell’efficacia piuttosto modesta nel ridurre l’uricemia a meno che i pazienti non seguano una alimentazione particolarmente iperuricemizzante, ad esempio per un eccesso di cibi carnei o di fruttosio.
La terapia ipouricemizzante trova una specifica indicazione in presenza di depositi di urato, condizione invero ben più frequente di quanto si possa immaginare in quanto l’attacco artritico acuto che caratterizza la gotta rappresenta solo la punta dell’iceberg della malattia da deposito di urato. Una quota non trascurabile di pazienti iperuricemici presentano depositi subclinici di urato monosodico che nel tempo determinano un variabile grado di danno a livello articolare, pur senza raggiungere l’estrinsecazione clinica tipica dell’attacco gottoso acuto (37,38,56). Questi depositi articolari di urato monosodico si riducono fino a scomparire in corso di terapia ipouricemizzante (57). L’assenza di aspetti clinici di artrite acuta non esclude certamente la presenza di un danno articolare sottostante, evidenza che suggerisce l’opportunità di una rivisitazione del concetto di “iperuricemia asintomatica”. Peraltro, lo stato infiammatorio cronico associato a questi depositi subclinici può favorire lo sviluppo e la progressione del danno vascolare aterosclerotico (58). A ciò si aggiunga che non di rado l’artrite gottosa, sia pur sintomatica, decorre misconosciuta perché confusa con una condizione di osteoartrite in ragione di un decorso spesso paucisintomatico, soprattutto negli anziani, e con un interessamento poliarticolare al posto del classico attacco di “podagra” a carico della prima articolazione metatarso-falangea.
Il corretto inquadramento del paziente iperteso iperuricemico è, quindi, di notevole rilevanza pratica in quanto la presenza di depositi tissutali di urato monosodico rappresenta una chiara indicazione alla terapia ipouricemizzante il cui obbiettivo deve essere il raggiungimento del target minimo di 6 mg/dL che deve poi essere mantenuto nel tempo per evitare che si formino nuovi depositi di urato e favorire la dissoluzione dei depositi già presenti (16,35). La presenza di tali depositi va sospettata in tutti i pazienti con iperuricemia sostenuta, soprattutto se di lunga durata, in quanto il raggiungimento della soglia di saturazione dell’acido – 6,8 mg/dL a 37° e a temperatura e pH fisiologici – comporta la frequente precipitazione di cristalli di urato monosodico (59).
Sicurezza e maneggevolezza della terapia ipouricemizzante
La terapia ipouricemizzante di riferimento nei pazienti con malattia da depositi di urato è rappresentata dagli inibitori della xantina-ossidasi, allopurinolo e febuxostat (35). Allopurinolo chimicamente è un analogo purinico, originariamente sintetizzato nell’ambito di un programma di sviluppo di farmaci antibatterici e chemioterapici (60). Questo farmaco è un inibitore relativamente debole della xantina ossidasi che a basse dosi agisce come substrato per questo enzima (“inibitore suicida”) mentre ad alte dosi si comporta come un inibitore non competitivo (61,62). Allopurinolo viene metabolizzato ad ossipurinolo, metabolita attivo che viene eliminato dal rene. A differenza di allopurinolo e del suo metabolita attivo ossipurinolo, febuxostat non è un composto purino-simile ma è un derivato dell’acido tiazolidin-carbossilico che ha la peculiare capacità di inibire selettivamente sia la forma ridotta che la forma ossidata della xantina ossidasi (63-65) con una potenza da 10 a 30 volte superiore rispetto a quella di allopurinolo (66). Febuxostat presenta una doppia via di eliminazione, epatica e renale, ragione per cui non ne è richiesto alcun aggiustamento posologico nei pazienti con insufficienza renale di grado I-III (67), condizione non infrequente nei pazienti iperuricemici e/o gottosi (49). Queste caratteristiche di febuxostat ne rendono particolarmente vantaggioso l’uso nei pazienti che non raggiungono il target terapeutico in corso di trattamento con allopurinolo o che non tollerano questo farmaco, invero non scevro di effetti indesiderati. La sicurezza cardiovascolare di questi 2 inibitori della xantina ossidasi è stata oggetto di un confronto diretto nel Febuxostat versus Allopurinol Streamlined Trial (FAST), recentemente pubblicato (68). Lo studio era stato specificatamente richiesto dalla European Union Risk Management Plan per verificare la sicurezza cardiovascolare di febuxostat rispetto al trattamento standard con allopurinolo. Lo studio, prospettico, randomizzato, in aperto con valutazione in cieco degli endpoint, ha confrontato febuxostat (80-120 mg/die) e allopurinolo con disegno di non-inferiorità, ha arruolato 6.128 pazienti con gotta (85,3% di sesso maschile) ed almeno un fattore di rischio cardiovascolare aggiuntivo, precedentemente trattati con allopurinolo. I pazienti sono stati seguiti nel corso di un tempo mediano di 1.467 giorni (range interquartile 1.029-2.052 giorni) con un periodo mediano di follow-up in trattamento di 1.324 giorni (range interquartile 870-1.919 giorni, 3,63 anni). Febuxostat è risultato non inferiore ad allopurinolo per l’endpoint primario (un composito di ospedalizzazione per infarto miocardico non fatale o riscontro di un aumento dei biomarker sindrome coronarica acuta, ictus non fatale o morte cardiovascolare) nell’analisi on-treatment (hazard ratio aggiustato pari a 0,85, intervallo di confidenza al 95% compreso tra 0,70 e 1,03, limite di non inferiorità pari a 1,3), risultato confermato nell’analisi intention-to-treat (Figura 5) (68). La non inferiorità di febuxostat è risultata evidente anche per vari outcome secondari compresa la morte per cause cardiovascolari (hazard ratio aggiustato pari a 0,91, intervallo di confidenza al 95% compreso tra 0,66 e 1,27) e per tutte le cause (hazard ratio aggiustato pari a 0,75, intervallo di confidenza al 95% compreso tra 0,59 e 0,95). L’elemento di maggiore solidità dello studio FAST è rappresentato dalla qualità del follow-up (68). Soltanto il 5,5% dei pazienti nel gruppo allopurinolo ed il 6,2% dei pazienti nel gruppo febuxostat sono stati persi nel corso del follow-up. La percentuale di discontinuazione del trattamento è risultata pari a 16,5% nel braccio allopurinolo e 32,4% nel gruppo febuxostat.
I risultati dello studio FAST, decisamente robusti, forniscono una possibile chiave interpretativa dei risultati di un precedente studio di confronto tra allopurinolo e febuxostat in tema di sicurezza cardiovascolare, lo studio Cardiovascular Safety of Febuxostat and Allopurinol in Patients with Gout and Cardiovascular Morbidities (CARES), che aveva evidenziato una frequenza di eventi cardiovascolari simile nei due bracci di trattamento, ma con un rischio di mortalità cardiovascolare e totale risultato, nell’analisi intention-to-treat, marginalmente più elevato nei pazienti trattati con febuxostat rispetto a quanto osservato nei pazienti trattati con allopurinolo (69). Nell’interpretazione di questi risultati va sottolineato come lo studio CARES, con disegno di non inferiorità, non prevedesse un braccio placebo. Conseguentemente, la succitata differente frequenza di mortalità nei 2 bracci di trattamento poteva esprimere, al massimo, una minore efficacia protettiva di febuxostat nei confronti di allopurinolo (69). Invero, lo studio CARES presenta molte limitazioni che ne minano non poco la solidità dei risultati. La cosa che più immediatamente balza agli occhi è la prematura discontinuazione del trattamento, soprattutto entro i primi 24 mesi dalla randomizzazione, da parte della larga maggioranza dei pazienti (55,9% per allopurinolo e 57,3 per febuxostat). Questo aspetto assume particolare significato in relazione alla constatazione che la quota maggiore dell’eccesso di mortalità osservato nei pazienti trattati con febuxostat è stata registrata dopo la discontinuazione dei trattamenti mentre nella fase antecedente il picco della discontinuazione medesima (2 anni) il trend della mortalità è stato esattamente l’opposto, con un possibile vantaggio di febuxostat (69). È evidente che una analisi intention-to-treat, certamente vantaggiosa nel replicare un contesto di mondo reale, perde molta della sua validità intrinseca in presenza di un tasso di discontinuazione così elevato e soprattutto per una valutazione della sicurezza, in cui l’analisi “on-treatment” è assai probabilmente da preferire. Peraltro, i pazienti arruolati nello studio CARES, in ragione del loro elevato profilo di rischio cardiovascolare, erano trattati con farmaci ipolipidemizzanti, antiaggreganti, ipoglicemizzanti ed antipertensivi, che in varia misura potrebbero avere modificato da un lato il profilo di rischio dei pazienti e dall’altro i livelli di uricemia (69). Nello studio, tuttavia, non viene fatta menzione del profilo lipidico dei pazienti o dei concomitanti trattamenti assunti dai pazienti.
Le conclusioni dello studio CARES differiscono sostanzialmente da quelle dello studio FAST per ciò che riguarda gli outcome secondari, nonostante le dimensioni simili dei due studi. Lo studio CARES, infatti, aveva evidenziato nei pazienti trattati con febuxostat un eccesso di mortalità cardiovascolare (hazard ratio pari a 1,34, intervallo di confidenza al 95% compreso tra 1,03 e 1,73) e per tutte le cause (hazard ratio pari a 1,22, intervallo di confidenza al 95% compreso tra 1,01 e 1,47) durante un periodo di osservazione esteso a 30 giorni dopo la fine del periodo di trattamento. Questo eccesso di eventi non è stato osservato nello studio FAST, anche in una analisi di sensibilità estesa a 90 giorni dopo il termine di trattamento. L’osservazione estesa oltre la fine del trattamento farmacologico nello studio FAST, inoltre, ha consentito di intercettare i decessi di quei pazienti che avevano interrotto il trattamento dopo un evento cardiovascolare e che erano deceduti successivamente. Il numero di pazienti nei quali si sono verificati gli eventi fatali non è ben chiaro nello studio CARES perché il 45,0% dei partecipanti avevano interrotto il follow-up. Tuttavia, l’eccesso di mortalità non è più risultato significativo quando sono stati contati dai database pubblici i decessi inizialmente non aggiudicati. Comunque, è bene sottolineare come sia lo studio CARES che lo studio FAST abbiano entrambi mostrato la non inferiorità di febuxostat vs allopurinolo per l’outcome primario. Risulta pertinente sottolineare come i pazienti arruolati negli studi CARES e FAST presentassero alcune differenze non trascurabili. I pazienti arruolati nello studio CARES, infatti, avevano una gotta più severa di quelli arruolati nello studio FAST con il 72% dei pazienti arruolati nel CARES che non avevano mai ricevuto un trattamento ipouricemizzante. Ma, soprattutto, i pazienti arruolati nel CARES avevano tutti una storia di malattia cardiovascolare mentre nel FAST poco più di un terzo dei pazienti riferiva storia di eventi cardiovascolari pregressi (2.046 su 6.128, 33,4%). In questo sottogruppo di pazienti arruolati nello studio FAST non è stato osservato, tuttavia, un eccesso di mortalità anche se il numero di pazienti potrebbe essere stato insufficiente a definire con certezza il potenziale rischio legato all’uso di febuxostat in pazienti con patologia cardiovascolare severa. Lo studio CARES ha incluso anche una quota di pazienti con scompenso cardiaco (il 20% dei partecipanti) mentre nello studio FAST sono stati esclusi i pazienti con scompenso cardiaco in classe NYHA III-IV, di cui è ben noto l’alto rischio di morte. Le dosi giornaliere di febuxostat utilizzate nello studio FAST (80 mg/die o 120 mg/die) sono risultate più alte rispetto a quelle usate nel CARES (40 mg/die o 80 mg/die) ed il range di dose di allopurinolo è risultato più ampio nel FAST (100-900 mg/die) rispetto al CARES (200-600 mg/die).
I risultati dello studio FAST appaiono robusti e rassicuranti in merito alla sicurezza cardiovascolare di febuxostat nella larga maggioranza dei pazienti affetti da malattia da depositi di urato. Invero, i risultati dello studio CARES sembrano rappresentare una sorta di voce fuori dal coro. Una meta-analisi di 25 studi non ha mostrato, infatti, differenze tra febuxostat ed allopurinolo in termini di occorrenza di eventi cardiovascolari (rischio relativo pari a 1,69 con un intervallo di confidenza al 95 compreso tra 0,54 e 5,34, p = 0,37) (70).
Conclusioni
La particolare attenzione rivolta dalle linee guida 2023 della European Society of Hypertension esprime il crescente interesse che la letteratura sta rivolgendo da alcuni anni a questa parte all’acido urico come determinante di una quota non trascurabile di rischio cardiovascolare. Questa “relazione pericolosa” tra acido urico e malattie cardiovascolari sembra cominci a delinearsi già per valori di uricemia al di sotto della soglia di 6 mg/dL che le raccomandazioni internazionali suggeriscono come target terapeutico per i pazienti con iperuricemia cronica con depositi di urato. Inoltre, esiste la possibilità che ciò che si vede, i livelli di acido urico, siano solo la parte emersa di un più ampio meccanismo di danno vascolare che potrebbe risiedere nella produzione esagerata o nella mancata clearance di alcuni prodotti intermedi della sintesi dello stesso con attività pro-ossidante la cui capacità di nuocere sarebbe proporzionale allo stato ossidativo di base del soggetto o alla efficienza del sistema anti-ossidante. È possibile, quindi, che analoghi livelli di acido urico circolante possano svolgere una diversa azione nociva in ragione della labilità del substrato vascolare nei confronti degli stessi o del meccanismo biochimico che ha contributo a generarli. Invero, le evidenze attualmente disponibili suggeriscono la possibilità che dietro gli stessi livelli di acido urico si debbano immaginare fenotipi diversi, identificabili in base a meccanismi fisiopatologici prevalenti, individualmente coinvolti nella relazione tra metabolismo dell’acido urico e malattia cardiovascolare. In particolare, per prima cosa dovremmo considerare l’infiammazione sistemica correlata ai depositi di urato monosodico, sia subclinici che clinicamente manifesti. Questo percorso fisiopatologico è probabilmente responsabile di quota rilevante del carico di malattie cardiovascolari legate al metabolismo dell’acido urico. Una quota ancor più rilevante del rischio cardiovascolare legato all’acido urico è probabilmente da ascrivere al livello di attività della xantina ossidasi, enzima chiave del metabolismo dell’acido urico e target ideale di una ipotetica strategia di prevenzione cardiovascolare nei pazienti iperuricemici. I diversi fenotipi fisiopatologici potrebbero essere parzialmente embricati ma con un impatto diverso in vari sottogruppi di pazienti. Ovviamente, questa fenotipizzazione è meno rilevante nei pazienti con depositi di urato monosodico, sia subclinici che clinicamente manifesti, per i quali comunque esiste una chiara indicazione alla terapia con inibitori della xantina ossidasi, farmaci che, vale la pena ribadirlo, attualmente restano indicati per il trattamento dell’iperuricemia cronica con deposito di urato.
Bibliografia
- Desideri G, Borghi C. Xanthine oxidase inhibition and cardiovascular protection: Don’t shoot in the dark. Eur J Intern Med. 2023 Jul;113:10-12.
- Mancia G, Kreutz R, Brunström M, Burnier M, Grassi G, Januszewicz A, Muiesan ML, Tsioufis K, Agabiti-Rosei E, Algharably EAE, Azizi M, Benetos A, Borghi C, Hitij JB, Cifkova R, Coca A, Cornelissen V, Cruickshank JK, Cunha PG, Danser AHJ, Pinho RM, Delles C, Dominiczak AF, Dorobantu M, Doumas M, Fernández-Alfonso MS, Halimi JM, Járai Z, Jelaković B, Jordan J, Kuznetsova T, Laurent S, Lovic D, Lurbe E, Mahfoud F, Manolis A, Miglinas M, Narkiewicz K, Niiranen T, Palatini P, Parati G, Pathak A, Persu A, Polonia J, Redon J, Sarafidis P, Schmieder R, Spronck B, Stabouli S, Stergiou G, Taddei S, Thomopoulos C, Tomaszewski M, Van de Borne P, Wanner C, Weber T, Williams B, Zhang ZY, Kjeldsen SE. 2023 ESH Guidelines for the management of arterial hypertension The Task Force for the management of arterial hypertension of the European Society of Hypertension: Endorsed by the International Society of Hypertension (ISH) and the European Renal Association (ERA). J Hypertens. 2023 Dec 1;41(12):1874-2071.
- Williams B, Mancia G, Spiering W, Agabiti Rosei E, Azizi M, Burnier M, Clement DL, Coca A, de Simone G, Dominiczak A, Kahan T, Mahfoud F, Redon J, Ruilope L, Zanchetti A, Kerins M, Kjeldsen SE, Kreutz R, Laurent S, Lip GYH, McManus R, Narkiewicz K, Ruschitzka F, Schmieder RE, Shlyakhto E, Tsioufis C, Aboyans V, Desormais I; Authors/Task Force Members:. 2018 ESC/ESH Guidelines for the management of arterial hypertension: The Task Force for the management of arterial hypertension of the European Society of Cardiology and the European Society of Hypertension: The Task Force for the management of arterial hypertension of the European Society of Cardiology and the European Society of Hypertension. J Hypertens. 2018 Oct;36(10):1953-2041.
- Unger T, Borghi C, Charchar F, Khan NA, Poulter NR, Prabhakaran D, Ramirez A, Schlaich M, Stergiou GS, Tomaszewski M, Wainford RD, Williams B, Schutte AE. 2020 International Society of Hypertension Global Hypertension Practice Guidelines. Hypertension. 2020 Jun;75(6):1334-1357.
- Yang YL, Xiang ZJ, Yang JH, Wang WJ, Xu ZC, Xiang RL. Association of β-blocker use with survival and pulmonary function in patients with chronic obstructive pulmonary and cardiovascular disease: a systematic review and meta-analysis. Eur Heart J. 2020 Dec 7;41(46):4415-4422.
- Hansildaar R, Vedder D, Baniaamam M, Tausche AK, Gerritsen M, Nurmohamed MT. Cardiovascular risk in inflammatory arthritis: rheumatoid arthritis and gout. Lancet Rheumatol. 2021 Jan;3(1):e58-e70.
- Krishnan E, Kwoh CK, Schumacher HR, Kuller L. Hyperuricemia and incidence of hypertension among men without metabolic syndrome. Hypertension. 2007 Feb;49(2):298-303.
- Bombelli M, Ronchi I, Volpe M, Facchetti R, Carugo S, Dell’oro R, Cuspidi C, Grassi G, Mancia G. Prognostic value of serum uric acid: new-onset in and out-of-office hypertension and long-term mortality. J Hypertens. 2014 Jun;32(6):1237-44.
- Cicero AF, Salvi P, D’Addato S, Rosticci M, Borghi C; Brisighella Heart Study group. Association between serum uric acid, hypertension, vascular stiffness and subclinical atherosclerosis: data from the Brisighella Heart Study. J Hypertens. 2014 Jan;32(1):57-64.
- Borghi C, Agnoletti D, Cicero AFG, Lurbe E, Virdis A. Uric Acid and Hypertension: a Review of Evidence and Future Perspectives for the Management of Cardiovascular Risk. Hypertension. 2022 Sep;79(9):1927-1936.
- Bhole V, Krishnan E. Gout and the heart. Rheum Dis Clin North Am. 2014 Feb;40(1):125-43.
- Ndrepepa G. Uric acid and cardiovascular disease. Clin Chim Acta. 2018 Sep;484:150-163.
- Agarwal V, Hans N, Messerli FH. Effect of allopurinol on blood pressure: a systematic review and meta-analysis. J Clin Hypertens (Greenwich). 2013 Jun;15(6):435-42.
- Chen JH, Lan JL, Cheng CF, Liang WM, Lin HY, Tsay GJ, Yeh WT, Pan WH. Effect of Urate-lowering Therapy on the Risk of Cardiovascular Disease and All-cause Mortality in Patients with Gout: A Case-matched Cohort Study. J Rheumatol. 2015 Sep;42(9):1694-701.
- Gill D, Cameron AC, Burgess S, Li X, Doherty DJ, Karhunen V, Abdul-Rahim AH, Taylor-Rowan M, Zuber V, Tsao PS, Klarin D; VA Million Veteran Program; Evangelou E, Elliott P, Damrauer SM, Quinn TJ, Dehghan A, Theodoratou E, Dawson J, Tzoulaki I. Urate, Blood Pressure, and Cardiovascular Disease: Evidence From Mendelian Randomization and Meta-Analysis of Clinical Trials. Hypertension. 2021 Feb;77(2):383-392.
- Drosos GC, Vedder D, Houben E, Boekel L, Atzeni F, Badreh S, Boumpas DT, Brodin N, Bruce IN, González-Gay MÁ, Jacobsen S, Kerekes G, Marchiori F, Mukhtyar C, Ramos-Casals M, Sattar N, Schreiber K, Sciascia S, Svenungsson E, Szekanecz Z, Tausche AK, Tyndall A, van Halm V, Voskuyl A, Macfarlane GJ, Ward MM, Nurmohamed MT, Tektonidou MG. EULAR recommendations for cardiovascular risk management in rheumatic and musculoskeletal diseases, including systemic lupus erythematosus and antiphospholipid syndrome. Ann Rheum Dis. 2022 Jun;81(6):768-779.
- Cebollada J, Buisan C. Therapeutic role of colchicine in reducing cardiovascular risk associated with inflammation. Endocrinol Diabetes Nutr (Engl Ed). 2022 Oct;69(8):551-553.
- Burnier M. Gout and hyperuricaemia: modifiable cardiovascular risk factors? Front Cardiovasc Med. 2023 May 25;10:1190069.
- Mackenzie IS, Hawkey CJ, Ford I, Greenlaw N, Pigazzani F, Rogers A, Struthers AD, Begg AG, Wei L, Avery AJ, Taggar JS, Walker A, Duce SL, Barr RJ, Dumbleton JS, Rooke ED, Townend JN, Ritchie LD, MacDonald TM; ALL-HEART Study Group. Allopurinol versus usual care in UK patients with ischaemic heart disease (ALL-HEART): a multicentre, prospective, randomised, open-label, blinded-endpoint trial. Lancet. 2022 Oct 8;400(10359):1195-1205.
- White WB, Saag KG, Becker MA, Borer JS, Gorelick PB, Whelton A, Hunt B, Castillo M, Gunawardhana L; CARES Investigators. Cardiovascular Safety of Febuxostat or Allopurinol in Patients with Gout. N Engl J Med. 2018 Mar 29;378(13):1200-1210.
- Borghi C, Agabiti-Rosei E, Johnson RJ, Kielstein JT, Lurbe E, Mancia G, Redon J, Stack AG, Tsioufis KP. Hyperuricaemia and gout in cardiovascular, metabolic and kidney disease. Eur J Intern Med. 2020 Oct;80:1-11.
- Choi HK, Soriano LC, Zhang Y, Rodríguez LA. Antihypertensive drugs and risk of incident gout among patients with hypertension: population based case-control study. BMJ. 2012 Jan 12;344:d8190.
- Moriwaki, Y. Effects on uric acid metabolism of the drugs except the antihyperuricemics. J. Bioequivalence Bioavailab. 2014,6, 010–017.
- Taneja AK, Gaze D, Coats AJ, Dumitrascu D, Spinarova L, Collinson P, Roughton M, Flather MD; SENIORS Investigators. Effects of nebivolol on biomarkers in elderly patients with heart failure. Int J Cardiol. 2014 Aug 1;175(2):253-60.
- Høieggen A, Alderman MH, Kjeldsen SE, Julius S, Devereux RB, De Faire U, Fyhrquist F, Ibsen H, Kristianson K, Lederballe-Pedersen O, Lindholm LH, Nieminen MS, Omvik P, Oparil S, Wedel H, Chen C, Dahlöf B; LIFE Study Group. The impact of serum uric acid on cardiovascular outcomes in the LIFE study. Kidney Int. 2004 Mar;65(3):1041-9.
- GBD 2019 Risk Factors Collaborators. Global burden of 87 risk factors in 204 countries and territories, 1990-2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet. 2020 Oct 17;396(10258):1223-1249.
- Borghi C, et al. ConsideRazionI Su goTta, Acido urico e rischio cardiovascoLare.Evidenze, aspetti controversi e prospettive future-CRISTAL. Sinergie Edizioni Scientifiche. 2012.
- Mahomed FA. On chronic Bright’s disease, and its essential symptoms. Lancet 1879; I:398–404.
- Sanchez-Lozada LG, Rodriguez-Iturbe B, Kelley EE, Nakagawa T, Madero M, Feig DI, Borghi C, Piani F, Cara-Fuentes G, Bjornstad P, Lanaspa MA, Johnson RJ. Uric Acid and Hypertension: An Update With Recommendations. Am J Hypertens. 2020 Jul 18;33(7):583-594.
- Gunawardhana L, McLean L, Punzi HA, Hunt B, Palmer RN, Whelton A, et al. Effect of Febuxostat on Ambulatory Blood Pressure in Subjects With Hyperuricemia and Hypertension: A Phase 2 Randomized Placebo-Controlled Study. J Am Heart Assoc. 2017 Nov 4;6(11).
- Clarson LE, Chandratre P, Hider SL, Belcher J, Heneghan C, Roddy E, Mallen CD. Increased cardiovascular mortality associated with gout: a systematic review and meta-analysis. Eur J Prev Cardiol. 2015 Mar;22(3):335-43.
- Klauser AS, Halpern EJ, Strobl S, Gruber J, Feuchtner G, Bellmann-Weiler R, Weiss G, Stofferin H, Jaschke W. Dual-Energy Computed Tomography Detection of Cardiovascular Monosodium Urate Deposits in Patients With Gout. JAMA Cardiol. 2019 Oct 1;4(10):1019-1028.
- Diaz-Torne C, Ortiz MA, Garcia-Guillen A, Jeria-Navarro S, Sainz L, Fernandez-Sanchez S, Corominas H, Vidal S. The inflammatory role of silent urate crystal deposition in intercritical gout. Rheumatology (Oxford). 2021 Nov 3;60(11):5463-5472.
- Wang L, Zhang X, Shen J, Wei Y, Zhao T, Xiao N, Lv X, Qin D, Xu Y, Zhou Y, Xie J, Li Z, Xie Z. Models of gouty nephropathy: exploring disease mechanisms and identifying potential therapeutic targets. Front Med (Lausanne). 2024 Feb 29;11:1305431.
- Richette P, Doherty M, Pascual E, Barskova V, Becce F, Castañeda-Sanabria J, Coyfish M, Guillo S, Jansen TL, Janssens H, Lioté F, Mallen C, Nuki G, Perez-Ruiz F, Pimentao J, Punzi L, Pywell T, So A, Tausche AK, Uhlig T, Zavada J, Zhang W, Tubach F, Bardin T. 2016 updated EULAR evidence-based recommendations for the management of gout. Ann Rheum Dis. 2017 Jan;76(1):29-42.
- Johnson RJ, Choi HK, Yeo AE, Lipsky PE. Pegloticase Treatment Significantly Decreases Blood Pressure in Patients With Chronic Gout. Hypertension. 2019 Jul;74(1):95-101.
- Shao Q, Wang J. The Role of Ultrasound Semi-Quantitative Scoring in the Diagnosis and Assessment of Gout and Hyperuricemia. J Ultrasound Med. 2024 Feb;43(2):281-291.
- Dalbeth N, House ME, Aati O, Tan P, Franklin C, Horne A, Gamble GD, Stamp LK, Doyle AJ, McQueen FM. Urate crystal deposition in asymptomatic hyperuricaemia and symptomatic gout: a dual energy CT study. Ann Rheum Dis. 2015 May;74(5):908-11.
- Virdis A, Masi S, Casiglia E, Tikhonoff V, Cicero AFG, Ungar A, Rivasi G, Salvetti M, Barbagallo CM, Bombelli M, Dell’Oro R, Bruno B, Lippa L, D’Elia L, Verdecchia P, Mallamaci F, Cirillo M, Rattazzi M, Cirillo P, Gesualdo L, Mazza A, Giannattasio C, Maloberti A, Volpe M, Tocci G, Georgiopoulos G, Iaccarino G, Nazzaro P, Parati G, Palatini P, Galletti F, Ferri C, Desideri G, Viazzi F, Pontremoli R, Muiesan ML, Grassi G, Borghi C; from the Working Group on Uric Acid and Cardiovascular Risk of the Italian Society of Hypertension. Identification of the Uric Acid Thresholds Predicting an Increased Total and Cardiovascular Mortality Over 20 Years. Hypertension. 2020 Feb;75(2):302-308.
- Johnson RJ, Bakris GL, Borghi C, Chonchol MB, Feldman D, Lanaspa MA, Merriman TR, Moe OW, Mount DB, Sanchez Lozada LG, Stahl E, Weiner DE, Chertow GM. Hyperuricemia, Acute and Chronic Kidney Disease, Hypertension, and Cardiovascular Disease: Report of a Scientific Workshop Organized by the National Kidney Foundation. Am J Kidney Dis. 2018 Jun;71(6):851-865.
- Borghi C, Desideri G. Urate-Lowering Drugs and Prevention of Cardiovascular Disease: The Emerging Role of Xanthine Oxidase Inhibition. Hypertension. 2016 Mar;67(3):496-8.
- Scheepers LE, Wei FF, Stolarz-Skrzypek K, Malyutina S, Tikhonoff V, Thijs L, Salvi E, Barlassina C, Filipovský J, Casiglia E, Nikitin Y, Kawecka-Jaszcz K, Manunta P, Cusi D, Boonen A, Staessen JA, Arts IC. Xanthine oxidase gene variants and their association with blood pressure and incident hypertension: a population study. J Hypertens. 2016 Nov;34(11):2147-54.
- Miah R, Fariha KA, Sony SA, Ahmed S, Hasan M, Mou AD, Barman Z, Hasan A, Mohanto NC, Ali N. Association of serum xanthine oxidase levels with hypertension: a study on Bangladeshi adults. Sci Rep. 2022 Dec 16;12(1):21727.
- Polito L, Bortolotti M, Battelli MG, Bolognesi A. Xanthine oxidoreductase: A leading actor in cardiovascular disease drama. Redox Biol. 2021 Nov 24;48:102195.
- Casiglia E, Tikhonoff V, Virdis A, Masi S, Barbagallo CM, Bombelli M, Bruno B, Cicero AFG, Cirillo M, Cirillo P, Desideri G, D’Elia L, Ferri C, Galletti F, Gesualdo L, Giannattasio C, Iaccarino G, Lippa L, Mallamaci F, Maloberti A, Mazza A, Muiesan ML, Nazzaro P, Palatini P, Parati G, Pontremoli R, Quarti-Trevano F, Rattazzi M, Rivasi G, Salvetti M, Tocci G, Ungar A, Verdecchia P, Viazzi F, Volpe M, Grassi G, Borghi C; Working Group on Uric Acid and Cardiovascular Risk of the Italian Society of Hypertension (SIIA). Serum uric acid and fatal myocardial infarction: detection of prognostic cut-off values: The URRAH (Uric Acid Right for Heart Health) study. J Hypertens. 2020 Mar;38(3):412-419.
- Otaki Y, Watanabe T, Kinoshita D, Yokoyama M, Takahashi T, Toshima T, Sugai T, Murase T, Nakamura T, Nishiyama S, Takahashi H, Arimoto T, Shishido T, Miyamoto T, Kubota I. Association of plasma xanthine oxidoreductase activity with severity and clinical outcome in patients with chronic heart failure. Int J Cardiol. 2017 Feb 1;228:151-157.
- Bredemeier M, Lopes LM, Eisenreich MA, Hickmann S, Bongiorno GK, d’Avila R, Morsch ALB, da Silva Stein F, Campos GGD. Xanthine oxidase inhibitors for prevention of cardiovascular events: a systematic review and meta-analysis of randomized controlled trials. BMC Cardiovasc Disord. 2018 Feb 7;18(1):24.
- Givertz MM, Anstrom KJ, Redfield MM, Deswal A, Haddad H, Butler J, Tang WH, Dunlap ME, LeWinter MM, Mann DL, Felker GM, O’Connor CM, Goldsmith SR, Ofili EO, Saltzberg MT, Margulies KB, Cappola TP, Konstam MA, Semigran MJ, McNulty SE, Lee KL, Shah MR, Hernandez AF; NHLBI Heart Failure Clinical Research Network. Effects of Xanthine Oxidase Inhibition in Hyperuricemic Heart Failure Patients: The Xanthine Oxidase Inhibition for Hyperuricemic Heart Failure Patients (EXACT-HF) Study. Circulation. 2015 May 19;131(20):1763-71.
- Desideri G, Castaldo G, Lombardi A, Mussap M, Testa A, Pontremoli R, Punzi L, Borghi C. Is it time to revise the normal range of serum uric acid levels? Eur Rev Med Pharmacol Sci. 2014;18(9):1295-306.
- Bardin T. Hyperuricemia starts at 360 micromoles (6 mg/dL). Joint Bone Spine. 2015 May;82(3):141-3.
- Feig DI, Kang DH, Johnson RJ. Uric acid and cardiovascular risk. N Engl J Med. 2008 Oct 23;359(17):1811-21.
- Viazzi F, Leoncini G, Vercelli M, Deferrari G, Pontremoli R. Serum uric acid levels predict new-onset type 2 diabetes in hospitalized patients with primary hypertension: the MAGIC study. Diabetes Care. 2011 Jan;34(1):126-8.
- Sui X, Church TS, Meriwether RA, Lobelo F, Blair SN. Uric acid and the development of metabolic syndrome in women and men. Metabolism. 2008 Jun;57(6):845-52.
- Diallo A, Diallo MF, Carlos-Bolumbu M, Galtier F. Uric acid-lowering effects of sodium-glucose cotransporter 2 inhibitors for preventing cardiovascular events and mortality: A systematic review and meta-analysis. Diabetes Obes Metab. 2024 Feb 5.
- Selvaraj S, Claggett BL, Pfeffer MA, Desai AS, Mc Causland FR, McGrath MM, Anand IS, van Veldhuisen DJ, Kober L, Janssens S, Cleland JGF, Pieske B, Rouleau JL, Zile MR, Shi VC, Lefkowitz MP, McMurray JJV, Solomon SD. Serum uric acid, influence of sacubitril-valsartan, and cardiovascular outcomes in heart failure with preserved ejection fraction: PARAGON-HF. Eur J Heart Fail. 2020 Nov;22(11):2093-2101.
- Keen HI, Davis WA, Latkovic E, Drinkwater JJ, Nossent J, Davis TME. Ultrasonographic assessment of joint pathology in type 2 diabetes and hyperuricemia: The Fremantle Diabetes Study Phase II. J Diabetes Complications. 2018 Apr;32(4):400-405.
- Ottaviani S, Bardin T, Richette P. Usefulness of ultrasonography for gout. Joint Bone Spine. 2012 Oct;79(5):441-5.
- Andrés M, Quintanilla MA, Sivera F, Sánchez-Payá J, Pascual E, Vela P, Ruiz-Nodar JM. Silent Monosodium Urate Crystal Deposits Are Associated With Severe Coronary Calcification in Asymptomatic Hyperuricemia: An Exploratory Study. Arthritis Rheumatol. 2016 Jun;68(6):1531-9.
- Chhana A, Lee G, Dalbeth N. Factors influencing the crystallization of monosodium urate: a systematic literature review. BMC Musculoskelet Disord. 2015 Oct 14;16:296.
- Elion GB, Callahan SW, Nathan HC, Bieber S, Rundles RW, Hitchings GH. Potentiation by inhibition of drug degradation: 6-substituted purines and xanthine oxidase. Biochemical Pharmacology. 1963;12, 85-93.
- Pacher P, Nivorozhkin A, Szabó C. Therapeutic effects of xanthine oxidase inhibitors: renaissance half a century after the discovery of allopurinol. Pharmacol Rev. 2006 Mar;58(1):87-114.
- Takano Y, Hase-Aoki K, Horiuchi H, Zhao L, Kasahara Y, Kondo S, Becker MA. Selectivity of febuxostat, a novel non-purine inhibitor of xanthine oxidase/xanthine dehydrogenase. Life Sci. 2005 Mar 4;76(16):1835-47.
- Terkeltaub R. Update on gout: new therapeutic strategies and options. Nat Rev Rheumatol. 2010 Jan;6(1):30-8.
- Becker MA, Schumacher HR Jr, Wortmann RL, MacDonald PA, Eustace D, Palo WA, Streit J, Joseph-Ridge N. Febuxostat compared with allopurinol in patients with hyperuricemia and gout. N Engl J Med. 2005 Dec 8;353(23):2450-61.
- Schumacher HR Jr, Becker MA, Wortmann RL, Macdonald PA, Hunt B, Streit J, Lademacher C, Joseph-Ridge N. Effects of febuxostat versus allopurinol and placebo in reducing serum urate in subjects with hyperuricemia and gout: a 28-week, phase III, randomized, double-blind, parallel-group trial. Arthritis Rheum. 2008 Nov 15;59(11):1540-8.
- Horiuchi H, Ota M, Kobayashi M, Kaneko H, Kasahara Y, Nishimura S, Kondo S, Komoriya K. A comparative study on the hypouricemic activity and potency in renal xanthine calculus formation of two xanthine oxidase/xanthine dehydrogenase inhibitors: TEI-6720 and allopurinol in rats. Res Commun Mol Pathol Pharmacol. 1999;104(3):307-19.
- Mayer MD, Khosravan R, Vernillet L, Wu JT, Joseph-Ridge N, Mulford DJ. Pharmacokinetics and pharmacodynamics of febuxostat, a new non-purine selective inhibitor of xanthine oxidase in subjects with renal impairment. Am J Ther. 2005 Jan-Feb;12(1):22-34.
- Mackenzie IS, Ford I, Nuki G, Hallas J, Hawkey CJ, Webster J, Ralston SH, Walters M, Robertson M, De Caterina R, Findlay E, Perez-Ruiz F, McMurray JJV, MacDonald TM; FAST Study Group. Long-term cardiovascular safety of febuxostat compared with allopurinol in patients with gout (FAST): a multicentre, prospective, randomised, open-label, non-inferiority trial. Lancet. 2020 Nov 28;396(10264):1745-1757.
- White WB, Saag KG, Becker MA, Borer JS, Gorelick PB, Whelton A, Hunt B, Castillo M, Gunawardhana L; CARES Investigators. Cardiovascular Safety of Febuxostat or Allopurinol in Patients with Gout. N Engl J Med. 2018 Mar 29;378(13):1200-1210.
- Zhang T, Pope JE. Cardiovascular effects of urate-lowering therapies in patients with chronic gout: a systematic review and meta-analysis. Rheumatology (Oxford). 2017 Jul 1;56(7):1144-1153.
Related papers
Lo scenario della medicina attuale è caratterizzato da elementi di complessità generale inimmaginabili due decenni fa ed in grado di rendere molto più difficile la pratica clinica giornaliera. In particolare, la coesistenza di multiple condizioni passibili di un trattamento farmacologico nello stesso soggetto condiziona in maniera forzata alcune delle scelte terapeutiche spingendo alla ricerca di [more info]
Premessa Nell’ultimo decennio l’orizzonte della terapia ipolipemizzante si è arricchita di formidabili strumenti terapeutici quali ezitimibe, inibitori della proteina PCSK9 (PCSK9i) e acido bempedoico. Gli studi su queste molecole hanno permesso non solo di dimostrarne l’efficacia, ma hanno fornito importanti informazioni sull’importanza dell’abbassamento delle LDL nella riduzione del rischio cardiovascolare (CV) e costituiscono la base [more info]
Colesterolemia subottimale come fattore di rischio per le malattie cardiovascolari Il miglioramento delle abitudini alimentari e l’ottimizzazione dei livelli di colesterolo LDL nel sangue – fattore causale e cumulativo - sembrano essere strumenti efficaci per ridurre il rischio di malattie cardiovascolari su base aterosclerotica, che ancora oggi rappresentano una delle principali cause di morte e [more info]