Controllare efficacemente il rischio cardiovascolare nel paziente ipercolesterolemico significa intervenire con decisione su dieta ed attività fisica, ma soprattutto ricorrere senza indugio – se necessario – alla terapia farmacologica. L’armamentario terapeutico contro l’ipercolesterolemia è ormai costituito da una lunga serie di presidi, anche biologici, ma ruota sempre e comunque intorno al cardine costituito da: 1) inibitori della idrossimetilglutaril-coenzima A (HMG-CoA) reduttasi, più semplicemente noti come statine; 2) inibitore della proteina di Niemann-Pick C1-Like 1 (NPC1L1), ezetimibe. Quest’ultima, come ben noto, è una valida alternativa alle statine in casi di vera intolleranza alle stesse, ma soprattutto è la naturale compagna per le statine, nei confronti delle quali manifesta un chiaro effetto sinergico. Pertanto, solo laddove la combinazione fissa tra statina ad elevata intensità+ezetimibe non riesca a garantire il risultato prefissato, il clinico accorto ricorrerà alle altre valide risorse terapeutiche: inibitori della proproteina convertasi subtilisina/kexina tipo 9 (PCSK9) (1), small interfering RNA (siRNA), e/o acido bempedoico (2).
Le statine, come è noto, riducono la sintesi epatica del colesterolo inibendo in modo competitivo l’HMG-CoA reduttasi, enzima limitante la biosintesi del colesterolo. Ottenere una inibizione superiore al 50-70%, tuttavia, è solo teoricamente possibile (3-8). In considerazione di ciò, tranne casi particolari – in cui la riduzione della LDL colesterolemia auspicata è modesta – le Linee Guida raccomando sempre l’uso di una statina ad elevata intensità (3). Infatti, la riduzione del colesterolo intracellulare promuove una maggiore espressione del recettore per LDL sulla superficie degli epatociti, determinando un aumento della captazione del colesterolo LDL circolante. Ciò si traduce in una diminuzione della concentrazione plasmatica di LDL. L’entità della riduzione del colesterolo LDL dipende però dalla tipologia di statina ben più che dal relativo dosaggio (3-8), mentre gli eventi avversi dipendono ben più dal dosaggio che dal tipo di statina (3-8). Un regime ad alta intensità, in questo ambito, è definito come la dose di statina che, in media, riduce il colesterolo LDL circolante di almeno il 50%; un regime ad intensità moderata è in grado di ridurlo del 30–50%, mentre uno a bassa intensità determina una riduzione al massimo pari al 30% (3,4). Sono considerate statine ad alta intensità, pertanto, solo rosuvastatina ed atorvastatina.
Le statine riducono significativamente il rischio di eventi fatali e non fatali in prevenzione cardiovascolare sia primaria che secondaria in un’amplissima serie di scenari clinici (-22% e -10% in 5 anni, rispettivamente, per ogni riduzione di 1 mmol/L di colesterolo LDL), con effetto evidente già nel primo anno di trattamento (5). Anche individui a basso rischio cardiovascolare trattati in prevenzione primaria (6), nonché individui anziani di età superiore ai 75 anni (7) traggono beneficio dall’assunzione di statine, sia in termini di eventi fatali e non fatali che di mortalità globale.
In termini di efficacia, vi è una considerevole variazione interindividuale nella riduzione del colesterolo LDL circolante con la stessa dose della medesima statina, correlabile al retroterra genetico e/o all’aderenza del paziente (8,9). Queste caratteristiche, con particolare riferimento alla scarsa aderenza e/o persistenza in terapia, rappresentano le cause principali della insufficiente risposta al trattamento con statine (10).
La ragione principale per l’interruzione della terapia con statine è l’intolleranza alle stesse, che coincide più che largamente con la riferita comparsa di sintomi muscolari (in inglese statin-associated muscle symptoms, più noti con la sigla SAMS). Tale tossicità muscolare sarebbe legata all’inibizione dell’HMG-CoA reduttasi a livello del miocita, risultando il muscolo scheletrico 40 volte più sensibile rispetto agli epatociti ed ai miocardiociti (11-13). Secondo diversi studi clinici, l’intolleranza alle statine riguarderebbe una percentuale variabile dal 10% al 30% dei pazienti (14). Tuttavia, diverse evidenze condotte in doppio cieco sembrano – a nostro avviso molto più che “sembrano” – supportare fortemente l’ipotesi di un chiaro effetto nocebo, con eccesso di eventi avversi muscolari solo quando il paziente è consapevole dell’assunzione della statina e non quando il tipo di compressa assunta è ignoto (14,15). Malgrado tale ipotesi sembri corrispondere più che largamente al vero, aderenza e persistenza in terapia con statine sono drammaticamente basse. In Italia, le statine appartengono alle categorie terapeutiche con percentuali più alte (41,6%) di ridotta aderenza (copertura terapeutica <40%), soprattutto tra individui di età compresa tra i 65 e gli 84 anni (42,3%) (16,17). Analogamente, i dati sulla persistenza al trattamento indicano al 50% la probabilità di interrompere il trattamento medesimo già entro i 150 giorni dal suo inizio (130 per le donne, 180 per gli uomini), con picco massimo nella fascia di età compresa tra i 55 e i 64 anni. Circa un quinto degli utilizzatori interrompe la terapia dopo un mese dall’inizio e solo un terzo dei nuovi utilizzatori risulta essere ancora in trattamento ad un anno dall’inizio della terapia (uomini: 38%; donne: 29%) (16).
Per questi motivi, certamente il clinico accorto dovrà spingere sul tasto della terapia non farmacologica e sulla prescrizione delle molecole – quali l’acido bempedoico e/o l’ezetimibe – che già prima citavamo (1,2). Ben prima del ricorso ad altre molecole, tuttavia, il buon senso clinico suggerisce a priori:
- di usare quasi esclusivamente una delle due statine ad elevata intensità;
- di non credere pedissequamente alla riferita mialgia, ma di testare l’effettiva esistenza della stessa attraverso un colloquio aperto con il paziente e la verifica oggettiva dei sintomi, anche successivamente ad un periodo – breve – di sospensione della terapia statinica;
- di usare quasi sistematicamente la combinazione fissa statina ad elevata intensità+ ezetimibe.
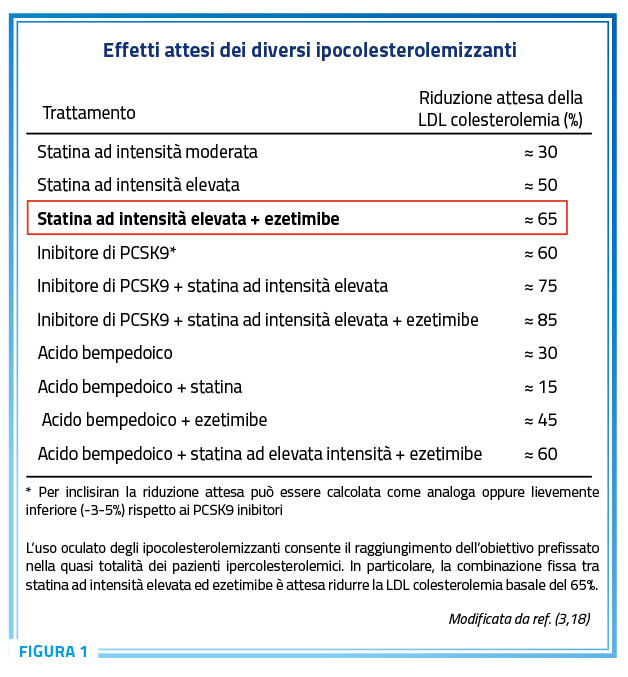
In questo ambito, secondo le Linee Guida di pertinenza lipidologica (Figura 1) (3,18), la combinazione fissa tra statina ad intensità elevata ed ezetimibe è attesa ridurre la LDL colesterolemia basale del 65% circa, cioè la medesima riduzione ottenibile con alirocumab oppure evolocumab oppure inclisiran.
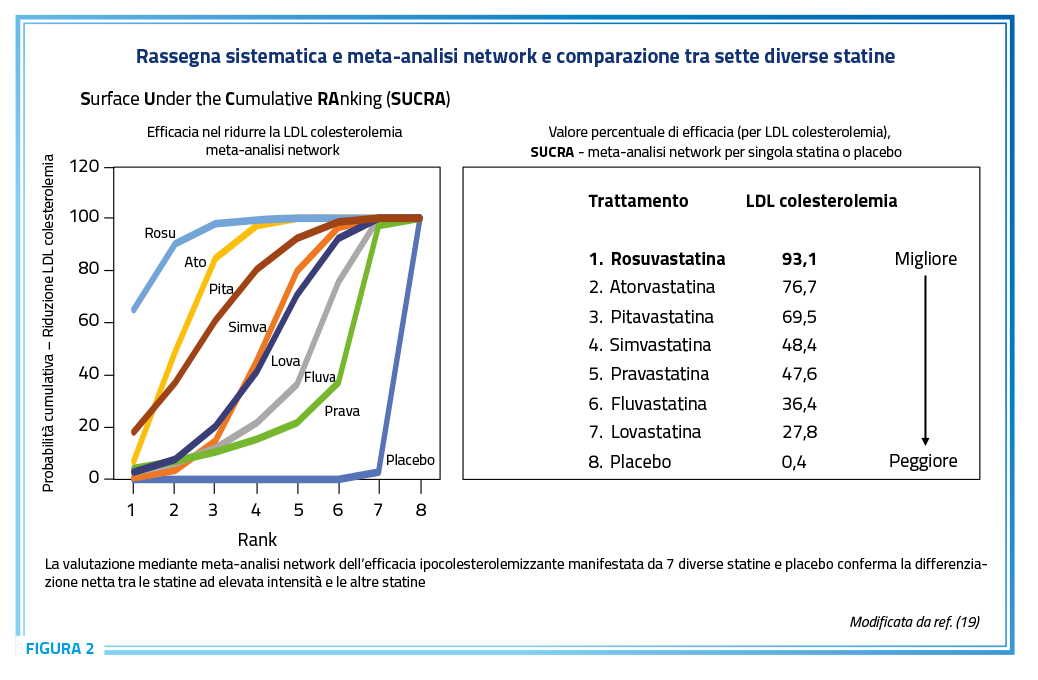
Tra le statine, una meta-analisi network chiaramente mostra la superiorità di rosuvastatina ed atorvastatina rispetto alle rimanenti statine, con maggiore efficacia della prima versus la seconda (Figura 2) (19).
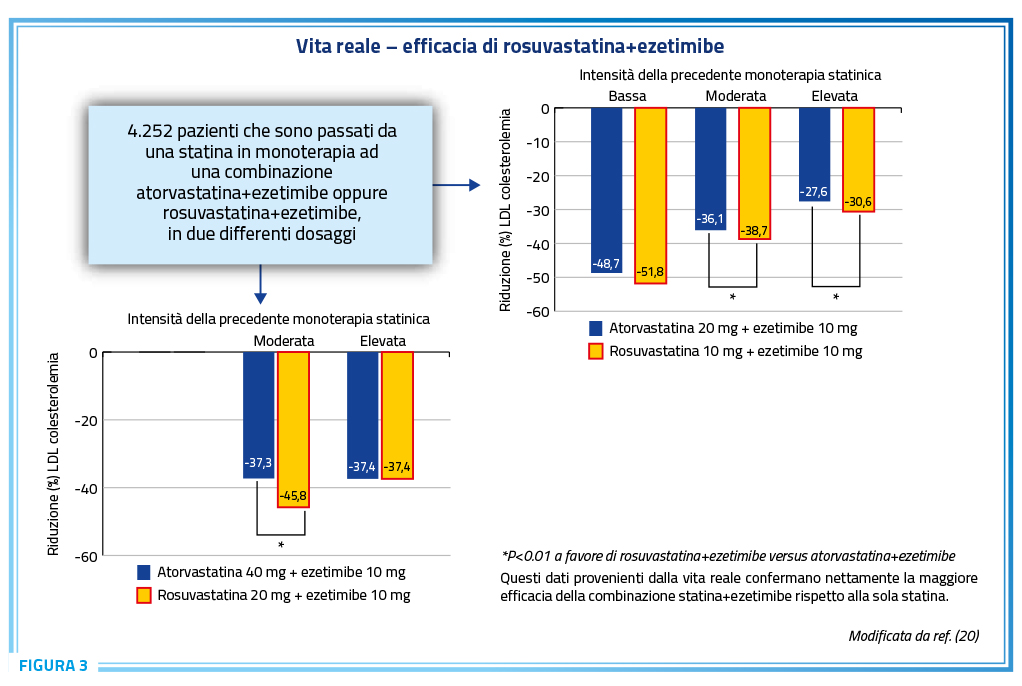
In accordo completo con ciò, la combinazione atorvastatina+ezetimibe, in due differenti dosaggi di statina è risultata essere estremamente efficace nel ridurre ulteriormente la LDL colesterolemia in pazienti provenienti da monoterapia statinica. Tuttavia, detta combinazione – pur estremamente efficace – lo era significativamente meno rispetto alla combinazione rosuvastatina+ezetimibe (Figura 3) (20).
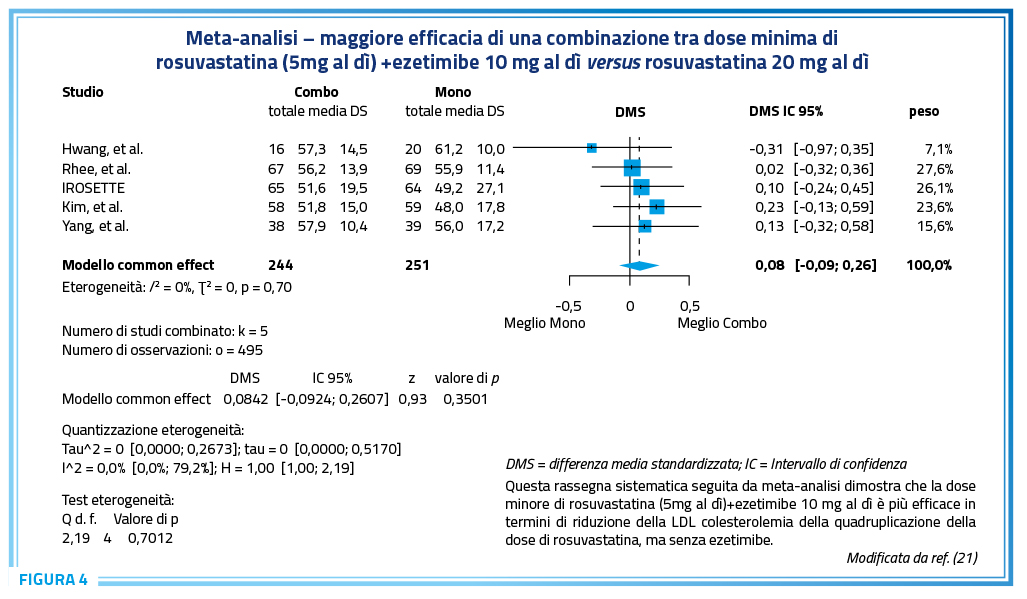
Pertanto, laddove si voglia non considerare quel ristretto numero di pazienti che necessita di una riduzione non consistente della LDL colesterolemia, che potranno quindi essere trattati con la sola ezetimine oppure con una statina ad intensità moderata+ezetimibe oppure con acido bempedoico, la quasi totalità dei pazienti in prevenzione secondaria e la grande maggioranza di quelli in prevenzione primaria necessiterà del trattamento – efficace e sicuro – con statina ad intensità elevata+ezetimibe, sempre in combinazione fissa al fine di migliorare aderenza e persistenza. Tra le statine ad intensità elevata, una meta-analisi network (Figura 2) e dati dalla vita reale (Figura 3) dimostrano la superiorità di rosuvastatina e di rosuvastatina+ezetimibe nei confronti, rispettivamente, di tutte le altre statine considerate come monoterapia e delle altre combinazioni tra altre statine ad intensità elevata+ezetimibe. Ad ulteriore conforto della maggiore validità ipocolesterolemizzante della combinazione fissa rosuvastatina+ezetimibe versus la monoterapia statinica, una esaustiva rassegna sistematica con meta-analisi (21) ha chiaramente dimostrato che persino la dose minima (5mg al dì) di rosuvastatina, quando in combinazione con ezetimibe 10mg al dì, è più efficace rispetto alla quadruplicazione della dose di rosuvastatina (fino a 20mg al dì) (Figura 4).
Ciò non significa che le terapie con statina ad intensità non elevata+ezetimibe oppure la monoterapia con ezetimibe vadano escluse dal nostro bagaglio terapeutico. Al contrario, entrambe le opzioni mantengono una consistente appropriatezza nel paziente che necessiti solo di una modesta riduzione della LDL colesterolemia, particolarmente in prevenzione primaria e senza danno d’organo evidente e/o in caso di comprovata intolleranza alle statine (22).
Per la restante parte, ampiamente maggioritaria, della popolazione affetta da ipercolesterolemia, la scelta più appropriata per raggiungere l’obiettivo prefissato di LDL colesterolemia – come dimostrato con evidente forza da consistenti dati clinici controllati (21,22) – è però fondata sulla combinazione fissa di statina ad intensità elevata+ezetimibe.
Bibliografia
- Del Pinto R, Grassi D, Properzi G, Desideri G, Ferri C. Low Density Lipoprotein (LDL) Cholesterol as a Causal Role for Atherosclerotic Disease: Potential Role of PCSK9 Inhibitors. High Blood Press Cardiovasc Prev. 2019;26: 199–207.
- Brandts J, Ray KK. Bempedoic acid, an inhibitor of ATP citrate lyase for the treatment of hypercholesterolemia: early indications and potential. Expert Opin Investig Drugs. 2020;29: 763–770.
- Mach F, Baigent C, Catapano AL, Koskinas KC, Casula M, Badimon L, Chapman MJ, De Backer GG, Delgado V, Ference BA, Graham IM, Halliday A, Landmesser U, Mihaylova B, Pedersen TR, Riccardi G, Richter DJ, Sabatine MS, Taskinen MR, Tokgozoglu L, Wiklund O; ESC Scientific Document Group. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J. 2020 Jan 1;41(1):111-188.
- Grundy SM, Stone NJ, Bailey AL, Beam C, Birtcher KK, Blumenthal RS, Braun LT, de Ferranti S, Faiella-Tommasino J, Forman DE, Goldberg R, Heidenreich PA, Hlatky MA, Jones DW, Lloyd-Jones D, Lopez-Pajares N, Ndumele CE, Orringer CE, Peralta CA, Saseen JJ, Smith SC Jr, Sperling L, Virani SS, Yeboah J. 2018 AHA/ACC/AACVPR/AAPA/ABC/ACPM/ADA/AGS/APhA/ASPC/NLA/PCNA Guideline on the Management of Blood Cholesterol: Executive Summary: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation. 2019 Jun 18;139(25):e1046-e1081.
- Cholesterol Treatment Trialists’ (CTT) Collaboration; Baigent C, Blackwell L, Emberson J, Holland LE, Reith C, Bhala N, Peto R, Barnes EH, Keech A, Simes J, Collins R. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet. 2010 Nov 13;376(9753):1670-81.
- Cholesterol Treatment Trialists’ (CTT) Collaborators; Mihaylova B, Emberson J, Blackwell L, Keech A, Simes J, Barnes EH, Voysey M, Gray A, Collins R, Baigent C. The effects of lowering LDL cholesterol with statin therapy in people at low risk of vascular disease: meta-analysis of individual data from 27 randomised trials. Lancet. 2012 Aug 11;380(9841):581-90.
- Cholesterol Treatment Trialists’ Collaboration. Efficacy and safety of statin therapy in older people: a meta-analysis of individual participant data from 28 randomised controlled trials. Lancet. 2019;393: 407–415.
- Chasman DI, Giulianini F, MacFadyen J, Barratt BJ, Nyberg F, Ridker PM. Genetic determinants of statin-induced low-density lipoprotein cholesterol reduction: the Justification for the Use of Statins in Prevention: an Intervention Trial Evaluating Rosuvastatin (JUPITER) trial. Circ Cardiovasc Genet. 2012;5: 257–264.
- Reiner Z. Resistance and intolerance to statins. Nutr Metab Cardiovasc Dis. 2014;24: 1057–1066.
- Zhou Z, Curtis AJ, Breslin M, Nelson M. Letter by Zhou et al Regarding Article, “Statin Toxicity: Mechanistic Insights and Clinical Implications.” Circulation research. 2019. p. e120.
- Muntean DM, Thompson PD, Catapano AL, Stasiolek M, Fabis J, Muntner P, Serban MC, Banach M. Statin-associated myopathy and the quest for biomarkers: can we effectively predict statin-associated muscle symptoms? Drug Discov Today. 2017 Jan;22(1):85-96.
- Bouitbir J, Charles AL, Echaniz-Laguna A, Kindo M, Daussin F, Auwerx J, Piquard F, Geny B, Zoll J. Opposite effects of statins on mitochondria of cardiac and skeletal muscles: a ‘mitohormesis’ mechanism involving reactive oxygen species and PGC-1. Eur Heart J. 2012 Jun;33(11):1397-407.
- Sirvent P, Bordenave S, Vermaelen M, Roels B, Vassort G, Mercier J, Raynaud E, Lacampagne A. Simvastatin induces impairment in skeletal muscle while heart is protected. Biochem Biophys Res Commun. 2005 Dec 23;338(3):1426-34.
- Ward NC, Watts GF, Eckel RH. Statin Toxicity. Circ Res. 2019;124: 328–350.
- Wood FA, Howard JP, Finegold JA, Nowbar AN, Thompson DM, Arnold AD, Rajkumar CA, Connolly S, Cegla J, Stride C, Sever P, Norton C, Thom SAM, Shun-Shin MJ, Francis DP. N-of-1 Trial of a Statin, Placebo, or No Treatment to Assess Side Effects. N Engl J Med. 2020 Nov 26;383(22):2182-2184.
- Osservatorio Nazionale sull’impiego dei Medicinali. L’uso dei Farmaci in Italia. Rapporto Nazionale Anno 2021. Roma: Agenzia Italiana del Farmaco, 2022. https://www.aifa.gov.it/documents/20142/1740782/Rapporto-OsMed-2021.pdf
- Osservatorio Nazionale sull’impiego dei Medicinali. L’uso dei farmaci in Italia. Rapporto Nazionale Anno 2022. Roma: Agenzia Italiana del Farmaco, 2023. https://www.aifa.gov.it/documents/20142/1967301/Rapporto-OsMed-2022.pdf
- Biolo G, Vinci P, Mangogna A, Landolfo M, Schincariol P, Fiotti N, Mearelli F, Di Girolamo FG. Mechanism of action and therapeutic use of bempedoic acid in atherosclerosis and metabolic syndrome. Front Cardiovasc Med. 2022 Oct 28;9:1028355.
- Zhang X, Xing L, Jia X, Pang X, Xiang Q, Zhao X, Ma L, Liu Z, Hu K, Wang Z, Cui Y. Comparative Lipid-Lowering/Increasing Efficacy of 7 Statins in Patients with Dyslipidemia, Cardiovascular Diseases, or Diabetes Mellitus: Systematic Review and Network Meta-Analyses of 50 Randomized Controlled Trials. Cardiovasc Ther. 2020 Apr 23;2020:3987065.
- Lee J, Lee SH, Kim H, Lee SH, Cho JH, Lee H, Yim HW, Yoon KH, Kim HS, Kim JH. Low-density lipoprotein cholesterol reduction and target achievement after switching from statin monotherapy to statin/ezetimibe combination therapy: Real-world evidence. J Clin Pharm Ther. 2021 Feb;46(1):134-142.
- Kang Y, Park JM, Lee SH Moderate-Intensity Rosuvastatin/Ezetimibe Combination versus Quadruple-Dose Rosuvastatin Monotherapy: A Meta-Analysis and Systemic Review.Yonsei Med J 2024;65(1):19-26.
- Katzmann JL, Kieble M, Enners S, Böhm M, Mahfoud F, Laufs U, Schulz M. Trends in Ezetimibe Prescriptions as Monotherapy or Fixed-Dose Combination in Germany 2012-2021. Front Cardiovasc Med. 2022 13;9:912785.
Controllare efficacemente il rischio cardiovascolare nel paziente ipercolesterolemico significa intervenire con decisione su dieta ed attività fisica, ma soprattutto ricorrere senza indugio – se necessario – alla terapia farmacologica. L’armamentario terapeutico contro l’ipercolesterolemia è ormai costituito da una lunga serie di presidi, anche biologici, ma ruota sempre e comunque intorno al cardine costituito da: 1) inibitori della idrossimetilglutaril-coenzima A (HMG-CoA) reduttasi, più semplicemente noti come statine; 2) inibitore della proteina di Niemann-Pick C1-Like 1 (NPC1L1), ezetimibe. Quest’ultima, come ben noto, è una valida alternativa alle statine in casi di vera intolleranza alle stesse, ma soprattutto è la naturale compagna per le statine, nei confronti delle quali manifesta un chiaro effetto sinergico. Pertanto, solo laddove la combinazione fissa tra statina ad elevata intensità+ezetimibe non riesca a garantire il risultato prefissato, il clinico accorto ricorrerà alle altre valide risorse terapeutiche: inibitori della proproteina convertasi subtilisina/kexina tipo 9 (PCSK9) (1), small interfering RNA (siRNA), e/o acido bempedoico (2).
Le statine, come è noto, riducono la sintesi epatica del colesterolo inibendo in modo competitivo l’HMG-CoA reduttasi, enzima limitante la biosintesi del colesterolo. Ottenere una inibizione superiore al 50-70%, tuttavia, è solo teoricamente possibile (3-8). In considerazione di ciò, tranne casi particolari – in cui la riduzione della LDL colesterolemia auspicata è modesta – le Linee Guida raccomando sempre l’uso di una statina ad elevata intensità (3). Infatti, la riduzione del colesterolo intracellulare promuove una maggiore espressione del recettore per LDL sulla superficie degli epatociti, determinando un aumento della captazione del colesterolo LDL circolante. Ciò si traduce in una diminuzione della concentrazione plasmatica di LDL. L’entità della riduzione del colesterolo LDL dipende però dalla tipologia di statina ben più che dal relativo dosaggio (3-8), mentre gli eventi avversi dipendono ben più dal dosaggio che dal tipo di statina (3-8). Un regime ad alta intensità, in questo ambito, è definito come la dose di statina che, in media, riduce il colesterolo LDL circolante di almeno il 50%; un regime ad intensità moderata è in grado di ridurlo del 30–50%, mentre uno a bassa intensità determina una riduzione al massimo pari al 30% (3,4). Sono considerate statine ad alta intensità, pertanto, solo rosuvastatina ed atorvastatina.
Le statine riducono significativamente il rischio di eventi fatali e non fatali in prevenzione cardiovascolare sia primaria che secondaria in un’amplissima serie di scenari clinici (-22% e -10% in 5 anni, rispettivamente, per ogni riduzione di 1 mmol/L di colesterolo LDL), con effetto evidente già nel primo anno di trattamento (5). Anche individui a basso rischio cardiovascolare trattati in prevenzione primaria (6), nonché individui anziani di età superiore ai 75 anni (7) traggono beneficio dall’assunzione di statine, sia in termini di eventi fatali e non fatali che di mortalità globale.
In termini di efficacia, vi è una considerevole variazione interindividuale nella riduzione del colesterolo LDL circolante con la stessa dose della medesima statina, correlabile al retroterra genetico e/o all’aderenza del paziente (8,9). Queste caratteristiche, con particolare riferimento alla scarsa aderenza e/o persistenza in terapia, rappresentano le cause principali della insufficiente risposta al trattamento con statine (10).
La ragione principale per l’interruzione della terapia con statine è l’intolleranza alle stesse, che coincide più che largamente con la riferita comparsa di sintomi muscolari (in inglese statin-associated muscle symptoms, più noti con la sigla SAMS). Tale tossicità muscolare sarebbe legata all’inibizione dell’HMG-CoA reduttasi a livello del miocita, risultando il muscolo scheletrico 40 volte più sensibile rispetto agli epatociti ed ai miocardiociti (11-13). Secondo diversi studi clinici, l’intolleranza alle statine riguarderebbe una percentuale variabile dal 10% al 30% dei pazienti (14). Tuttavia, diverse evidenze condotte in doppio cieco sembrano – a nostro avviso molto più che “sembrano” – supportare fortemente l’ipotesi di un chiaro effetto nocebo, con eccesso di eventi avversi muscolari solo quando il paziente è consapevole dell’assunzione della statina e non quando il tipo di compressa assunta è ignoto (14,15). Malgrado tale ipotesi sembri corrispondere più che largamente al vero, aderenza e persistenza in terapia con statine sono drammaticamente basse. In Italia, le statine appartengono alle categorie terapeutiche con percentuali più alte (41,6%) di ridotta aderenza (copertura terapeutica <40%), soprattutto tra individui di età compresa tra i 65 e gli 84 anni (42,3%) (16,17). Analogamente, i dati sulla persistenza al trattamento indicano al 50% la probabilità di interrompere il trattamento medesimo già entro i 150 giorni dal suo inizio (130 per le donne, 180 per gli uomini), con picco massimo nella fascia di età compresa tra i 55 e i 64 anni. Circa un quinto degli utilizzatori interrompe la terapia dopo un mese dall’inizio e solo un terzo dei nuovi utilizzatori risulta essere ancora in trattamento ad un anno dall’inizio della terapia (uomini: 38%; donne: 29%) (16).
Per questi motivi, certamente il clinico accorto dovrà spingere sul tasto della terapia non farmacologica e sulla prescrizione delle molecole – quali l’acido bempedoico e/o l’ezetimibe – che già prima citavamo (1,2). Ben prima del ricorso ad altre molecole, tuttavia, il buon senso clinico suggerisce a priori:
- di usare quasi esclusivamente una delle due statine ad elevata intensità;
- di non credere pedissequamente alla riferita mialgia, ma di testare l’effettiva esistenza della stessa attraverso un colloquio aperto con il paziente e la verifica oggettiva dei sintomi, anche successivamente ad un periodo – breve – di sospensione della terapia statinica;
- di usare quasi sistematicamente la combinazione fissa statina ad elevata intensità+ ezetimibe.
In questo ambito, secondo le Linee Guida di pertinenza lipidologica (Figura 1) (3,18), la combinazione fissa tra statina ad intensità elevata ed ezetimibe è attesa ridurre la LDL colesterolemia basale del 65% circa, cioè la medesima riduzione ottenibile con alirocumab oppure evolocumab oppure inclisiran.
Tra le statine, una meta-analisi network chiaramente mostra la superiorità di rosuvastatina ed atorvastatina rispetto alle rimanenti statine, con maggiore efficacia della prima versus la seconda (Figura 2) (19).
In accordo completo con ciò, la combinazione atorvastatina+ezetimibe, in due differenti dosaggi di statina è risultata essere estremamente efficace nel ridurre ulteriormente la LDL colesterolemia in pazienti provenienti da monoterapia statinica. Tuttavia, detta combinazione – pur estremamente efficace – lo era significativamente meno rispetto alla combinazione rosuvastatina+ezetimibe (Figura 3) (20).
Pertanto, laddove si voglia non considerare quel ristretto numero di pazienti che necessita di una riduzione non consistente della LDL colesterolemia, che potranno quindi essere trattati con la sola ezetimine oppure con una statina ad intensità moderata+ezetimibe oppure con acido bempedoico, la quasi totalità dei pazienti in prevenzione secondaria e la grande maggioranza di quelli in prevenzione primaria necessiterà del trattamento – efficace e sicuro – con statina ad intensità elevata+ezetimibe, sempre in combinazione fissa al fine di migliorare aderenza e persistenza. Tra le statine ad intensità elevata, una meta-analisi network (Figura 2) e dati dalla vita reale (Figura 3) dimostrano la superiorità di rosuvastatina e di rosuvastatina+ezetimibe nei confronti, rispettivamente, di tutte le altre statine considerate come monoterapia e delle altre combinazioni tra altre statine ad intensità elevata+ezetimibe. Ad ulteriore conforto della maggiore validità ipocolesterolemizzante della combinazione fissa rosuvastatina+ezetimibe versus la monoterapia statinica, una esaustiva rassegna sistematica con meta-analisi (21) ha chiaramente dimostrato che persino la dose minima (5mg al dì) di rosuvastatina, quando in combinazione con ezetimibe 10mg al dì, è più efficace rispetto alla quadruplicazione della dose di rosuvastatina (fino a 20mg al dì) (Figura 4).
Ciò non significa che le terapie con statina ad intensità non elevata+ezetimibe oppure la monoterapia con ezetimibe vadano escluse dal nostro bagaglio terapeutico. Al contrario, entrambe le opzioni mantengono una consistente appropriatezza nel paziente che necessiti solo di una modesta riduzione della LDL colesterolemia, particolarmente in prevenzione primaria e senza danno d’organo evidente e/o in caso di comprovata intolleranza alle statine (22).
Per la restante parte, ampiamente maggioritaria, della popolazione affetta da ipercolesterolemia, la scelta più appropriata per raggiungere l’obiettivo prefissato di LDL colesterolemia – come dimostrato con evidente forza da consistenti dati clinici controllati (21,22) – è però fondata sulla combinazione fissa di statina ad intensità elevata+ezetimibe.
Bibliografia
- Del Pinto R, Grassi D, Properzi G, Desideri G, Ferri C. Low Density Lipoprotein (LDL) Cholesterol as a Causal Role for Atherosclerotic Disease: Potential Role of PCSK9 Inhibitors. High Blood Press Cardiovasc Prev. 2019;26: 199–207.
- Brandts J, Ray KK. Bempedoic acid, an inhibitor of ATP citrate lyase for the treatment of hypercholesterolemia: early indications and potential. Expert Opin Investig Drugs. 2020;29: 763–770.
- Mach F, Baigent C, Catapano AL, Koskinas KC, Casula M, Badimon L, Chapman MJ, De Backer GG, Delgado V, Ference BA, Graham IM, Halliday A, Landmesser U, Mihaylova B, Pedersen TR, Riccardi G, Richter DJ, Sabatine MS, Taskinen MR, Tokgozoglu L, Wiklund O; ESC Scientific Document Group. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J. 2020 Jan 1;41(1):111-188.
- Grundy SM, Stone NJ, Bailey AL, Beam C, Birtcher KK, Blumenthal RS, Braun LT, de Ferranti S, Faiella-Tommasino J, Forman DE, Goldberg R, Heidenreich PA, Hlatky MA, Jones DW, Lloyd-Jones D, Lopez-Pajares N, Ndumele CE, Orringer CE, Peralta CA, Saseen JJ, Smith SC Jr, Sperling L, Virani SS, Yeboah J. 2018 AHA/ACC/AACVPR/AAPA/ABC/ACPM/ADA/AGS/APhA/ASPC/NLA/PCNA Guideline on the Management of Blood Cholesterol: Executive Summary: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation. 2019 Jun 18;139(25):e1046-e1081.
- Cholesterol Treatment Trialists’ (CTT) Collaboration; Baigent C, Blackwell L, Emberson J, Holland LE, Reith C, Bhala N, Peto R, Barnes EH, Keech A, Simes J, Collins R. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet. 2010 Nov 13;376(9753):1670-81.
- Cholesterol Treatment Trialists’ (CTT) Collaborators; Mihaylova B, Emberson J, Blackwell L, Keech A, Simes J, Barnes EH, Voysey M, Gray A, Collins R, Baigent C. The effects of lowering LDL cholesterol with statin therapy in people at low risk of vascular disease: meta-analysis of individual data from 27 randomised trials. Lancet. 2012 Aug 11;380(9841):581-90.
- Cholesterol Treatment Trialists’ Collaboration. Efficacy and safety of statin therapy in older people: a meta-analysis of individual participant data from 28 randomised controlled trials. Lancet. 2019;393: 407–415.
- Chasman DI, Giulianini F, MacFadyen J, Barratt BJ, Nyberg F, Ridker PM. Genetic determinants of statin-induced low-density lipoprotein cholesterol reduction: the Justification for the Use of Statins in Prevention: an Intervention Trial Evaluating Rosuvastatin (JUPITER) trial. Circ Cardiovasc Genet. 2012;5: 257–264.
- Reiner Z. Resistance and intolerance to statins. Nutr Metab Cardiovasc Dis. 2014;24: 1057–1066.
- Zhou Z, Curtis AJ, Breslin M, Nelson M. Letter by Zhou et al Regarding Article, “Statin Toxicity: Mechanistic Insights and Clinical Implications.” Circulation research. 2019. p. e120.
- Muntean DM, Thompson PD, Catapano AL, Stasiolek M, Fabis J, Muntner P, Serban MC, Banach M. Statin-associated myopathy and the quest for biomarkers: can we effectively predict statin-associated muscle symptoms? Drug Discov Today. 2017 Jan;22(1):85-96.
- Bouitbir J, Charles AL, Echaniz-Laguna A, Kindo M, Daussin F, Auwerx J, Piquard F, Geny B, Zoll J. Opposite effects of statins on mitochondria of cardiac and skeletal muscles: a ‘mitohormesis’ mechanism involving reactive oxygen species and PGC-1. Eur Heart J. 2012 Jun;33(11):1397-407.
- Sirvent P, Bordenave S, Vermaelen M, Roels B, Vassort G, Mercier J, Raynaud E, Lacampagne A. Simvastatin induces impairment in skeletal muscle while heart is protected. Biochem Biophys Res Commun. 2005 Dec 23;338(3):1426-34.
- Ward NC, Watts GF, Eckel RH. Statin Toxicity. Circ Res. 2019;124: 328–350.
- Wood FA, Howard JP, Finegold JA, Nowbar AN, Thompson DM, Arnold AD, Rajkumar CA, Connolly S, Cegla J, Stride C, Sever P, Norton C, Thom SAM, Shun-Shin MJ, Francis DP. N-of-1 Trial of a Statin, Placebo, or No Treatment to Assess Side Effects. N Engl J Med. 2020 Nov 26;383(22):2182-2184.
- Osservatorio Nazionale sull’impiego dei Medicinali. L’uso dei Farmaci in Italia. Rapporto Nazionale Anno 2021. Roma: Agenzia Italiana del Farmaco, 2022. https://www.aifa.gov.it/documents/20142/1740782/Rapporto-OsMed-2021.pdf
- Osservatorio Nazionale sull’impiego dei Medicinali. L’uso dei farmaci in Italia. Rapporto Nazionale Anno 2022. Roma: Agenzia Italiana del Farmaco, 2023. https://www.aifa.gov.it/documents/20142/1967301/Rapporto-OsMed-2022.pdf
- Biolo G, Vinci P, Mangogna A, Landolfo M, Schincariol P, Fiotti N, Mearelli F, Di Girolamo FG. Mechanism of action and therapeutic use of bempedoic acid in atherosclerosis and metabolic syndrome. Front Cardiovasc Med. 2022 Oct 28;9:1028355.
- Zhang X, Xing L, Jia X, Pang X, Xiang Q, Zhao X, Ma L, Liu Z, Hu K, Wang Z, Cui Y. Comparative Lipid-Lowering/Increasing Efficacy of 7 Statins in Patients with Dyslipidemia, Cardiovascular Diseases, or Diabetes Mellitus: Systematic Review and Network Meta-Analyses of 50 Randomized Controlled Trials. Cardiovasc Ther. 2020 Apr 23;2020:3987065.
- Lee J, Lee SH, Kim H, Lee SH, Cho JH, Lee H, Yim HW, Yoon KH, Kim HS, Kim JH. Low-density lipoprotein cholesterol reduction and target achievement after switching from statin monotherapy to statin/ezetimibe combination therapy: Real-world evidence. J Clin Pharm Ther. 2021 Feb;46(1):134-142.
- Kang Y, Park JM, Lee SH Moderate-Intensity Rosuvastatin/Ezetimibe Combination versus Quadruple-Dose Rosuvastatin Monotherapy: A Meta-Analysis and Systemic Review.Yonsei Med J 2024;65(1):19-26.
- Katzmann JL, Kieble M, Enners S, Böhm M, Mahfoud F, Laufs U, Schulz M. Trends in Ezetimibe Prescriptions as Monotherapy or Fixed-Dose Combination in Germany 2012-2021. Front Cardiovasc Med. 2022 13;9:912785.
Related papers
Lo scenario della medicina attuale è caratterizzato da elementi di complessità generale inimmaginabili due decenni fa ed in grado di rendere molto più difficile la pratica clinica giornaliera. In particolare, la coesistenza di multiple condizioni passibili di un trattamento farmacologico nello stesso soggetto condiziona in maniera forzata alcune delle scelte terapeutiche spingendo alla ricerca di [more info]
Premessa Nell’ultimo decennio l’orizzonte della terapia ipolipemizzante si è arricchita di formidabili strumenti terapeutici quali ezitimibe, inibitori della proteina PCSK9 (PCSK9i) e acido bempedoico. Gli studi su queste molecole hanno permesso non solo di dimostrarne l’efficacia, ma hanno fornito importanti informazioni sull’importanza dell’abbassamento delle LDL nella riduzione del rischio cardiovascolare (CV) e costituiscono la base [more info]
Colesterolemia subottimale come fattore di rischio per le malattie cardiovascolari Il miglioramento delle abitudini alimentari e l’ottimizzazione dei livelli di colesterolo LDL nel sangue – fattore causale e cumulativo - sembrano essere strumenti efficaci per ridurre il rischio di malattie cardiovascolari su base aterosclerotica, che ancora oggi rappresentano una delle principali cause di morte e [more info]