1. Epidemiologia dello scompenso cardiaco
Lo scompenso cardiaco (SC) è una sindrome che negli ultimi decenni ha assunto un ruolo epidemiologico sempre più rilevante in termini di incidenza, prevalenza, per le sue conseguenze prognostiche nonché per il suo impatto socioeconomico (1–4).
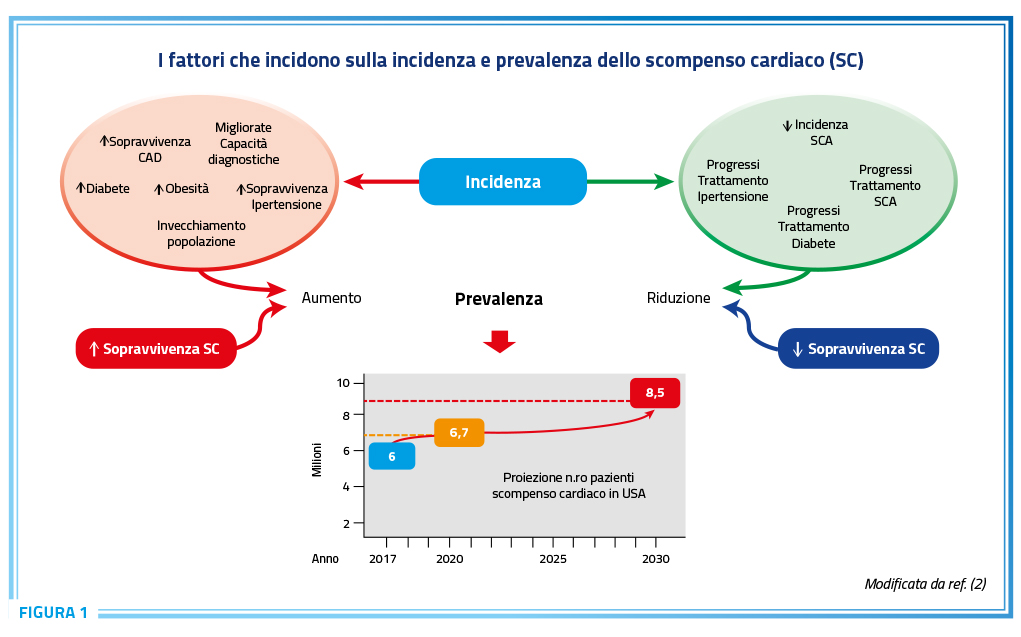
L’incidenza dello SC, stimata tra 1 e 20 casi per 1.000 abitanti (1), è condizionata da diversi fattori (4). L’invecchiamento della popolazione, l’aumentata prevalenza di condizioni fortemente predisponenti come diabete ed obesità, l’aumentata sopravvivenza dei pazienti coronaropatici ed ipertesi, l’aumentata capacità diagnostica hanno determinato un aumento dell’incidenza. Al contrario, ne hanno limitato l’aumento: le migliori strategie di prevenzione delle sindromi coronariche acute, la minore severità della disfunzione ventricolare dopo un evento ischemico acuto, il migliore trattamento dell’ipertensione arteriosa e le più efficaci strategie di prevenzione nei pazienti diabetici (1–4). Come mostrato in Figura 1, oltre alle variazioni di incidenza, la prevalenza è legata alle variazioni di sopravvivenza dei pazienti già affetti da SC (4).
Nelle ultime decadi, infatti, i nuovi approcci terapeutici hanno migliorato sensibilmente la prognosi dei pazienti, in particolare di quelli con SC a frazione di eiezione (FE) compromessa (3,5). Tale beneficio si è osservato non solo negli studi randomizzati ma anche in quelli di “mondo reale” (6). Come risultante di tutti i fattori sopraelencati, nei prossimi anni, è atteso un progressivo aumento del numero di pazienti affetti da SC (Figura 1) (2), la cui prevalenza rispetto alla popolazione generale è attualmente stimata tra 1 e 3% (1–3,7).
Nonostante tali miglioramenti, tuttavia, la prognosi dei pazienti con SC rimane severa (1–6,8). Anche quando si guarda alle curve di sopravvivenza dei pazienti trattati con le più recenti strategie farmacologiche, non si può non osservare come il rischio residuo rimanga ancora elevato. Ciò è ancor più evidente nei pazienti che si avviano verso le fasi più avanzate dello SC, quando diventano sempre più frequenti le ospedalizzazioni per riacutizzazione di scompenso (8).
Le ospedalizzazioni per SC rappresentano, pertanto, un marker prognostico rilevante che ha anche ricadute in termini di impatto socioeconomico. Si stima che le ospedalizzazioni costituiscano circa il 75% dei costi di gestione dello SC. Tali costi, nel loro complesso, assorbono circa l’1-2% del budget sanitario nazionale dei Paesi europei (9).
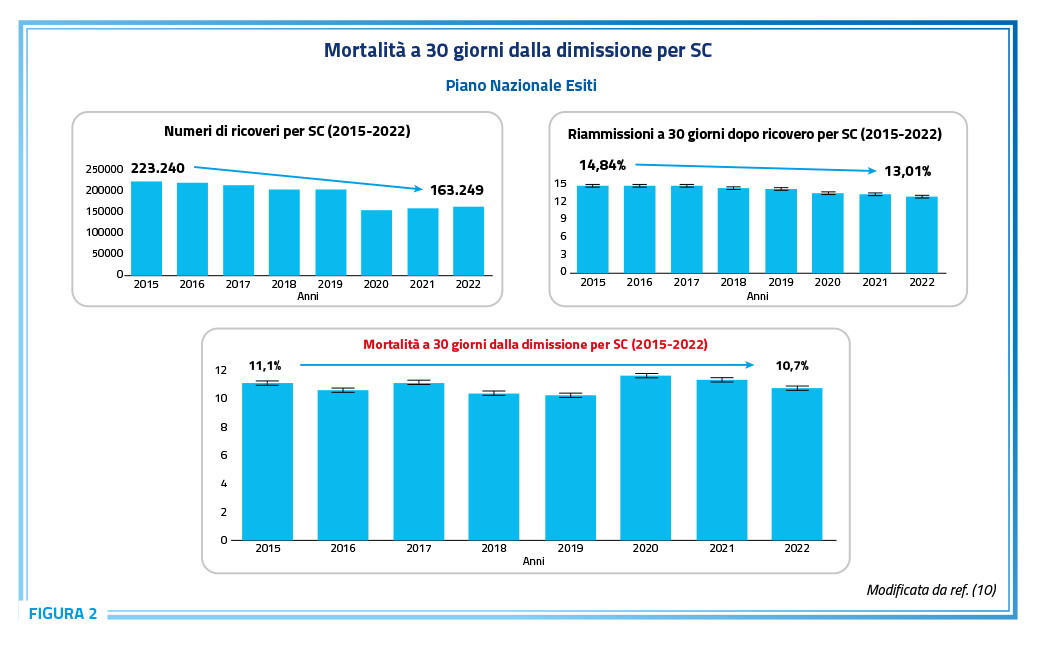
In Italia, in base all’analisi dei DRG dei ricoveri ordinari (10), le riacutizzazioni dello SC rappresentano la principale causa di ospedalizzazione, seconda solo ai ricoveri per parto. Negli ultimi anni, si è osservata una lieve flessione nel numero di ricoveri e nella probabilità di nuovo ricovero a 30 giorni, mentre la mortalità a 30 giorni è rimasta sostanzialmente invariata (Figura 2) (10).
È importante sottolineare, a tal proposito, come, complessivamente, la mortalità dei pazienti con SC rimanga superiore rispetto a molte delle patologie oncologiche più temute (11). A fronte di tali evidenze epidemiologiche, tuttavia, la percezione nell’opinione pubblica delle implicazioni di una diagnosi di SC nella aspettativa di vita di un paziente è molto sottostimata così come il suo impatto socioeconomico (12).
1.1 Fenotipi e comorbilità
Lo SC include un insieme eterogeneo di pazienti. Un’eterogeneità che è innanzitutto legata alle differenti eziologie sottostanti alla insorgenza della disfunzione cardiaca responsabile della sindrome. All’eterogeneità eziologica si affianca anche quella fisiopatologica, con necessità di utilizzare criteri utili ad individuare gruppi omogenei che possono beneficiare di un approccio terapeutico comune (13). Il principale dei criteri attualmente utilizzati è quello basato sulla frazione d’eiezione del ventricolo sinistro (VS) che distingue pazienti con FE compromessa (≤ 40%, “heart failure with reduced ejection fraction”, HFrEF), con FE lievemente compromessa (tra 41 e 49%, “heart failure with mildly reduced ejection fraction”, HFmrEF) e pazienti con FE preservata (≥ 50%, “heart failure with preserved ejection fraction”, HFpEF) (3,13). È importante sottolineare come, da un punto di vista epidemiologico, negli ultimi decenni la proporzione di pazienti con HFpEF sia aumentata e come attualmente questo gruppo rappresenti più della metà dei pazienti affetti da SC (14).
L’utilità principale di una classificazione basata sulla sola FE, che ha, come misura, molteplici limiti, è mutuata dai pazienti con HFrEF. Questi costituiscono un gruppo con un background fisiopatologico più omogeneo, in cui l’attivazione neuro-ormonale rappresenta uno dei principali meccanismi responsabili della progressione del rimodellamento ventricolare e della disfunzione sistolica del VS. In questo stesso gruppo la modulazione neuro-ormonale rappresenta anche un target terapeutico capace di migliorare la prognosi dei pazienti (3). I pazienti con HFmrEF ed ancor di più quelli con HFpEF rappresentano, invece, un gruppo di pazienti con meccanismi fisiopatologici maggiormente eterogenei, nei quali non è stata dimostrata con uguale forza delle evidenze l’efficacia di un approccio terapeutico basato sulla modulazione neuro-ormonale (3).
In tali gruppi è emersa, negli ultimi anni, la necessità di una migliore caratterizzazione basata su genere, su ipertensione e fibrillazione atriale, su aspetti metabolici come obesità e diabete nonché sulle comorbilità, di natura CV e non (15). I pazienti con HFpEF, d’altro canto, sono più anziani e presentano più frequentemente molteplici comorbilità (16). Ciò si riflette anche nelle differenze osservate nella causa di ospedalizzazione e di morte di questi pazienti, che rispetto ai pazienti con HFrEF, è proporzionalmente maggiormente legata a cause di natura non CV (17).
Le comorbilità non sono rilevanti solo per la caratterizzazione ed il trattamento dei pazienti con HFpEF. Il loro impatto sia in termini di evoluzione clinica della sindrome che in termini di approccio terapeutico è spesso indipendente dalla FE. Tra le comorbilità CV l’ipertensione arteriosa, la cardiopatia ischemica e la fibrillazione atriale sono sicuramente quelle con maggiori risvolti nella gestione terapeutica dei pazienti. La presenza, infatti, di una pressione non controllata, di ischemia inducibile e/o di una fibrillazione atriale ad elevata frequenza di risposta ventricolare possono condizionare la stabilità clinica di tutti i pazienti con SC.
Oltre alle comorbilità CV, quelle non CV sono sempre più prevalenti nei pazienti con SC. Tra le più frequenti il diabete, la malattia renale cronica, la carenza marziale, l’anemia e la broncopneumopatia cronica ostruttiva (BPCO). Anche tali comorbilità assumono un peso che è indipendente dalla FE. Le riacutizzazioni di SC possono, ad esempio, essere la conseguenza di una riacutizzazione di BPCO e di malattia renale cronica (18). La presenza di BPCO può condizionare l’uso della terapia betabloccante, mentre la malattia renale cronica quello degli inibitori del sistema renina-angiotensina-aldosterone (SRAA).
In conclusione, nella gestione dello SC non è possibile prescindere da un’adeguata caratterizzazione del paziente basata sulla valutazione ed il trattamento delle comorbilità.
2. Ipertensione e scompenso cardiaco: relazioni pericolose
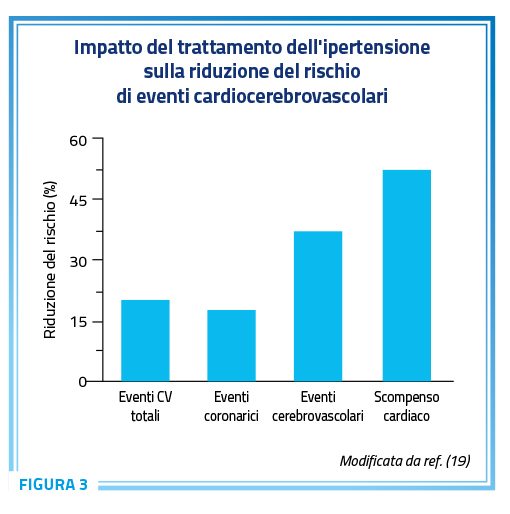
L’ipertensione arteriosa si associa ad un notevole grado di morbilità e mortalità. Tra le numerose patologie CV che spesso si associano all’ipertensione lo SC è sicuramente quella che determina la peggior “relazione pericolosa” (Figura 3) (19).
L’aumento della pressione arteriosa (PA) è uno dei principali fattori di rischio di aterosclerosi coronarica e la prevalenza dell’ipertensione arteriosa in questi pazienti è superiore al 60% (20). La cardiopatia ipertensiva è la risposta del miocardio al postcarico determinato dall’aumento della PA che porta all’ipertrofia ventricolare sinistra (IVsx) (21). Inoltre, la prevalenza della sclerosi della valvola aortica è maggiore nei pazienti ipertesi rispetto ai soggetti con pressione arteriosa normale, in particolare nelle persone anziane (22).
La cardiopatia ischemica, l’IVsx e la malattia della valvola aortica possono coesistere nel paziente iperteso, favorendo la comparsa di SC.
2.1 Aspetti epidemiologici e fisiopatologici
I dati epidemiologici dello studio Framingham forniscono informazioni sui fattori di rischio modificabili che favoriscono la comparsa di SC (23–25). A questo proposito, sulla base dei rischi attribuibili sulla popolazione generale, l’ipertensione ha l’impatto maggiore, contribuendo al 39% dell’incidenza di SC negli uomini e al 59% nelle donne. L’ipertensione aumenta il rischio di SC (aggiustato per età) di 2 volte negli uomini e di 3 volte nelle donne, con un impatto maggiore della pressione sistolica rispetto a quella diastolica.
L’incidenza di SC è elevata anche nei pazienti ipertesi in trattamento. Una revisione sistematica di 23 studi sull’ipertensione condotti tra il 1997 e il 2007 che includeva 193.424 pazienti, ha rivelato un’incidenza del 28,9% di nuovi casi di SC (26). Lo sviluppo di SC era più probabile negli anziani, nei pazienti di colore, nei diabetici e negli individui a rischio cardiovascolare (CV) molto alto.
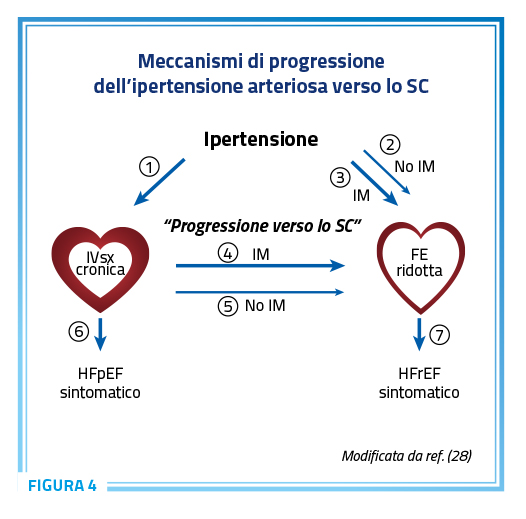
L’esame delle caratteristiche dei pazienti con HFrEF e dei pazienti con HFpEF (N = 19.519) inclusi negli studi del Digitalis Investigation Group, negli studi CHARM (Candesartan in Heart Failure: Assessment of Reduction in Mortality and Morbidity) e nello studio I-PRESERVE (Irbesartan in Heart Failure with Preserved Systolic Function Trial) mostra che l’ipertensione è il principale determinante dell’HFpEF, molto più che dell’HFrEF (27). Dal punto di vista fisiopatologico, in risposta all’aumento della PA, si sviluppa inizialmente una ipertrofia ventricolare sinistra (IVsx) concentrica, successivamente tale meccanismo compensatorio si perde ed attraverso diverse vie il quadro può evolvere verso lo SC (Figura 4) (28).
In primo luogo, è ben noto che i pazienti con IVsx concentrica possono sviluppare HFpEF e che solo successivamente, in una minoranza di casi, il quadro può progredire verso l’HFrEF. In secondo luogo, alcuni pazienti ipertesi possono sviluppare un pattern geometrico di crescita del VS che è diverso dall’ipertrofia concentrica (e.g. rimodellamento concentrico o eccentrico), che può evolvere in HFpEF o in HFrEF.
Queste diverse possibilità di progressione dall’ipertensione arteriosa allo SC sono il risultato dell’influenza di fattori modulatori (e.g. genetica, sesso, invecchiamento, fattori legati allo stile di vita, obesità e diabete mellito) nonché dei cambiamenti strutturali del miocardio che si verificano in risposta a meccanismi emodinamici e non emodinamici (29–33).
2.2 Aspetti diagnostici e terapeutici
L’imaging o i biomarcatori biochimici possono fornire importanti informazioni sulla patogenesi dello SC associato all’ipertensione, ma possono anche essere utili nell’identificazione e nello screening dei pazienti a rischio di sviluppare SC e nel monitoraggio della terapia.
L’imaging svolge un ruolo centrale nella diagnosi e nella guida del trattamento nei pazienti ipertesi con SC (34). L’ecocardiografia è ampiamente disponibile e clinicamente utile per la rilevazione dell’IVsx e per la valutazione della funzione diastolica e sistolica. Inoltre, diversi studi hanno dimostrato le alterazioni degli indici eco-Doppler nei pazienti con HFrEF (35,36) e nei pazienti con HFpEF (37).
Sebbene l’ecocardiografia sia riconosciuta come centrale per la gestione del paziente iperteso con SC, altre metodologie di imaging possono offrire in casi selezionati alcuni vantaggi per la caratterizzazione diagnostica della cardiopatia ipertensiva nei pazienti con SC. Ad esempio, la risonanza magnetica cardiaca (RNM) ha dimostrato di essere più riproducibile dell’ecocardiografia per la stima della massa VS e la caratterizzazione tissutale del miocardio (38).
L’ipertensione arteriosa come causa di SC è quindi tra i principali problemi sanitari in ambito CV ed è pertanto necessario ottimizzare le strategie per trattarla e prevenire la sua evoluzione in SC.
Numerosi studi hanno dimostrato che tutti i principali agenti antipertensivi riducono l’incidenza di SC, confermando così che la riduzione della PA è una strategia fondamentale per prevenire lo SC nei pazienti con ipertensione arteriosa (39). Ad esempio, una metanalisi di 12 studi condotti sull’ipertensione arteriosa che includevano lo sviluppo di SC ha mostrato significativi benefici terapeutici indotti dalla terapia antipertensiva (40) con una riduzione di nuovi casi di SC del 52% rispetto al placebo.
Nei pazienti con HFrEF, numerosi studi indicano che gli inibitori del SRAA ed i beta-bloccanti riducono la mortalità e i tassi di ospedalizzazione, quindi questi agenti sono la terapia di prima linea in questi pazienti e dovrebbero essere usati come base del trattamento antipertensivo e della disfunzione VS (41–44).
Il trattamento intensivo dell’ipertensione arteriosa è altrettanto importante nei pazienti con HFpEF. Gli inibitori del SRAA sembrano particolarmente efficaci in questi pazienti. Allo stesso modo i beta-bloccanti sono stati reintrodotti come farmaci con la più elevata classe di raccomandazione (I e livello di evidenza A) (45).
Le più recenti linee guida sul trattamento dell’ipertensione arteriosa definiscono quale possa essere una corretta strategia terapeutica nel trattare a target i pazienti ipertesi o ad evitare lo sviluppo di HFpEF (Figura 5) (46).
Risulta evidente come i beta-bloccanti possano essere inseriti come terapia di associazione in ogni step dell’approccio terapeutico. I beta-bloccanti sono una classe di farmaci utilizzata da più di 30 anni nella terapia antipertensiva. Esistono 3 generazioni di farmaci beta-bloccanti, col tempo introdotte nella pratica clinica. In particolare, la terza generazione di beta-bloccanti è composta da molecole sia selettive sia non selettive per b1 che però possiedono proprietà addizionali (come la capacità vasodilatatoria di stimolare la produzione di NO) che devono essere prese in considerazione per ottimizzare una terapia di tipo personalizzato. Il nebivololo appartiene alla terza generazione di beta-bloccanti e, infatti, possiede non solo un’elevata selettività per b1, ma anche proprietà vasodilatatorie ed una lunga durata d’azione. In particolare, il nebivololo è la molecola, rispetto ai beta-bloccanti di generazioni precedenti, con più alta selettività per b1; inoltre, non sembra possedere né attività simpaticomimetica intrinseca né antagonismo a-adrenergico (47). La vasodilatazione arteriosa endotelio-dipendente, che si manifesta anche a livello coronarico, deriva dalle proprietà agoniste sui recettori b3 che determinano l’incremento di disponibilità di ossido nitrico (NO) con 2 meccanismi, la riduzione del superossido e quindi della inattivazione del NO e lo stimolo della NO sintetasi (48).
Alla luce delle sue caratteristiche il nebivololo ha indicazioni terapeutiche approvate per il trattamento della ipertensione essenziale oltre che dello SC cronico dell’anziano (≥ 70 anni) di grado lieve o moderato con diversa eziologia in aggiunta alle terapie standard.
Una metanalisi di 12 studi randomizzati su pazienti ipertesi ha dimostrato che la terapia con nebivololo 5 mg/die in monosomministrazione si associava ad una maggiore probabilità di raggiungere l’obiettivo della normalizzazione della pressione ed a minori effetti collaterali rispetto a dosaggi terapeutici di altri farmaci antipertensivi (ACE inibitori, sartani, calcio-antagonisti) (49).
Il nebivololo sembra essere un beta-bloccante particolarmente adatto ai pazienti ipertesi e diabetici. Lo studio YESTONO aveva l’obiettivo di verificare gli effetti ipotensivi e metabolici del nebivololo in pazienti ipertesi con diabete di tipo 2 (con o senza altre comorbidità) (50). Ai pazienti arruolati è stato prescritto il trattamento con nebivololo, in monoterapia o in aggiunta ad altri farmaci antipertensivi. Dopo tre mesi dall’introduzione in terapia del nebivololo, la pressione sistolica e diastolica sono diminuite rispettivamente di 21,1 e 10,9 mmHg e il 62% dei pazienti è risultato raggiungere l’obiettivo raccomandato di pressione < 130/80 mmHg, dimostrando l’efficacia dell’effetto antipertensivo della molecola. I parametri più rilevanti valutati in questo studio erano però i parametri metabolici come glicemia a digiuno, emoglobina glicata, peso, colesterolo totale e trigliceridi. A 3 mesi dall’inizio dell’assunzione di nebivololo, tutti i parametri elencati sono risultati essere significativamente migliorati rispetto ai livelli registrati all’inizio dello studio, supportando l’ipotesi che il nebivololo, a differenza dei beta-bloccanti della prima e seconda generazione, non ha effetti dismetabolici nel paziente iperteso.
In conclusione, esiste una relazione pericolosa tra ipertensione arteriosa e SC? Si! È una relazione stretta, maligna ma che si può prevenire e curare. Sta a noi essere efficaci e non inerti, sviluppando un’alleanza terapeutica efficace tra medico e paziente.
3. HFpEF: diagnosi e caratteristiche dei pazienti
Lo SC con HFpEF è caratterizzato da segni e sintomi di SC con una FE VS ≥ 50%. Pertanto, lo SC può essere definito emodinamicamente in un paziente con FE VS preservata come una ridotta capacità del cuore di pompare sangue nell’organismo in una quantità commisurata alle esigenze dell’organismo stesso (Tabella 1) (51).
L’HFpEF è maggiormente presente nei pazienti anziani ed è associata a comorbilità come ipertensione arteriosa, insufficienza renale, diabete, obesità e sindrome metabolica (52,53). I meccanismi fisiopatologici che determinano tale patologia non sono ancora completamente compresi, ma sono correlati a sovraccarico pressorio, infiammazione sistemica, disfunzione coronarica, ischemia tissutale, fibrosi, disfunzione metabolica e disfunzione endoteliale. Esistono una serie di patologie o disturbi CV che hanno lo stesso profilo emodinamico presente nell’HFpEF ma che non dovrebbero essere considerate un vero HFpEF. Riunire tutte queste eziologie specifiche sotto la definizione dell’HFpEF, analogamente a quanto avviene per l’HFrEF, può determinare un aumento dell’eterogeneità, rischiando di privare alcuni pazienti di potenziali terapie specifiche (54,55) (Tabella 2).
L’HFpEF è una condizione che prevede un percorso diagnostico complesso mirato a fornire una diagnosi accurata per prescrivere farmaci adeguati e identificare cause specifiche, cercando di fenotipizzare nel modo più preciso possibile i pazienti. La diagnosi può risultare complessa, tant’è che l’HFpEF è sottodiagnosticata. La diagnosi di HFpEF richiede una valutazione multiparametrica che include una valutazione ecocardiografica di base, un dosaggio dei livelli di biomarcatori cardiaci, l’utilizzo di scores, ed in casi selezionati l’ecocardiografia da stress e/o una valutazione invasiva. Sebbene l’American Society of Echocardiography e l’European Association of Cardiovascular Imaging abbiano proposto un approccio basato sui dati ecocardiografici, in casi selezionati sintomi e disfunzione diastolica non presenti a riposo possono emergere da sforzo, rendendo necessari test da sforzo, sia invasivi che non.
L’uso dei peptidi natriuretici è utile e necessario per la diagnosi di HFpEF. I peptidi natriuretici sono validi predittori di esiti sfavorevoli nei pazienti con SC indipendentemente dai valori della FE VS. Il BNP e l’NTproBNP si sono dimostrati, rispettivamente, più sensibile e più specifico per la diagnosi HFpEF. Le raccomandazioni dell’ESC per la diagnosi di HFpEF hanno indicato che un NT-proBNP > 220 pg/mL o BNP > 80 pg/mL sono i criteri principali per la diagnosi di HFpEF nei pazienti in ritmo sinusale, mentre un NT-proBNP > 660 pg/ml o BNP > 240 pg/ml dovrebbero essere utilizzati come cut-off nei pazienti con fibrillazione atriale (56–58).
È inoltre da considerare la diversa sensibilità e specificità di valori intermedi di NTproBNP in rapporto all’età dei pazienti. Nei pazienti ultrasettantaciquenni (la maggioranza dei pazienti con HFpEF) i valori di NTproBNP della zona grigia variano tra 300 e 1800 pg/ml, mentre lo scompenso viene ritenuto probabile per valori >1800 pg/ml (59).
L’elettrocardiogramma (ECG) è un elemento chiave nella valutazione di pazienti con sospetto HFpEF. L’ECG può evidenziare segni di ischemia, ipertrofia ventricolare sinistra, fibrillazione atriale o altri disturbi del ritmo cardiaco che possono contribuire ai sintomi.
L’ecocardiografia è la modalità di imaging più utilizzata nella diagnosi e nel monitoraggio dell’HFpEF e comprende la misurazione della FE VS, della massa miocardica e dei volumi atriali, la valutazione delle pressioni di riempimento e la misurazione della pressione arteriosa polmonare (PAP). La misurazione della funzione di riempimento è essenziale. Inoltre, l’ecocardiografia consente la valutazione delle comorbidità e delle cause sottostanti di HFpEF.
A questo punto, l’uso di algoritmi validati è utile per confermare, escludere o suggerire la diagnosi di HFpEF. In letteratura sono stati pubblicati diversi algoritmi e scores che incorporano variabili indipendenti di HFpEF (e.g. H2FPEF e HFA-PEFF). Questi metodi consentono un approccio bayesiano alla diagnosi di HFpEF, in base al quale vengono diagnosticati i pazienti con una probabilità bassa o alta di malattia e ciò permette di riservare il cateterismo cardiaco ai pazienti con una probabilità pre-test di grado intermedio (Figura 6) (51,60).
Un ruolo importante ha anche il test cardiopolmonare (CPET) per la possibilità di valutare una moltitudine di variabili derivate, fornendo informazioni approfondite delle cause cardiache o non cardiache della limitazione dell’esercizio. Il CPET è particolarmente utile per differenziare l’HFpEF dalla dispnea non cardiaca.
La risonanza magnetica cardiaca (RMC) contribuisce a caratterizzare le alterazioni anatomiche e funzionali dei pazienti con HFpEF. La RMC fornisce informazioni sulla morfologia cardiaca, la massa del VS, la compliance del VS e la presenza di fibrosi miocardica. Anche la scintigrafia miocardica può essere un esame utile per escludere la cardiopatia ischemica come causa dei sintomi.
Infine, in casi selezionati per la diagnosi di HFpEF può essere utile la misurazione della PAP e la determinazione della pressione venosa polmonare (PVP) media con cateterismo cardiaco. La PVP media ed una pressione capillare polmonare (WP) ≥ 15 mmHg possono aiutare a stabilire la presenza di congestione polmonare, confermando così la diagnosi di HFpEF. Talvolta, se i valori di WP aumentano e rientrano in determinati intervalli con il sollevamento passivo delle gambe, si suggerisce di eseguire un cateterismo cardiaco da sforzo su cicloergometro che ha dimostrato un’elevata accuratezza in caso di stress-WP ≥ 25 mmHg.
4. HFpEF: trattamento attuale e nuove linee guida
Fino all’arrivo degli SGLT2i, il trattamento dell’HFpEF è stato probabilmente l’argomento di ricerca CV che ha raccolto più insuccessi scientifici, probabilmente per l’errore di fondo di volere trattare con modalità “one size fits all” una malattia estremamente eterogenea per eziologia e meccanismi fisiopatologici (61).
Solo recentemente, l’HFpEF ha trovato una prima possibilità di cura “specifica” con i 2 trial Emperor Preserved (Anker) e Deliver (Solomon), alla base della classe di raccomandazione IA per empagliflozin e dapagliflozin nell’HFmrEF e nell’HFpEF. In particolare, nei pazienti con HFmrEF o HFpEF arruolati nello studio Deliver, 4 su 5 partecipanti (corrispondente all’83% della popolazione di studio) sono stati trattati con un beta-bloccante. L’uso di beta-bloccanti non è stato associato a un rischio più elevato di peggioramento dello scompenso cardiaco o morte cardiovascolare. Inoltre, il farmaco dapagliflozin ha ridotto in modo consistente e sicuro gli eventi clinici, indipendentemente dall’uso di beta-bloccanti (62).
Per quanto riguarda i farmaci antagonisti/modulatori neurormonali la classe di raccomandazione nell’HFmrEF è IIB, mentre nell’HFpEF l’indicazione di classe IA per questi farmaci rientra nel più generico ma non meno importante “trattamento eziologico e delle comorbidità CV e non CV”, ed in particolare nei pazienti con ipertensione arteriosa, fibrillazione atriale e cardiopatia ischemica.
Nell’Emperor Preserved la prescrizione di farmaci antineurormonali è stata la più elevata (inibitori del SRA 81%, beta-bloccanti 86%, antialdosteronici 37%) (63), pur non al livello di prescrizione dell’HFrEF, ma superiore a quella dello studio Deliver (64).
Nell’Osservatorio CV del Friuli-Venezia Giulia, su pazienti più anziani e multimorbidi, gli antagonisti neurormonali sono stati prescritti nell’HFpEF in una percentuale ridotta rispetto a HFrEF e HFmrEF (inibitori del SRA 67%, beta-bloccanti 74%, antialdosteronici 31%) (7).
Una delle novità delle ultime linee guida è stata il riposizionamento dei beta-bloccanti nel trattamento di prima linea dell’ipertensione con classe di raccomandazione IA, alla pari di ACE inibitori, sartani, calcio antagonisti e diuretici tiazidici (46). Se i beta-bloccanti di prima e seconda generazione (propranololo, atenololo and metoprololo) sono in grado di ridurre il rischio di stroke, SC ed eventi CV maggiori in modo paragonabile agli altri farmaci antipertensivi (con l’eccezione di un minore effetto preventivo sull’ictus), è anche vero che dimostrano una maggiore frequenza di effetti collaterali ed una minore persistenza in trattamento. Al contrario, il nebivololo, beta-bloccante con elevata selettività b1 e vasodilatazione mediata da un aumentato rilascio di ossido nitrico, ha dimostrato un profilo di tollerabilità più favorevole, incluso sulla sfera sessuale (65). In uno studio di popolazione, non sono state registrate differenze significative sugli outcomes CV tra i 118.133 pazienti trattati con nebivololo o carvedilolo e 267.891 pazienti trattati con atenololo (66), mentre in un altro studio, l’utilizzo del nebivololo si è associato ad una maggiore protezione CV, in confronto ad atenololo o metoprololo (67). Non ci sono tuttavia trial di outcome in pazienti ipertesi trattati con beta-bloccanti con attività di vasodilatazione.
Nella cardiopatia ischemica (68) i beta-bloccanti hanno una azione antischemica e permettono di ridurre la FC a riposo a 55-60 bpm. In pazienti con pregresso infarto miocardico e HFrEF, l’uso dei beta-bloccanti è convincentemente associato ad una riduzione della mortalità e/o degli eventi CV. Tuttavia, nell’epoca attuale, caratterizzata da una elevata proporzione di pazienti con infarto miocardico rivascolarizzati precocemente con bassa probabilità di HFrEF, c’è una carenza di trial randomizzati e controllati e l’effetto protettivo dei beta-bloccanti è meno chiaro (69,70).
Infine, i beta-bloccanti sono raccomandati dalle linee guida europee sulla fibrillazione atriale (71) come terapia di prima linea, nel controllo della FC e, con minori evidenze, per il controllo del ritmo, in associazione ai farmaci antiaritmici, in particolare nei pazienti in cui la fibrillazione atriale si associa a ipertensione e/o SC, indipendentemente dalla FE.
Un ultimo aspetto riguarda il valore prognostico della FC e la possibilità che il paziente con HFpEF, spesso anziano e multimorbido, trattato con beta-bloccanti, possa subire un effetto negativo sulla sua sintomatologia per la loro azione sulla competenza cronotropa. Una FC elevata (> 80 bpm), comune nell’ipertensione per l’attivazione simpatica ed associata ad una mortalità più elevata (72), è probabilmente alla base del reinserimento della terapia betabloccante tra i farmaci di prima linea nell’ipertensione (73).
Una associazione tra mortalità e frequenza cardiaca è stata osservata anche nella cardiopatia ischemica. Oba et al. hanno dimostrato che in pazienti giapponesi con malattia coronarica una FC ≥ 75 bpm era indipendentemente associata ad una maggiore frequenza di eventi CV e cerebrovascolari maggiori (74).
Discorso parzialmente diverso va fatto per la fibrillazione atriale. Come detto, da un lato i beta-bloccanti sono fortemente raccomandati per migliorare la qualità della vita e ridurre il rischio di cardiomiopatia indotta da tachicardia. Dall’altro le linee guida sottolineano che il valore prognostico della FC e del suo controllo nella fibrillazione atriale non è così critico come nel ritmo sinusale. Di conseguenza l’uso dei beta-bloccanti è raccomandato ma con un target prudenziale di FC < 110 bpm.
5. Ruolo dei beta-bloccanti
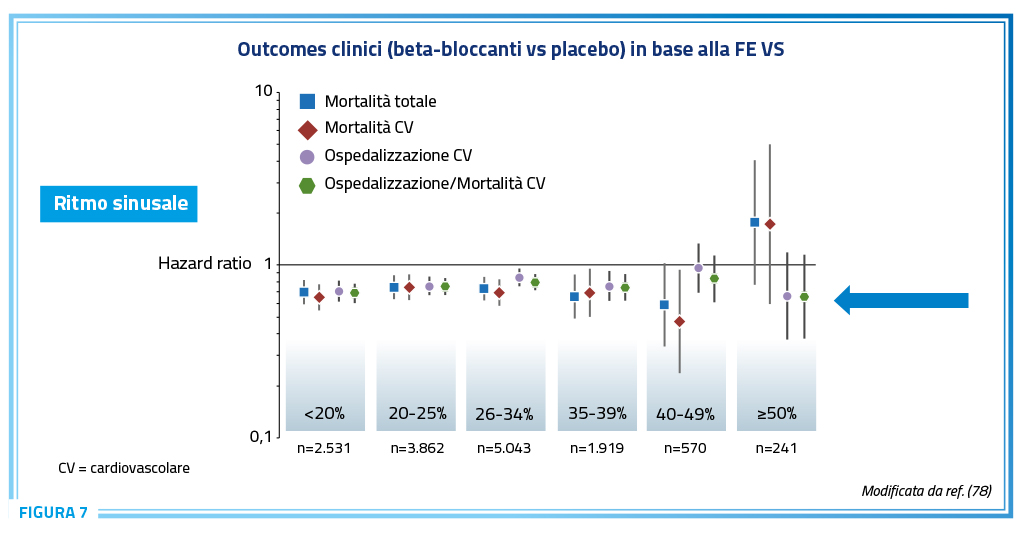
I beta-bloccanti rappresentano un pilastro irrinunciabile nel trattamento dello HFrEF. Numerosi studi randomizzati controllati hanno infatti dimostrato l’efficacia dei beta-bloccanti, in associazione alle altre classi farmacologiche indicate, nel ridurre mortalità e morbilità nel paziente con HFrEF. In particolare, la riduzione del rischio assoluto di mortalità è stata rispettivamente del 5,5% con il bisoprololo, del 4,6% con il carvedilolo, del 4,5% con il metoprololo, e del 2,2% con il nebivololo (43,75–77). La minore riduzione della mortalità riscontrata nei pazienti trattati con nebivololo sembrerebbe associata all’età più avanzata dei pazienti inclusi nello studio specifico con un possibile impatto delle comorbilità presenti sugli obiettivi dello studio, ed all’arruolamento di circa 1/3 dei pazienti con FE VS > 35% (77). L’utilizzo dei beta-bloccanti è anche associato ad una significativa riduzione della morte improvvisa nel paziente con HFrEF. In generale, gli effetti dei beta-bloccanti nei pazienti con SC sembrerebbero essere maggiori nei pazienti in ritmo sinusale rispetto a quelli con fibrillazione atriale (78).
L’efficacia sulla mortalità per ogni causa è stata inoltre confermata anche per i pazienti con HFmrEF (41-49%) ma non per quelli con HFpEF (78). Bisogna però sottolineare che in quest’ultimo caso una percentuale rilevante di pazienti dovrebbe essere comunque trattata con beta-bloccanti per la presenza di comorbidità quali ad esempio pregressi eventi ischemici miocardici, fibrillazione atriale ad elevata FC e ipertensione arteriosa. Anche in questi pazienti, infatti, una riduzione della FC legata alla terapia beta-bloccante è stata associata ad un minor rischio di ospedalizzazione per cause CV e dell’end point combinato di ospedalizzazioni/mortalità CV (Figura 7) (78). Ad esempio, nello studio di Nodari et al. in 30 pazienti con ipertensione arteriosa e HFpEF trattati con nebivololo o atenololo, solo il primo ha migliorato significativamente la tolleranza allo sforzo, la funzione diastolica ed i parametri emodinamici (aumento della gittata sistolica, mantenimento dell’indice cardiaco, riduzione della pressione capillare polmonare e delle resistenze periferiche) (79).
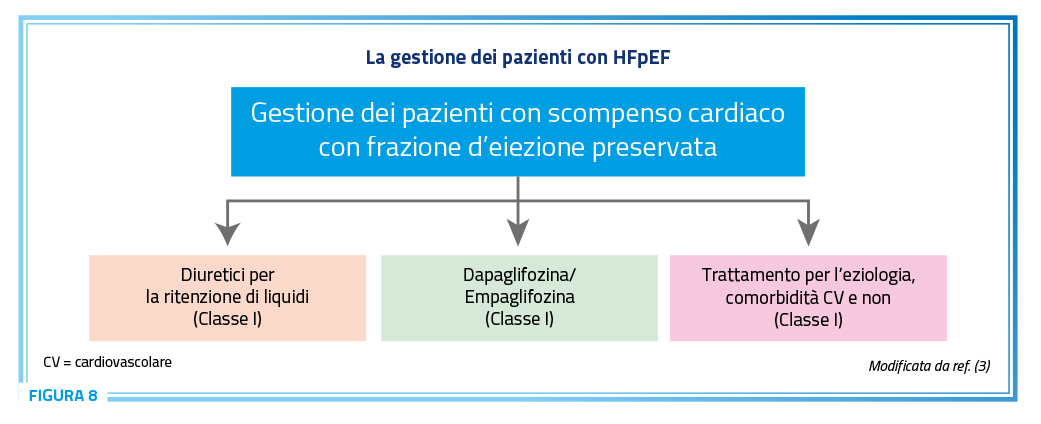
Nelle ultime linee guida europee sullo SC i beta-bloccanti sono raccomandati in Classe IIB nei pazienti con HFmrEF. Nei pazienti con HFpEF trovano invece indicazione per il trattamento delle comorbidità CV e non (Classe I) (Figura 8) (3).
Tuttavia, uno studio pubblicato nel 2024 ha dimostrato che l’utilizzo di beta-bloccanti è associato ad un rischio inferiore per il composito primario di eventi cardiaci avversi, come il peggioramento dello scompenso cardiaco o la morte cardiovascolare, in pazienti con HFmrEF o HFpEF (62). Questa associazione è rimasta significativa anche dopo l’aggiustamento per variabili demografiche e prognostiche iniziali e in analisi di sensibilità. Inoltre, l’effetto benefico dei beta-bloccanti non è stato influenzato dalla FE VS.
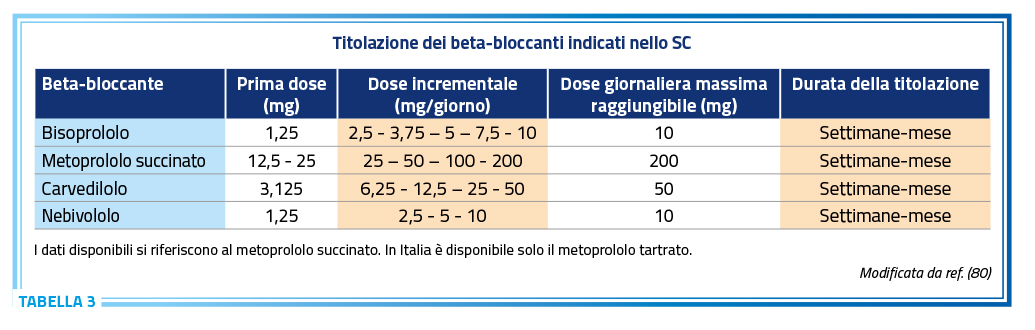
La terapia con beta-bloccanti dovrebbe essere iniziata nei pazienti emodinamicamente stabili, ad un basso dosaggio e gradualmente aumentata fino al raggiungimento del massimo dosaggio tollerato, idealmente corrispondente al dosaggio target definito dagli studi randomizzati e controllati (Tabella 3) (3,80).
Va sottolineato, tuttavia, che anche l’utilizzo di basse dosi iniziali del farmaco ha comunque dimostrato un effetto benefico sul tasso di mortalità e di ospedalizzazione a 30 giorni dalla randomizzazione (81). La titolazione del dosaggio della terapia con beta-bloccanti (bisoprololo, carvedilolo, nebivololo, metoprololo) che hanno indicazione nello SC, si effettua tenendo conto di FC target, pressione arteriosa e tollerabilità. Il raggiungimento di una FC < 70 bpm (e > 50 bpm) può essere considerato l’obiettivo target della terapia con beta-bloccanti nel paziente in ritmo sinusale. La FC rappresenta il principale fattore da monitorare durante la terapia con beta-bloccanti insieme ai valori di pressione arteriosa e alla tollerabilità clinica del farmaco (ad esempio, la comparsa di sintomi o di altri effetti collaterali). È stato peraltro dimostrato come la riduzione della FC, e non il dosaggio totale di beta-bloccante somministrato, sia correlata in maniera direttamente proporzionale alla riduzione della mortalità (82).
Va ricordato in particolare che i beta-bloccanti non sono tutti ugualmente tollerati nei pazienti anziani, che rappresentano la più ampia quota di pazienti con HFpEF, per cui è necessario personalizzare l’intervento terapeutico in termini di tollerabilità e titolazione del farmaco. L’età del paziente deve essere tenuta in considerazione in quanto si è dimostrata essere un fattore significativamente associato al mancato raggiungimento del target terapeutico. In questo contesto, le maggiori evidenze sono a favore del nebivololo sia in HFrEF che in HFmrEF (83). Dal punto di vista clinico, in categorie particolari di pazienti (ad esempio anziani, con BPCO) la maneggevolezza del dosaggio, la possibilità di mono-somministrazione e la selettività per i recettori b1 (metoprololo, bisoprololo, nebivololo) vanno tenute in considerazione.
In conclusione, i beta-bloccanti giocano un ruolo fondamentale nella gestione terapeutica del paziente con SC indipendentemente dalla FE VS in quanto associati ad un considerevole miglioramento clinico e ad una sostanziale riduzione della mortalità e morbilità. La titolazione graduale del beta-bloccante è un procedimento fondamentale per assicurare l’aderenza alla terapia e ridurre la possibile insorgenza di effetti collaterali, soprattutto nei pazienti anziani e con particolari comorbidità.
6. I Beta-bloccanti non sono tutti uguali: il ruolo del nebivololo
La grande famiglia dei beta-bloccanti è composta da molte molecole con caratteristiche fra loro diverse. Questo comporta nella ricerca del miglior risultato clinico di scegliere la molecola più adatta per quel determinato paziente e quindi di conoscere a fondo sia la farmacologia dei vari beta-bloccanti disponibili che la fisiopatologia del nostro paziente. Purtroppo, studi di comparazione fra i vari beta-bloccanti nelle diverse patologie in cui i beta-bloccanti sono raccomandati sono pochissimi e quindi il processo di accoppiamento farmaco-paziente è per lo più induttivo e lasciato alla buona volontà del medico e viene raramente applicato in clinica.
Il nebivololo è indicato nel trattamento della ipertensione arteriosa e dello SC cronico stabile di grado lieve e moderato in aggiunta alle terapie standard in pazienti anziani di età ≥ 70 anni. Insieme a carvedilolo, metoprololo e bisoprololo è il quarto beta-bloccante per il quale è stata provata l’efficacia clinica. Per quanto concerne il nebivololo, lo studio SENIORS ha dimostrato in una popolazione di pazienti anziani con SC cronico di ridurre l’endpoint primario combinato di mortalità per tutte le cause e i ricoveri per cause cardiovascolari rispetto al placebo con una diminuzione del rischio relativo del 14% (77,84).
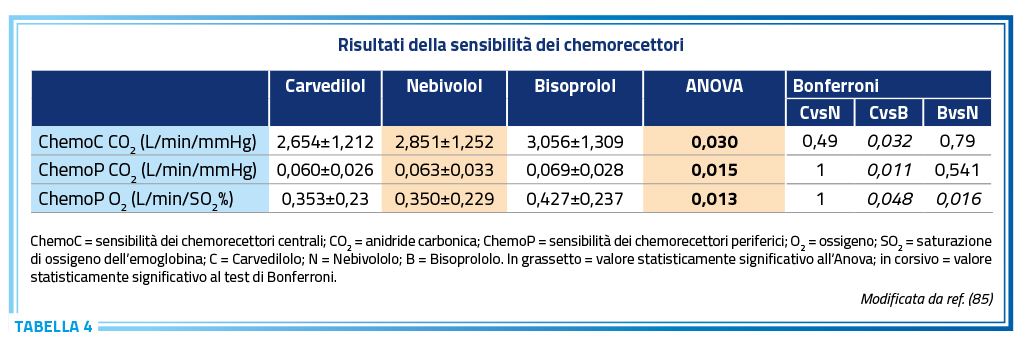
Il nebivololo è un beta-bloccante dotato di rilevante b1 selettività ed ha la caratteristica unica fra i beta-boccanti di liberare nitrossido. La rilevante b1 selettività, la più alta tra i beta-bloccanti di generazioni precedenti che si possono prescrivere nello SC comporta l’assenza del blocco dei b2 recettori presenti sulle cellule alveolari, sia di tipo 1 che di tipo 2, dove i b2 recettori stimolano varie pompe ioniche o canali ionici la cui azione è di ridurre la quantità di fluidi presenti sugli alveoli. Questo permette una più rapida risoluzione dell’edema polmonare ed un miglior mantenimento della omeostasi dei fluidi intratoracici, entrambe condizioni molto importanti nello SC. Questa informazione è misurabile in termini di diffusione alveolo-capillare del monossido di carbonio (DLCO) che è minore quando si utilizza un beta-bloccante che agisce su entrambi i b1 e b2 recettori rispetto ad un beta-bloccante b1-selettivo. Un altro aspetto è che l’assenza di azione sui b2 recettori comporta un minor o assente effetto sulla regolazione riflessa della ventilazione che è una delle cause principali della iperventilazione nello SC. Quest’ultima è associata ad aumento della mortalità ed alla gravità dello scompenso stesso. Lo studio CARNEBI ha dimostrato la diversa attivazione dei chemorettori periferici per ossigeno e centrali per anidride carbolica in pazienti con SC trattati con bisoprololo, carvedilolo e nebivololo (Tabella 4) (85). Fra i 3, il nebivololo ha una situazione intermedia.
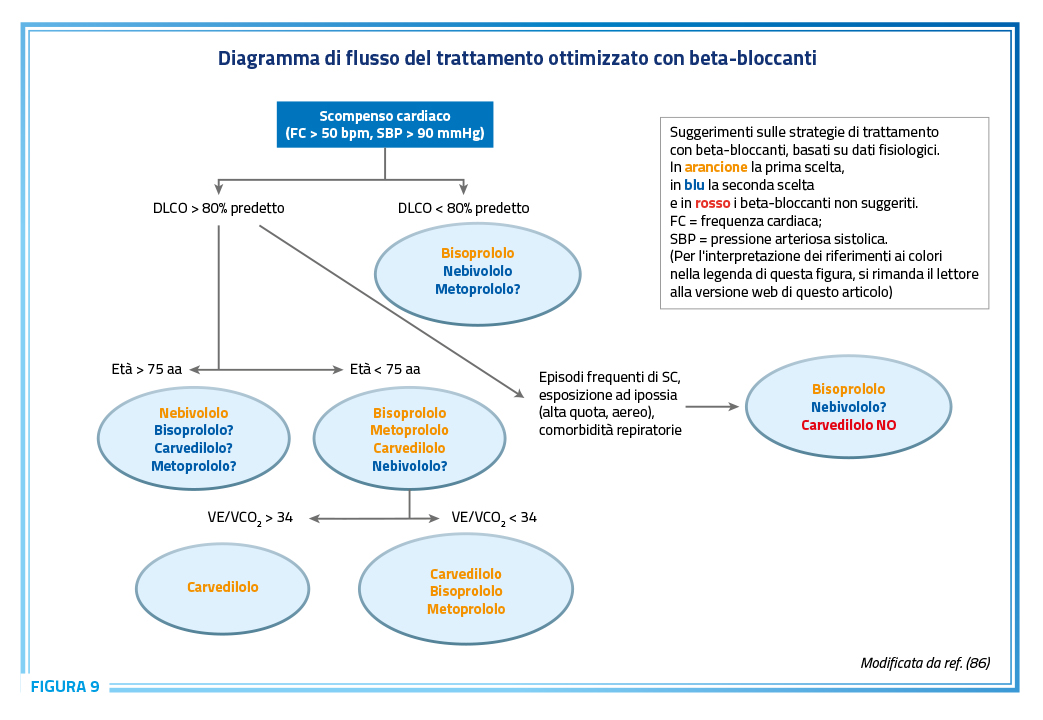
Da un punto di vista pratico, considerando sia gli effetti sulla diffusione alveolo-capillare che quelli sui chemorecettori, è stato proposto uno schema per la scelta del beta-bloccante più adatto nel paziente con SC dove il nebivololo risulta tra i preferibili in caso di paziente anziano con DLCO normale o in tutti i casi di paziente con DLCO ridotta (Figura 9) (86).
La liberazione di nitrossido è, tra i farmaci beta-bloccanti, presente solo nel nebivololo. Questa è una caratteristica unica che si associa ad una preservata funzione endoteliale. Una ipotesi di lavoro potrebbe essere l’utilizzo del nebivololo in soggetti di genere femminile in menopausa che necessitano di terapia betabloccante, in considerazione della fisiologica riduzione del nitrossido tissutale, del progressivo degradamento della funzione endoteliale e dell’incremento dello stress ossidativo e dell’overdrive adrenergico (87,88). Questo approccio è molto attuale in considerazione del ruolo che lo stress ossidativo ha nella pressoché totalità delle patologie CV acquisite. Un’altra ipotesi di lavoro potrebbe anche riguardare il trattamento dell’ipertensione polmonare in considerazione dell’effetto sull’ endotelio e sulla cessione di ossigeno in periferia, come suggerito da alcuni esperti (89).
Inoltre, rispetto a molti altri beta-bloccanti il nebivololo ha un minore effetto cronotropo negativo cosicché il suo uso si associa raramente a frequenze cardiache molto basse che tanto, ed a volte inutilmente, spaventano i pazienti e gli operatori sanitari. Da notare che la riduzione ancorché lieve della FC a riposo e di quella al picco dell’esercizio fanno sì che l’incremento della FC durante esercizio sia mantenuto. A questo proposito, nei pazienti con SC cronico, quando trattati con nebivololo, la capacità di esercizio è simile a quella ottenuta con bisoprololo e superiore a quella osservata con carvedilolo (85).
L’insieme di queste caratteristiche farmacologiche, e cioè la b1 selettività che permette di preservare lo scambio dei gas a livello della barriera alveolo-capillare, la limitata interferenza con i chemorecettori centrali e periferici, la possibilità di somministrarlo in caso di bronchite cronica, la capacità di liberare nitrossido e la conseguente preservata funzione endoteliale ed il ridotto effetto cronotropo negativo fanno sì che il nebivololo possa essere definito un beta-bloccante con caratteristiche di particolare interesse sia per la sua particolare efficacia che per la sua tollerabilità.
Bibliografia
- Becher PM, Lund LH, Coats AJS, Savarese G. An update on global epidemiology in heart failure. Eur Heart J. 2022 Aug 21;43(32):3005–7.
- Bozkurt B, Ahmad T, Alexander KM, Baker WL, Bosak K, Breathett K, et al. Heart Failure Epidemiology and Outcomes Statistics: A Report of the Heart Failure Society of America. J Card Fail. 2023 Oct;29(10):1412–51.
- McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Böhm M, et al. 2023 Focused Update of the 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2023 Oct 1;44(37):3627–39.
- Najafi F, Jamrozik K, Dobson AJ. Understanding the ‘epidemic of heart failure’: a systematic review of trends in determinants of heart failure. Eur J Heart Fail. 2009 May 22;11(5):472–9.
- Vaduganathan M, Claggett BL, Jhund PS, Cunningham JW, Pedro Ferreira J, Zannad F, et al. Estimating lifetime benefits of comprehensive disease-modifying pharmacological therapies in patients with heart failure with reduced ejection fraction: a comparative analysis of three randomised controlled trials. The Lancet. 2020 Jul;396(10244):121–8.
- Gori M, Marini M, De Maria R, Gonzini L, Gorini M, Cassaniti L, et al. Age-related changes in clinical characteristics and outcomes of chronic heart failure outpatients in a cardiology setting. A report from the Italian Network on Heart Failure. Int J Cardiol. 2022 Jan;346:36–44.
- Di Lenarda A, Cittar M, Cappelletto C, et al. Dai trial al mondo reale: uno sguardo all’HFpEF dall’Osservatorio Cardiovascolare del Friuli-Venezia Giulia. G Ital Cardiol 2024 submitted.
- Butler J, Usman MS, Anstrom KJ, Blaustein RO, Bonaca MP, Ezekowitz JA, et al. Soluble guanylate cyclase stimulators in patients with heart failure with reduced ejection fraction across the risk spectrum. Eur J Heart Fail. 2022 Nov 16;24(11):2029–36.
- Hessel FP. Overview of the socio-economic consequences of heart failure. Cardiovasc Diagn Ther. 2021 Feb;11(1):254–62.
- Programma Nazionale Esiti. Edizione 2023. [Internet]. [cited 2024 Jan 15]. Available from: https://pne.agenas.it/ospedaliera/indicatori?noso=cardiovascolare&cond=scompenso%20cardiaco
- Mamas MA, Sperrin M, Watson MC, Coutts A, Wilde K, Burton C, et al. Do patients have worse outcomes in heart failure than in cancer? A primary care‐based cohort study with 10‐year follow‐up in Scotland. Eur J Heart Fail. 2017 Sep 3;19(9):1095–104.
- Remme WJ, McMurray JJV, Rauch B, Zannad F, Keukelaar K, Cohen-Solal A, et al. Public awareness of heart failure in Europe: first results from SHAPE. Eur Heart J. 2005 Nov 1;26(22):2413–21.
- Bozkurt B, Coats AJ, Tsutsui H, et al. Universal Definition and Classification of Heart Failure: A Report of the Heart Failure Society of America, Heart Failure Association of the European Society of Cardiology, Japanese Heart Failure Society and Writing Committee of the Universal Definition of Heart Failure. J Card Fail 2021:S1071-9164(21)00050-6.
- Vasan RS, Xanthakis V, Lyass A, Andersson C, Tsao C, Cheng S, et al. Epidemiology of Left Ventricular Systolic Dysfunction and Heart Failure in the Framingham Study. JACC Cardiovasc Imaging. 2018 Jan;11(1):1–11.
- Simmonds SJ, Cuijpers I, Heymans S, Jones EA V. Cellular and Molecular Differences between HFpEF and HFrEF: A Step Ahead in an Improved Pathological Understanding. Cells. 2020 Jan 18;9(1):242.
- Khan MS, Samman Tahhan A, Vaduganathan M, Greene SJ, Alrohaibani A, Anker SD, et al. Trends in prevalence of comorbidities in heart failure clinical trials. Eur J Heart Fail. 2020 Jun 15;22(6):1032–42.
- Desai AS, Jhund PS, Claggett BL, Vaduganathan M, Miao ZM, Kondo T, et al. Effect of Dapagliflozin on Cause-Specific Mortality in Patients With Heart Failure Across the Spectrum of Ejection Fraction: A Participant-Level Pooled Analysis of DAPA-HF and DELIVER. JAMA Cardiol. 2022 Dec 1;7(12):1227–34.
- Mentz RJ, Felker GM. Noncardiac Comorbidities and Acute Heart Failure Patients. Heart Fail Clin. 2013 Jul;9(3):359–67.
- Moser M, Hebert PR. Prevention of disease progression, left ventricular hypertrophy and congestive heart failure in hypertension treatment trials. J Am Coll Cardiol. 1996 Apr;27(5):1214–8.
- Yusuf S, Hawken S, Ounpuu S, Dans T, Avezum A, Lanas F, et al. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case-control study. Lancet. 364(9438):937–52.
- Frohlich ED, Apstein C, Chobanian A V, Devereux RB, Dustan HP, Dzau V, et al. The heart in hypertension. N Engl J Med. 1992 Oct 1;327(14):998–1008.
- Agno FS, Chinali M, Bella JN, Liu JE, Arnett DK, Kitzman DW, et al. Aortic valve sclerosis is associated with preclinical cardiovascular disease in hypertensive adults: the Hypertension Genetic Epidemiology Network study. J Hypertens. 2005 Apr;23(4):867–73.
- Kannel WB. Incidence and epidemiology of heart failure. Heart Fail Rev. 2000 Jun;5(2):167–73.
- Kenchaiah S, Narula J, Vasan RS. Risk factors for heart failure. Med Clin North Am. 2004 Sep;88(5):1145–72.
- Mahmood SS, Wang TJ. The epidemiology of congestive heart failure: the Framingham Heart Study perspective. Glob Heart. 2013 Mar 1;8(1):77–82.
- Tocci G, Sciarretta S, Volpe M. Development of heart failure in recent hypertension trials. J Hypertens. 2008 Jul;26(7):1477–86.
- Campbell RT, Jhund PS, Castagno D, Hawkins NM, Petrie MC, McMurray JJ V. What have we learned about patients with heart failure and preserved ejection fraction from DIG-PEF, CHARM-preserved, and I-PRESERVE? J Am Coll Cardiol. 2012 Dec 11;60(23):2349–56.
- Drazner MH. The progression of hypertensive heart disease. Circulation. 2011 Jan 25;123(3):327–34.
- Giampietri C, Petrungaro S, Musumeci M, Coluccia P, Antonangeli F, De Cesaris P, et al. c-Flip overexpression reduces cardiac hypertrophy in response to pressure overload. J Hypertens. 2008 May;26(5):1008–16.
- Díez J, González A, López B, Querejeta R. Mechanisms of disease: pathologic structural remodeling is more than adaptive hypertrophy in hypertensive heart disease. Nat Clin Pract Cardiovasc Med. 2005 Apr;2(4):209–16.
- López B, González A, Querejeta R, Larman M, Díez J. Alterations in the pattern of collagen deposition may contribute to the deterioration of systolic function in hypertensive patients with heart failure. J Am Coll Cardiol. 2006 Jul 4;48(1):89–96.
- López B, Querejeta R, González A, Larman M, Díez J. Collagen cross-linking but not collagen amount associates with elevated filling pressures in hypertensive patients with stage C heart failure: potential role of lysyl oxidase. Hypertension. 2012 Sep;60(3):677–83.
- Díez J. Arterial hypertension in patients with heart failure. Heart Fail Clin. 2014 Apr;10(2):233–42.
- Steeds RP. Multimodality imaging in heart failure patients. Curr Opin Cardiol. 2013 Mar;28(2):209–15.
- Pozzoli M, Traversi E, Cioffi G, Stenner R, Sanarico M, Tavazzi L. Loading manipulations improve the prognostic value of Doppler evaluation of mitral flow in patients with chronic heart failure. Circulation. 1997 Mar 4;95(5):1222–30.
- Giannuzzi P, Temporelli PL, Bosimini E, Silva P, Imparato A, Corrà U, et al. Independent and incremental prognostic value of Doppler-derived mitral deceleration time of early filling in both symptomatic and asymptomatic patients with left ventricular dysfunction. J Am Coll Cardiol. 1996 Aug;28(2):383–90.
- Ohtani T, Mohammed SF, Yamamoto K, Dunlay SM, Weston SA, Sakata Y, et al. Diastolic stiffness as assessed by diastolic wall strain is associated with adverse remodelling and poor outcomes in heart failure with preserved ejection fraction. Eur Heart J. 2012 Jul;33(14):1742–9.
- Armstrong AC, Gidding S, Gjesdal O, Wu C, Bluemke DA, Lima JAC. LV mass assessed by echocardiography and CMR, cardiovascular outcomes, and medical practice. JACC Cardiovasc Imaging. 2012 Aug;5(8):837–48.
- Georgiopoulou V V, Kalogeropoulos AP, Butler J. Heart failure in hypertension: prevention and treatment. Drugs. 2012 Jul 9;72(10):1373–98.
- Sciarretta S, Palano F, Tocci G, Baldini R, Volpe M. Antihypertensive treatment and development of heart failure in hypertension: a Bayesian network meta-analysis of studies in patients with hypertension and high cardiovascular risk. Arch Intern Med. 2011 Mar 14;171(5):384–94.
- CONSENSUS Trial Study Group. Effects of enalapril on mortality in severe congestive heart failure. Results of the Cooperative North Scandinavian Enalapril Survival Study (CONSENSUS). N Engl J Med. 1987 Jun 4;316(23):1429–35.
- SOLVD Investigators, Yusuf S, Pitt B, Davis CE, Hood WB, Cohn JN. Effect of enalapril on survival in patients with reduced left ventricular ejection fractions and congestive heart failure. N Engl J Med. 1991 Aug 1;325(5):293–302.
- Packer M, Bristow MR, Cohn JN, Colucci WS, Fowler MB, Gilbert EM, et al. The effect of carvedilol on morbidity and mortality in patients with chronic heart failure. U.S. Carvedilol Heart Failure Study Group. N Engl J Med. 1996 May 23;334(21):1349–55.
- Brophy JM, Joseph L, Rouleau JL. Beta-blockers in congestive heart failure. A Bayesian meta-analysis. Ann Intern Med. 2001 Apr 3;134(7):550–60.
- McMurray JJ V, Adamopoulos S, Anker SD, Auricchio A, Böhm M, Dickstein K, et al. ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail. 2012 Aug;14(8):803–69.
- Mancia G, Kreutz R, Brunström M, Burnier M, Grassi G, Januszewicz A, et al. 2023 ESH Guidelines for the management of arterial hypertension The Task Force for the management of arterial hypertension of the European Society of Hypertension: Endorsed by the International Society of Hypertension (ISH) and the European Renal Association (ERA). J Hypertens. 2023 Dec 1;41(12):1874–2071.
- Czuriga I, Riecansky I, Bodnar J, Fulop T, Kruzsicz V, Kristof E, et al. Comparison of the new cardioselective beta-blocker nebivolol with bisoprolol in hypertension: the Nebivolol, Bisoprolol Multicenter Study (NEBIS). Cardiovasc Drugs Ther. 2003 May;17(3):257–63.
- Sorrentino SA, Doerries C, Manes C, Speer T, Dessy C, Lobysheva I, et al. Nebivolol exerts beneficial effects on endothelial function, early endothelial progenitor cells, myocardial neovascularization, and left ventricular dysfunction early after myocardial infarction beyond conventional β1-blockade. J Am Coll Cardiol. 2011 Feb 1;57(5):601–11.
- Van Bortel LM, Fici F, Mascagni F. Efficacy and tolerability of nebivolol compared with other antihypertensive drugs: a meta-analysis. Am J Cardiovasc Drugs. 2008;8(1):35–44.
- Schmidt AC, Graf C, Brixius K, Scholze J. Blood pressure-lowering effect of nebivolol in hypertensive patients with type 2 diabetes mellitus: the YESTONO study. Clin Drug Investig. 2007;27(12):841–9.
- Borlaug BA. Evaluation and management of heart failure with preserved ejection fraction. Nat Rev Cardiol. 2020 Sep;17(9):559–73.
- Pfeffer MA, Shah AM, Borlaug BA. Heart Failure With Preserved Ejection Fraction In Perspective. Circ Res. 2019 May 24;124(11):1598–617.
- Shah SJ, Kitzman DW, Borlaug BA, van Heerebeek L, Zile MR, Kass DA, et al. Phenotype-Specific Treatment of Heart Failure With Preserved Ejection Fraction: A Multiorgan Roadmap. Circulation. 2016 Jul 5;134(1):73–90.
- Heidenreich PA, Bozkurt B, Aguilar D, Allen LA, Byun JJ, Colvin MM, et al. 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure: Executive Summary: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2022 May 3;145(18):e876–94.
- Lüscher TF. Lumpers and splitters: the bumpy road to precision medicine. Eur Heart J. 2019 Oct 21;40(40):3292–6.
- Ho JE, Zern EK, Wooster L, Bailey CS, Cunningham T, Eisman AS, et al. Differential Clinical Profiles, Exercise Responses, and Outcomes Associated With Existing HFpEF Definitions. Circulation. 2019 Jul 30;140(5):353–65.
- Eisman AS, Shah R V, Dhakal BP, Pappagianopoulos PP, Wooster L, Bailey C, et al. Pulmonary Capillary Wedge Pressure Patterns During Exercise Predict Exercise Capacity and Incident Heart Failure. Circ Heart Fail. 2018 May;11(5):e004750.
- Dorfs S, Zeh W, Hochholzer W, Jander N, Kienzle RP, Pieske B, et al. Pulmonary capillary wedge pressure during exercise and long-term mortality in patients with suspected heart failure with preserved ejection fraction. Eur Heart J. 2014 Nov 21;35(44):3103–12.
- Castiglione V, Aimo A, Vergaro G, Saccaro L, Passino C, Emdin M. Biomarkers for the diagnosis and management of heart failure. Heart Fail Rev. 2022 Mar;27(2):625–43.
- Albani S, Zilio F, Scicchitano P, Musella F, Ceriello L, Marini M, et al. Comprehensive diagnostic workup in patients with suspected heart failure and preserved ejection fraction. Hellenic J of Cardiology 2023 Sep 22:S1109-9666(23)00184-7.
- Ahmad T, Desai NR, Januzzi JL. Heart Failure With Preserved Ejection Fraction. JACC Heart Fail. 2020 Mar;8(3):185–7.
- Peikert A, Bart BA, Vaduganathan M, Claggett BL, Kulac IJ, Kosiborod MN, et al. Contemporary Use and Implications of Beta-Blockers in Patients With HFmrEF or HFpEF. JACC Heart Fail. 2024 Apr;12(4):631–44.
- Anker SD, Butler J, Filippatos G, Shahzeb Khan M, Ferreira JP, Bocchi E, et al. Baseline characteristics of patients with heart failure with preserved ejection fraction in the EMPEROR‐Preserved trial. Eur J Heart Fail. 2020 Dec 8;22(12):2383–92.
- Solomon SD, Vaduganathan M, Claggett BL, de Boer RA, DeMets D, Hernandez AF, et al. Baseline Characteristics of Patients With HF With Mildly Reduced and Preserved Ejection Fraction. JACC Heart Fail. 2022 Mar;10(3):184–97.
- Brixius K, Middeke M, Lichtenthal A, Jahn E, Schwinger RHG. Nitric oxide, erectile dysfunction and beta-blocker treatment (MR NOED study): benefit of nebivolol versus metoprolol in hypertensive men. Clin Exp Pharmacol Physiol. 2007 Apr;34(4):327–31.
- Chan You S, Krumholz HM, Suchard MA, Schuemie MJ, Hripcsak G, Chen R, et al. Comprehensive Comparative Effectiveness and Safety of First-Line β-Blocker Monotherapy in Hypertensive Patients: A Large-Scale Multicenter Observational Study. Hypertension. 2021 May 5;77(5):1528–38.
- Huck DM, Rosenberg MA, Stauffer BL. Nebivolol and incident cardiovascular events in hypertensive patients compared with nonvasodilatory beta blockers. J Hypertens. 2022 May 1;40(5):1019–29.
- Knuuti J, Wijns W, Saraste A, Capodanno D, Barbato E, Funck-Brentano C, et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J. 2020 Jan 14;41(3):407–77.
- Dahl Aarvik M, Sandven I, Dondo TB, Gale CP, Ruddox V, Munkhaugen J, et al. Effect of oral β-blocker treatment on mortality in contemporary post-myocardial infarction patients: a systematic review and meta-analysis. Eur Heart J Cardiovasc Pharmacother. 2019 Jan 1;5(1):12–20.
- Misumida N, Harjai K, Kernis S, Kanei Y. Does Oral Beta-Blocker Therapy Improve Long-Term Survival in ST-Segment Elevation Myocardial Infarction With Preserved Systolic Function? A Meta-Analysis. J Cardiovasc Pharmacol Ther. 2016 May;21(3):280–5.
- Hindricks G, Potpara T, Dagres N, Arbelo E, Bax JJ, Blomström-Lundqvist C, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2021 Feb 1;42(5):373–498.
- Gillman MW, Kannel WB, Belanger A, D’Agostino RB. Influence of heart rate on mortality among persons with hypertension: the Framingham Study. Am Heart J. 1993 Apr;125(4):1148–54.
- Esler M, Kjeldsen SE, Pathak A, Grassi G, Kreutz R, Mancia G. Diverse pharmacological properties, trial results, comorbidity prescribing and neural pathophysiology suggest European hypertension guideline downgrading of beta-blockers is not justified. Blood Press. 2022 Dec 31;31(1):210–24.
- Oba Y, Kabutoya T, Kohro T, Imai Y, Kario K, Sato H, et al. Relationships Among Heart Rate, β-Blocker Dosage, and Prognosis in Patients With Coronary Artery Disease in a Real-World Database Using a Multimodal Data Acquisition System. Circ J. 2023 Jan 25;87(2):336–44.
- Effect of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL Randomised Intervention Trial in Congestive Heart Failure (MERIT-HF). Lancet. 1999 Jun 12;353(9169):2001–7.
- The Cardiac Insufficiency Bisoprolol Study II (CIBIS-II): a randomised trial. Lancet. 1999 Jan 2;353(9146):9–13.
- Flather MD, Shibata MC, Coats AJS, Van Veldhuisen DJ, Parkhomenko A, Borbola J, et al. Randomized trial to determine the effect of nebivolol on mortality and cardiovascular hospital admission in elderly patients with heart failure (SENIORS). Eur Heart J. 2005 Feb;26(3):215–25.
- Cleland JGF, Bunting K V, Flather MD, Altman DG, Holmes J, Coats AJS, et al. Beta-blockers for heart failure with reduced, mid-range, and preserved ejection fraction: an individual patient-level analysis of double-blind randomized trials. Eur Heart J. 2018 Jan 1;39(1):26–35.
- Nodari S, Metra M, Dei Cas L. Beta-blocker treatment of patients with diastolic heart failure and arterial hypertension. A prospective, randomized, comparison of the long-term effects of atenolol vs. nebivolol. Eur J Heart Fail. 2003 Oct;5(5):621–7.
- Swedberg K, Cleland J, Dargie H, Drexler H, Follath F, Komajda M, et al. Guidelines for the diagnosis and treatment of chronic heart failure: executive summary (update 2005): The Task Force for the Diagnosis and Treatment of Chronic Heart Failure of the European Society of Cardiology. Eur Heart J. 2005 Jun;26(11):1115–40.
- Packer M, McMurray JJ V. Rapid evidence-based sequencing of foundational drugs for heart failure and a reduced ejection fraction. Eur J Heart Fail. 2021 Jun;23(6):882–94.
- McAlister FA, Wiebe N, Ezekowitz JA, Leung AA, Armstrong PW. Meta-analysis: beta-blocker dose, heart rate reduction, and death in patients with heart failure. Ann Intern Med. 2009 Jun 2;150(11):784–94.
- van Veldhuisen DJ, Cohen-Solal A, Böhm M, Anker SD, Babalis D, Roughton M, et al. Beta-blockade with nebivolol in elderly heart failure patients with impaired and preserved left ventricular ejection fraction: Data From SENIORS (Study of Effects of Nebivolol Intervention on Outcomes and Rehospitalization in Seniors With Heart Failure). J Am Coll Cardiol. 2009 Jun 9;53(23):2150–8.
- Tavazzi L. Il trial SENIORS nel contesto della terapia dello scompenso cardiaco nel paziente anziano. G Gerontol 2005;53:248-252.
- Contini M, Apostolo A, Cattadori G, Paolillo S, Iorio A, Bertella E, et al. Multiparametric comparison of CARvedilol, vs. NEbivolol, vs. BIsoprolol in moderate heart failure: the CARNEBI trial. Int J Cardiol. 2013 Oct 3;168(3):2134–40.
- Sinagra G, Corrà U, Contini M, Magrì D, Paolillo S, Perrone Filardi P, et al. Choosing among β-blockers in heart failure patients according to β-receptors’ location and functions in the cardiopulmonary system. Pharmacol Res. 2020 Jun;156:104785.
- Sciomer S, De Carlo C, Moscucci F, Maffei S. Age at menopause: A fundamental data of interest to acquire in female patients’ anamnesis. Int J Cardiol. 2016 Jul 15;215:358–9.
- Sciomer S, Moscucci F, Maffei S, Gallina S, Mattioli A V. Prevention of cardiovascular risk factors in women: The lifestyle paradox and stereotypes we need to defeat. Eur J Prev Cardiol. 2019 Apr;26(6):609–10.
- Badagliacca R, Mercurio V, Romeo E, Correale M, Masarone D, Papa S, et al. Beta-blockers in pulmonary arterial hypertension: Time for a second thought? Vascul Pharmacol. 2022 Jun;144:106974.
1. Epidemiologia dello scompenso cardiaco
Lo scompenso cardiaco (SC) è una sindrome che negli ultimi decenni ha assunto un ruolo epidemiologico sempre più rilevante in termini di incidenza, prevalenza, per le sue conseguenze prognostiche nonché per il suo impatto socioeconomico (1–4).
L’incidenza dello SC, stimata tra 1 e 20 casi per 1.000 abitanti (1), è condizionata da diversi fattori (4). L’invecchiamento della popolazione, l’aumentata prevalenza di condizioni fortemente predisponenti come diabete ed obesità, l’aumentata sopravvivenza dei pazienti coronaropatici ed ipertesi, l’aumentata capacità diagnostica hanno determinato un aumento dell’incidenza. Al contrario, ne hanno limitato l’aumento: le migliori strategie di prevenzione delle sindromi coronariche acute, la minore severità della disfunzione ventricolare dopo un evento ischemico acuto, il migliore trattamento dell’ipertensione arteriosa e le più efficaci strategie di prevenzione nei pazienti diabetici (1–4). Come mostrato in Figura 1, oltre alle variazioni di incidenza, la prevalenza è legata alle variazioni di sopravvivenza dei pazienti già affetti da SC (4).
Nelle ultime decadi, infatti, i nuovi approcci terapeutici hanno migliorato sensibilmente la prognosi dei pazienti, in particolare di quelli con SC a frazione di eiezione (FE) compromessa (3,5). Tale beneficio si è osservato non solo negli studi randomizzati ma anche in quelli di “mondo reale” (6). Come risultante di tutti i fattori sopraelencati, nei prossimi anni, è atteso un progressivo aumento del numero di pazienti affetti da SC (Figura 1) (2), la cui prevalenza rispetto alla popolazione generale è attualmente stimata tra 1 e 3% (1–3,7).
Nonostante tali miglioramenti, tuttavia, la prognosi dei pazienti con SC rimane severa (1–6,8). Anche quando si guarda alle curve di sopravvivenza dei pazienti trattati con le più recenti strategie farmacologiche, non si può non osservare come il rischio residuo rimanga ancora elevato. Ciò è ancor più evidente nei pazienti che si avviano verso le fasi più avanzate dello SC, quando diventano sempre più frequenti le ospedalizzazioni per riacutizzazione di scompenso (8).
Le ospedalizzazioni per SC rappresentano, pertanto, un marker prognostico rilevante che ha anche ricadute in termini di impatto socioeconomico. Si stima che le ospedalizzazioni costituiscano circa il 75% dei costi di gestione dello SC. Tali costi, nel loro complesso, assorbono circa l’1-2% del budget sanitario nazionale dei Paesi europei (9).
In Italia, in base all’analisi dei DRG dei ricoveri ordinari (10), le riacutizzazioni dello SC rappresentano la principale causa di ospedalizzazione, seconda solo ai ricoveri per parto. Negli ultimi anni, si è osservata una lieve flessione nel numero di ricoveri e nella probabilità di nuovo ricovero a 30 giorni, mentre la mortalità a 30 giorni è rimasta sostanzialmente invariata (Figura 2) (10).
È importante sottolineare, a tal proposito, come, complessivamente, la mortalità dei pazienti con SC rimanga superiore rispetto a molte delle patologie oncologiche più temute (11). A fronte di tali evidenze epidemiologiche, tuttavia, la percezione nell’opinione pubblica delle implicazioni di una diagnosi di SC nella aspettativa di vita di un paziente è molto sottostimata così come il suo impatto socioeconomico (12).
1.1 Fenotipi e comorbilità
Lo SC include un insieme eterogeneo di pazienti. Un’eterogeneità che è innanzitutto legata alle differenti eziologie sottostanti alla insorgenza della disfunzione cardiaca responsabile della sindrome. All’eterogeneità eziologica si affianca anche quella fisiopatologica, con necessità di utilizzare criteri utili ad individuare gruppi omogenei che possono beneficiare di un approccio terapeutico comune (13). Il principale dei criteri attualmente utilizzati è quello basato sulla frazione d’eiezione del ventricolo sinistro (VS) che distingue pazienti con FE compromessa (≤ 40%, “heart failure with reduced ejection fraction”, HFrEF), con FE lievemente compromessa (tra 41 e 49%, “heart failure with mildly reduced ejection fraction”, HFmrEF) e pazienti con FE preservata (≥ 50%, “heart failure with preserved ejection fraction”, HFpEF) (3,13). È importante sottolineare come, da un punto di vista epidemiologico, negli ultimi decenni la proporzione di pazienti con HFpEF sia aumentata e come attualmente questo gruppo rappresenti più della metà dei pazienti affetti da SC (14).
L’utilità principale di una classificazione basata sulla sola FE, che ha, come misura, molteplici limiti, è mutuata dai pazienti con HFrEF. Questi costituiscono un gruppo con un background fisiopatologico più omogeneo, in cui l’attivazione neuro-ormonale rappresenta uno dei principali meccanismi responsabili della progressione del rimodellamento ventricolare e della disfunzione sistolica del VS. In questo stesso gruppo la modulazione neuro-ormonale rappresenta anche un target terapeutico capace di migliorare la prognosi dei pazienti (3). I pazienti con HFmrEF ed ancor di più quelli con HFpEF rappresentano, invece, un gruppo di pazienti con meccanismi fisiopatologici maggiormente eterogenei, nei quali non è stata dimostrata con uguale forza delle evidenze l’efficacia di un approccio terapeutico basato sulla modulazione neuro-ormonale (3).
In tali gruppi è emersa, negli ultimi anni, la necessità di una migliore caratterizzazione basata su genere, su ipertensione e fibrillazione atriale, su aspetti metabolici come obesità e diabete nonché sulle comorbilità, di natura CV e non (15). I pazienti con HFpEF, d’altro canto, sono più anziani e presentano più frequentemente molteplici comorbilità (16). Ciò si riflette anche nelle differenze osservate nella causa di ospedalizzazione e di morte di questi pazienti, che rispetto ai pazienti con HFrEF, è proporzionalmente maggiormente legata a cause di natura non CV (17).
Le comorbilità non sono rilevanti solo per la caratterizzazione ed il trattamento dei pazienti con HFpEF. Il loro impatto sia in termini di evoluzione clinica della sindrome che in termini di approccio terapeutico è spesso indipendente dalla FE. Tra le comorbilità CV l’ipertensione arteriosa, la cardiopatia ischemica e la fibrillazione atriale sono sicuramente quelle con maggiori risvolti nella gestione terapeutica dei pazienti. La presenza, infatti, di una pressione non controllata, di ischemia inducibile e/o di una fibrillazione atriale ad elevata frequenza di risposta ventricolare possono condizionare la stabilità clinica di tutti i pazienti con SC.
Oltre alle comorbilità CV, quelle non CV sono sempre più prevalenti nei pazienti con SC. Tra le più frequenti il diabete, la malattia renale cronica, la carenza marziale, l’anemia e la broncopneumopatia cronica ostruttiva (BPCO). Anche tali comorbilità assumono un peso che è indipendente dalla FE. Le riacutizzazioni di SC possono, ad esempio, essere la conseguenza di una riacutizzazione di BPCO e di malattia renale cronica (18). La presenza di BPCO può condizionare l’uso della terapia betabloccante, mentre la malattia renale cronica quello degli inibitori del sistema renina-angiotensina-aldosterone (SRAA).
In conclusione, nella gestione dello SC non è possibile prescindere da un’adeguata caratterizzazione del paziente basata sulla valutazione ed il trattamento delle comorbilità.
2. Ipertensione e scompenso cardiaco: relazioni pericolose
L’ipertensione arteriosa si associa ad un notevole grado di morbilità e mortalità. Tra le numerose patologie CV che spesso si associano all’ipertensione lo SC è sicuramente quella che determina la peggior “relazione pericolosa” (Figura 3) (19).
L’aumento della pressione arteriosa (PA) è uno dei principali fattori di rischio di aterosclerosi coronarica e la prevalenza dell’ipertensione arteriosa in questi pazienti è superiore al 60% (20). La cardiopatia ipertensiva è la risposta del miocardio al postcarico determinato dall’aumento della PA che porta all’ipertrofia ventricolare sinistra (IVsx) (21). Inoltre, la prevalenza della sclerosi della valvola aortica è maggiore nei pazienti ipertesi rispetto ai soggetti con pressione arteriosa normale, in particolare nelle persone anziane (22).
La cardiopatia ischemica, l’IVsx e la malattia della valvola aortica possono coesistere nel paziente iperteso, favorendo la comparsa di SC.
2.1 Aspetti epidemiologici e fisiopatologici
I dati epidemiologici dello studio Framingham forniscono informazioni sui fattori di rischio modificabili che favoriscono la comparsa di SC (23–25). A questo proposito, sulla base dei rischi attribuibili sulla popolazione generale, l’ipertensione ha l’impatto maggiore, contribuendo al 39% dell’incidenza di SC negli uomini e al 59% nelle donne. L’ipertensione aumenta il rischio di SC (aggiustato per età) di 2 volte negli uomini e di 3 volte nelle donne, con un impatto maggiore della pressione sistolica rispetto a quella diastolica.
L’incidenza di SC è elevata anche nei pazienti ipertesi in trattamento. Una revisione sistematica di 23 studi sull’ipertensione condotti tra il 1997 e il 2007 che includeva 193.424 pazienti, ha rivelato un’incidenza del 28,9% di nuovi casi di SC (26). Lo sviluppo di SC era più probabile negli anziani, nei pazienti di colore, nei diabetici e negli individui a rischio cardiovascolare (CV) molto alto.
L’esame delle caratteristiche dei pazienti con HFrEF e dei pazienti con HFpEF (N = 19.519) inclusi negli studi del Digitalis Investigation Group, negli studi CHARM (Candesartan in Heart Failure: Assessment of Reduction in Mortality and Morbidity) e nello studio I-PRESERVE (Irbesartan in Heart Failure with Preserved Systolic Function Trial) mostra che l’ipertensione è il principale determinante dell’HFpEF, molto più che dell’HFrEF (27). Dal punto di vista fisiopatologico, in risposta all’aumento della PA, si sviluppa inizialmente una ipertrofia ventricolare sinistra (IVsx) concentrica, successivamente tale meccanismo compensatorio si perde ed attraverso diverse vie il quadro può evolvere verso lo SC (Figura 4) (28).
In primo luogo, è ben noto che i pazienti con IVsx concentrica possono sviluppare HFpEF e che solo successivamente, in una minoranza di casi, il quadro può progredire verso l’HFrEF. In secondo luogo, alcuni pazienti ipertesi possono sviluppare un pattern geometrico di crescita del VS che è diverso dall’ipertrofia concentrica (e.g. rimodellamento concentrico o eccentrico), che può evolvere in HFpEF o in HFrEF.
Queste diverse possibilità di progressione dall’ipertensione arteriosa allo SC sono il risultato dell’influenza di fattori modulatori (e.g. genetica, sesso, invecchiamento, fattori legati allo stile di vita, obesità e diabete mellito) nonché dei cambiamenti strutturali del miocardio che si verificano in risposta a meccanismi emodinamici e non emodinamici (29–33).
2.2 Aspetti diagnostici e terapeutici
L’imaging o i biomarcatori biochimici possono fornire importanti informazioni sulla patogenesi dello SC associato all’ipertensione, ma possono anche essere utili nell’identificazione e nello screening dei pazienti a rischio di sviluppare SC e nel monitoraggio della terapia.
L’imaging svolge un ruolo centrale nella diagnosi e nella guida del trattamento nei pazienti ipertesi con SC (34). L’ecocardiografia è ampiamente disponibile e clinicamente utile per la rilevazione dell’IVsx e per la valutazione della funzione diastolica e sistolica. Inoltre, diversi studi hanno dimostrato le alterazioni degli indici eco-Doppler nei pazienti con HFrEF (35,36) e nei pazienti con HFpEF (37).
Sebbene l’ecocardiografia sia riconosciuta come centrale per la gestione del paziente iperteso con SC, altre metodologie di imaging possono offrire in casi selezionati alcuni vantaggi per la caratterizzazione diagnostica della cardiopatia ipertensiva nei pazienti con SC. Ad esempio, la risonanza magnetica cardiaca (RNM) ha dimostrato di essere più riproducibile dell’ecocardiografia per la stima della massa VS e la caratterizzazione tissutale del miocardio (38).
L’ipertensione arteriosa come causa di SC è quindi tra i principali problemi sanitari in ambito CV ed è pertanto necessario ottimizzare le strategie per trattarla e prevenire la sua evoluzione in SC.
Numerosi studi hanno dimostrato che tutti i principali agenti antipertensivi riducono l’incidenza di SC, confermando così che la riduzione della PA è una strategia fondamentale per prevenire lo SC nei pazienti con ipertensione arteriosa (39). Ad esempio, una metanalisi di 12 studi condotti sull’ipertensione arteriosa che includevano lo sviluppo di SC ha mostrato significativi benefici terapeutici indotti dalla terapia antipertensiva (40) con una riduzione di nuovi casi di SC del 52% rispetto al placebo.
Nei pazienti con HFrEF, numerosi studi indicano che gli inibitori del SRAA ed i beta-bloccanti riducono la mortalità e i tassi di ospedalizzazione, quindi questi agenti sono la terapia di prima linea in questi pazienti e dovrebbero essere usati come base del trattamento antipertensivo e della disfunzione VS (41–44).
Il trattamento intensivo dell’ipertensione arteriosa è altrettanto importante nei pazienti con HFpEF. Gli inibitori del SRAA sembrano particolarmente efficaci in questi pazienti. Allo stesso modo i beta-bloccanti sono stati reintrodotti come farmaci con la più elevata classe di raccomandazione (I e livello di evidenza A) (45).
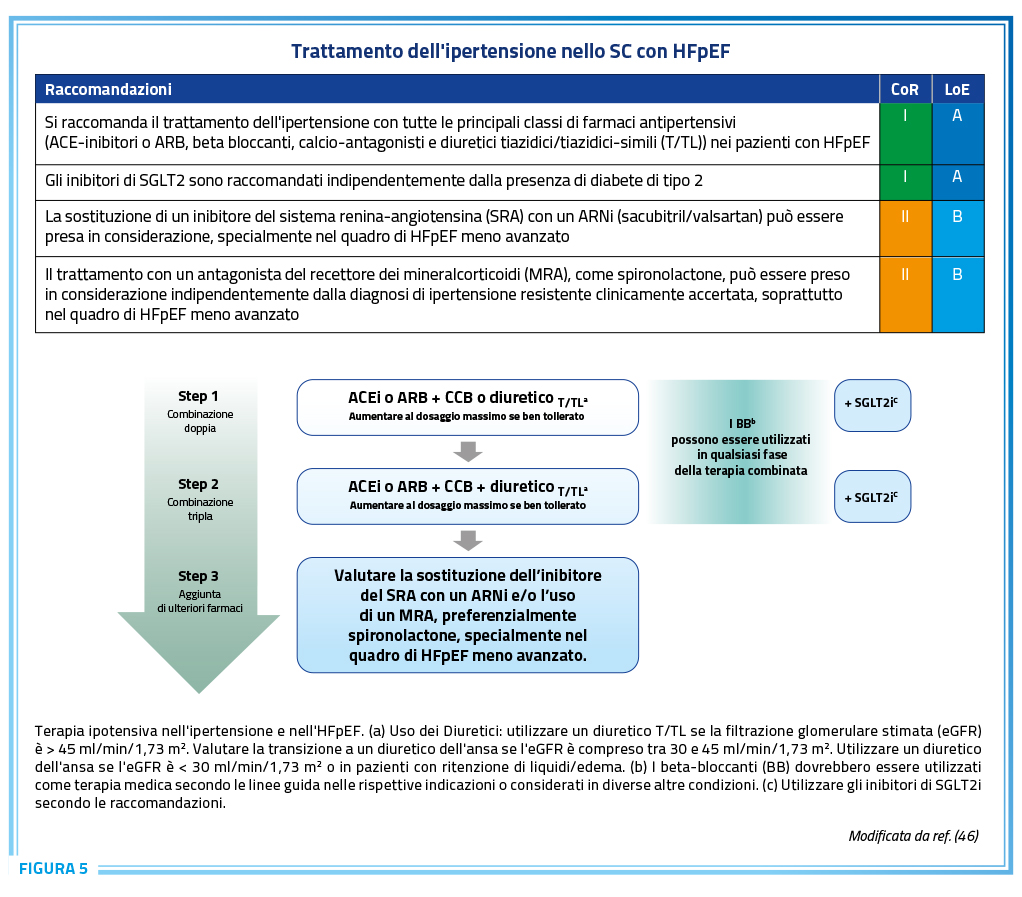
Le più recenti linee guida sul trattamento dell’ipertensione arteriosa definiscono quale possa essere una corretta strategia terapeutica nel trattare a target i pazienti ipertesi o ad evitare lo sviluppo di HFpEF (Figura 5) (46).
Risulta evidente come i beta-bloccanti possano essere inseriti come terapia di associazione in ogni step dell’approccio terapeutico. I beta-bloccanti sono una classe di farmaci utilizzata da più di 30 anni nella terapia antipertensiva. Esistono 3 generazioni di farmaci beta-bloccanti, col tempo introdotte nella pratica clinica. In particolare, la terza generazione di beta-bloccanti è composta da molecole sia selettive sia non selettive per b1 che però possiedono proprietà addizionali (come la capacità vasodilatatoria di stimolare la produzione di NO) che devono essere prese in considerazione per ottimizzare una terapia di tipo personalizzato. Il nebivololo appartiene alla terza generazione di beta-bloccanti e, infatti, possiede non solo un’elevata selettività per b1, ma anche proprietà vasodilatatorie ed una lunga durata d’azione. In particolare, il nebivololo è la molecola, rispetto ai beta-bloccanti di generazioni precedenti, con più alta selettività per b1; inoltre, non sembra possedere né attività simpaticomimetica intrinseca né antagonismo a-adrenergico (47). La vasodilatazione arteriosa endotelio-dipendente, che si manifesta anche a livello coronarico, deriva dalle proprietà agoniste sui recettori b3 che determinano l’incremento di disponibilità di ossido nitrico (NO) con 2 meccanismi, la riduzione del superossido e quindi della inattivazione del NO e lo stimolo della NO sintetasi (48).
Alla luce delle sue caratteristiche il nebivololo ha indicazioni terapeutiche approvate per il trattamento della ipertensione essenziale oltre che dello SC cronico dell’anziano (≥ 70 anni) di grado lieve o moderato con diversa eziologia in aggiunta alle terapie standard.
Una metanalisi di 12 studi randomizzati su pazienti ipertesi ha dimostrato che la terapia con nebivololo 5 mg/die in monosomministrazione si associava ad una maggiore probabilità di raggiungere l’obiettivo della normalizzazione della pressione ed a minori effetti collaterali rispetto a dosaggi terapeutici di altri farmaci antipertensivi (ACE inibitori, sartani, calcio-antagonisti) (49).
Il nebivololo sembra essere un beta-bloccante particolarmente adatto ai pazienti ipertesi e diabetici. Lo studio YESTONO aveva l’obiettivo di verificare gli effetti ipotensivi e metabolici del nebivololo in pazienti ipertesi con diabete di tipo 2 (con o senza altre comorbidità) (50). Ai pazienti arruolati è stato prescritto il trattamento con nebivololo, in monoterapia o in aggiunta ad altri farmaci antipertensivi. Dopo tre mesi dall’introduzione in terapia del nebivololo, la pressione sistolica e diastolica sono diminuite rispettivamente di 21,1 e 10,9 mmHg e il 62% dei pazienti è risultato raggiungere l’obiettivo raccomandato di pressione < 130/80 mmHg, dimostrando l’efficacia dell’effetto antipertensivo della molecola. I parametri più rilevanti valutati in questo studio erano però i parametri metabolici come glicemia a digiuno, emoglobina glicata, peso, colesterolo totale e trigliceridi. A 3 mesi dall’inizio dell’assunzione di nebivololo, tutti i parametri elencati sono risultati essere significativamente migliorati rispetto ai livelli registrati all’inizio dello studio, supportando l’ipotesi che il nebivololo, a differenza dei beta-bloccanti della prima e seconda generazione, non ha effetti dismetabolici nel paziente iperteso.
In conclusione, esiste una relazione pericolosa tra ipertensione arteriosa e SC? Si! È una relazione stretta, maligna ma che si può prevenire e curare. Sta a noi essere efficaci e non inerti, sviluppando un’alleanza terapeutica efficace tra medico e paziente.
3. HFpEF: diagnosi e caratteristiche dei pazienti
Lo SC con HFpEF è caratterizzato da segni e sintomi di SC con una FE VS ≥ 50%. Pertanto, lo SC può essere definito emodinamicamente in un paziente con FE VS preservata come una ridotta capacità del cuore di pompare sangue nell’organismo in una quantità commisurata alle esigenze dell’organismo stesso (Tabella 1) (51).
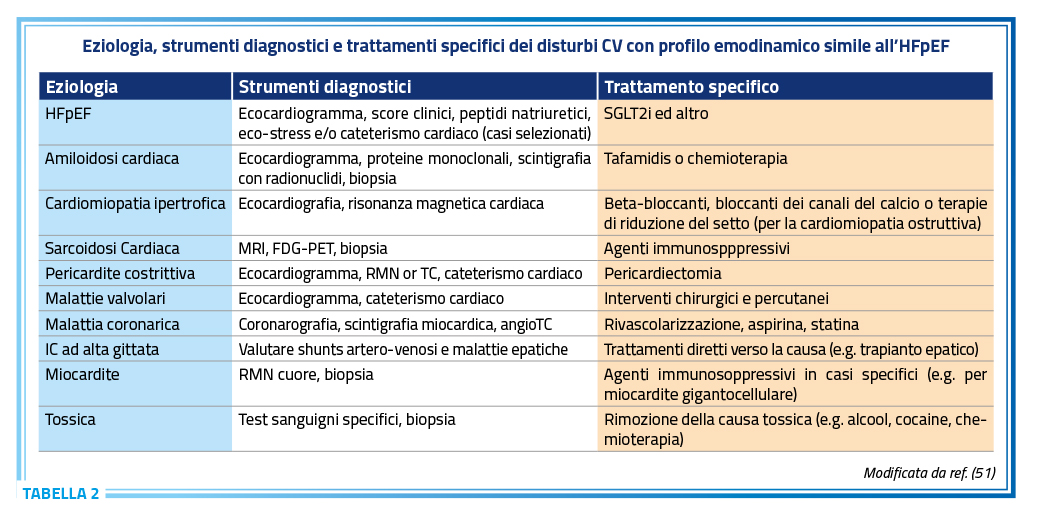
L’HFpEF è maggiormente presente nei pazienti anziani ed è associata a comorbilità come ipertensione arteriosa, insufficienza renale, diabete, obesità e sindrome metabolica (52,53). I meccanismi fisiopatologici che determinano tale patologia non sono ancora completamente compresi, ma sono correlati a sovraccarico pressorio, infiammazione sistemica, disfunzione coronarica, ischemia tissutale, fibrosi, disfunzione metabolica e disfunzione endoteliale. Esistono una serie di patologie o disturbi CV che hanno lo stesso profilo emodinamico presente nell’HFpEF ma che non dovrebbero essere considerate un vero HFpEF. Riunire tutte queste eziologie specifiche sotto la definizione dell’HFpEF, analogamente a quanto avviene per l’HFrEF, può determinare un aumento dell’eterogeneità, rischiando di privare alcuni pazienti di potenziali terapie specifiche (54,55) (Tabella 2).
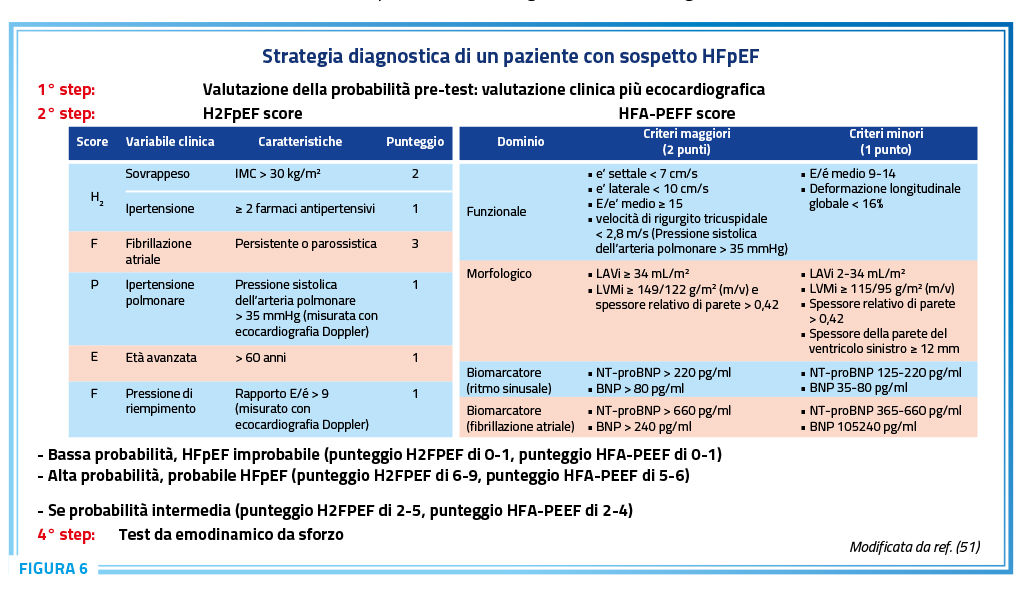
L’HFpEF è una condizione che prevede un percorso diagnostico complesso mirato a fornire una diagnosi accurata per prescrivere farmaci adeguati e identificare cause specifiche, cercando di fenotipizzare nel modo più preciso possibile i pazienti. La diagnosi può risultare complessa, tant’è che l’HFpEF è sottodiagnosticata. La diagnosi di HFpEF richiede una valutazione multiparametrica che include una valutazione ecocardiografica di base, un dosaggio dei livelli di biomarcatori cardiaci, l’utilizzo di scores, ed in casi selezionati l’ecocardiografia da stress e/o una valutazione invasiva. Sebbene l’American Society of Echocardiography e l’European Association of Cardiovascular Imaging abbiano proposto un approccio basato sui dati ecocardiografici, in casi selezionati sintomi e disfunzione diastolica non presenti a riposo possono emergere da sforzo, rendendo necessari test da sforzo, sia invasivi che non.
L’uso dei peptidi natriuretici è utile e necessario per la diagnosi di HFpEF. I peptidi natriuretici sono validi predittori di esiti sfavorevoli nei pazienti con SC indipendentemente dai valori della FE VS. Il BNP e l’NTproBNP si sono dimostrati, rispettivamente, più sensibile e più specifico per la diagnosi HFpEF. Le raccomandazioni dell’ESC per la diagnosi di HFpEF hanno indicato che un NT-proBNP > 220 pg/mL o BNP > 80 pg/mL sono i criteri principali per la diagnosi di HFpEF nei pazienti in ritmo sinusale, mentre un NT-proBNP > 660 pg/ml o BNP > 240 pg/ml dovrebbero essere utilizzati come cut-off nei pazienti con fibrillazione atriale (56–58).
È inoltre da considerare la diversa sensibilità e specificità di valori intermedi di NTproBNP in rapporto all’età dei pazienti. Nei pazienti ultrasettantaciquenni (la maggioranza dei pazienti con HFpEF) i valori di NTproBNP della zona grigia variano tra 300 e 1800 pg/ml, mentre lo scompenso viene ritenuto probabile per valori >1800 pg/ml (59).
L’elettrocardiogramma (ECG) è un elemento chiave nella valutazione di pazienti con sospetto HFpEF. L’ECG può evidenziare segni di ischemia, ipertrofia ventricolare sinistra, fibrillazione atriale o altri disturbi del ritmo cardiaco che possono contribuire ai sintomi.
L’ecocardiografia è la modalità di imaging più utilizzata nella diagnosi e nel monitoraggio dell’HFpEF e comprende la misurazione della FE VS, della massa miocardica e dei volumi atriali, la valutazione delle pressioni di riempimento e la misurazione della pressione arteriosa polmonare (PAP). La misurazione della funzione di riempimento è essenziale. Inoltre, l’ecocardiografia consente la valutazione delle comorbidità e delle cause sottostanti di HFpEF.
A questo punto, l’uso di algoritmi validati è utile per confermare, escludere o suggerire la diagnosi di HFpEF. In letteratura sono stati pubblicati diversi algoritmi e scores che incorporano variabili indipendenti di HFpEF (e.g. H2FPEF e HFA-PEFF). Questi metodi consentono un approccio bayesiano alla diagnosi di HFpEF, in base al quale vengono diagnosticati i pazienti con una probabilità bassa o alta di malattia e ciò permette di riservare il cateterismo cardiaco ai pazienti con una probabilità pre-test di grado intermedio (Figura 6) (51,60).
Un ruolo importante ha anche il test cardiopolmonare (CPET) per la possibilità di valutare una moltitudine di variabili derivate, fornendo informazioni approfondite delle cause cardiache o non cardiache della limitazione dell’esercizio. Il CPET è particolarmente utile per differenziare l’HFpEF dalla dispnea non cardiaca.
La risonanza magnetica cardiaca (RMC) contribuisce a caratterizzare le alterazioni anatomiche e funzionali dei pazienti con HFpEF. La RMC fornisce informazioni sulla morfologia cardiaca, la massa del VS, la compliance del VS e la presenza di fibrosi miocardica. Anche la scintigrafia miocardica può essere un esame utile per escludere la cardiopatia ischemica come causa dei sintomi.
Infine, in casi selezionati per la diagnosi di HFpEF può essere utile la misurazione della PAP e la determinazione della pressione venosa polmonare (PVP) media con cateterismo cardiaco. La PVP media ed una pressione capillare polmonare (WP) ≥ 15 mmHg possono aiutare a stabilire la presenza di congestione polmonare, confermando così la diagnosi di HFpEF. Talvolta, se i valori di WP aumentano e rientrano in determinati intervalli con il sollevamento passivo delle gambe, si suggerisce di eseguire un cateterismo cardiaco da sforzo su cicloergometro che ha dimostrato un’elevata accuratezza in caso di stress-WP ≥ 25 mmHg.
4. HFpEF: trattamento attuale e nuove linee guida
Fino all’arrivo degli SGLT2i, il trattamento dell’HFpEF è stato probabilmente l’argomento di ricerca CV che ha raccolto più insuccessi scientifici, probabilmente per l’errore di fondo di volere trattare con modalità “one size fits all” una malattia estremamente eterogenea per eziologia e meccanismi fisiopatologici (61).
Solo recentemente, l’HFpEF ha trovato una prima possibilità di cura “specifica” con i 2 trial Emperor Preserved (Anker) e Deliver (Solomon), alla base della classe di raccomandazione IA per empagliflozin e dapagliflozin nell’HFmrEF e nell’HFpEF. In particolare, nei pazienti con HFmrEF o HFpEF arruolati nello studio Deliver, 4 su 5 partecipanti (corrispondente all’83% della popolazione di studio) sono stati trattati con un beta-bloccante. L’uso di beta-bloccanti non è stato associato a un rischio più elevato di peggioramento dello scompenso cardiaco o morte cardiovascolare. Inoltre, il farmaco dapagliflozin ha ridotto in modo consistente e sicuro gli eventi clinici, indipendentemente dall’uso di beta-bloccanti (62).
Per quanto riguarda i farmaci antagonisti/modulatori neurormonali la classe di raccomandazione nell’HFmrEF è IIB, mentre nell’HFpEF l’indicazione di classe IA per questi farmaci rientra nel più generico ma non meno importante “trattamento eziologico e delle comorbidità CV e non CV”, ed in particolare nei pazienti con ipertensione arteriosa, fibrillazione atriale e cardiopatia ischemica.
Nell’Emperor Preserved la prescrizione di farmaci antineurormonali è stata la più elevata (inibitori del SRA 81%, beta-bloccanti 86%, antialdosteronici 37%) (63), pur non al livello di prescrizione dell’HFrEF, ma superiore a quella dello studio Deliver (64).
Nell’Osservatorio CV del Friuli-Venezia Giulia, su pazienti più anziani e multimorbidi, gli antagonisti neurormonali sono stati prescritti nell’HFpEF in una percentuale ridotta rispetto a HFrEF e HFmrEF (inibitori del SRA 67%, beta-bloccanti 74%, antialdosteronici 31%) (7).
Una delle novità delle ultime linee guida è stata il riposizionamento dei beta-bloccanti nel trattamento di prima linea dell’ipertensione con classe di raccomandazione IA, alla pari di ACE inibitori, sartani, calcio antagonisti e diuretici tiazidici (46). Se i beta-bloccanti di prima e seconda generazione (propranololo, atenololo and metoprololo) sono in grado di ridurre il rischio di stroke, SC ed eventi CV maggiori in modo paragonabile agli altri farmaci antipertensivi (con l’eccezione di un minore effetto preventivo sull’ictus), è anche vero che dimostrano una maggiore frequenza di effetti collaterali ed una minore persistenza in trattamento. Al contrario, il nebivololo, beta-bloccante con elevata selettività b1 e vasodilatazione mediata da un aumentato rilascio di ossido nitrico, ha dimostrato un profilo di tollerabilità più favorevole, incluso sulla sfera sessuale (65). In uno studio di popolazione, non sono state registrate differenze significative sugli outcomes CV tra i 118.133 pazienti trattati con nebivololo o carvedilolo e 267.891 pazienti trattati con atenololo (66), mentre in un altro studio, l’utilizzo del nebivololo si è associato ad una maggiore protezione CV, in confronto ad atenololo o metoprololo (67). Non ci sono tuttavia trial di outcome in pazienti ipertesi trattati con beta-bloccanti con attività di vasodilatazione.
Nella cardiopatia ischemica (68) i beta-bloccanti hanno una azione antischemica e permettono di ridurre la FC a riposo a 55-60 bpm. In pazienti con pregresso infarto miocardico e HFrEF, l’uso dei beta-bloccanti è convincentemente associato ad una riduzione della mortalità e/o degli eventi CV. Tuttavia, nell’epoca attuale, caratterizzata da una elevata proporzione di pazienti con infarto miocardico rivascolarizzati precocemente con bassa probabilità di HFrEF, c’è una carenza di trial randomizzati e controllati e l’effetto protettivo dei beta-bloccanti è meno chiaro (69,70).
Infine, i beta-bloccanti sono raccomandati dalle linee guida europee sulla fibrillazione atriale (71) come terapia di prima linea, nel controllo della FC e, con minori evidenze, per il controllo del ritmo, in associazione ai farmaci antiaritmici, in particolare nei pazienti in cui la fibrillazione atriale si associa a ipertensione e/o SC, indipendentemente dalla FE.
Un ultimo aspetto riguarda il valore prognostico della FC e la possibilità che il paziente con HFpEF, spesso anziano e multimorbido, trattato con beta-bloccanti, possa subire un effetto negativo sulla sua sintomatologia per la loro azione sulla competenza cronotropa. Una FC elevata (> 80 bpm), comune nell’ipertensione per l’attivazione simpatica ed associata ad una mortalità più elevata (72), è probabilmente alla base del reinserimento della terapia betabloccante tra i farmaci di prima linea nell’ipertensione (73).
Una associazione tra mortalità e frequenza cardiaca è stata osservata anche nella cardiopatia ischemica. Oba et al. hanno dimostrato che in pazienti giapponesi con malattia coronarica una FC ≥ 75 bpm era indipendentemente associata ad una maggiore frequenza di eventi CV e cerebrovascolari maggiori (74).
Discorso parzialmente diverso va fatto per la fibrillazione atriale. Come detto, da un lato i beta-bloccanti sono fortemente raccomandati per migliorare la qualità della vita e ridurre il rischio di cardiomiopatia indotta da tachicardia. Dall’altro le linee guida sottolineano che il valore prognostico della FC e del suo controllo nella fibrillazione atriale non è così critico come nel ritmo sinusale. Di conseguenza l’uso dei beta-bloccanti è raccomandato ma con un target prudenziale di FC < 110 bpm.
5. Ruolo dei beta-bloccanti
I beta-bloccanti rappresentano un pilastro irrinunciabile nel trattamento dello HFrEF. Numerosi studi randomizzati controllati hanno infatti dimostrato l’efficacia dei beta-bloccanti, in associazione alle altre classi farmacologiche indicate, nel ridurre mortalità e morbilità nel paziente con HFrEF. In particolare, la riduzione del rischio assoluto di mortalità è stata rispettivamente del 5,5% con il bisoprololo, del 4,6% con il carvedilolo, del 4,5% con il metoprololo, e del 2,2% con il nebivololo (43,75–77). La minore riduzione della mortalità riscontrata nei pazienti trattati con nebivololo sembrerebbe associata all’età più avanzata dei pazienti inclusi nello studio specifico con un possibile impatto delle comorbilità presenti sugli obiettivi dello studio, ed all’arruolamento di circa 1/3 dei pazienti con FE VS > 35% (77). L’utilizzo dei beta-bloccanti è anche associato ad una significativa riduzione della morte improvvisa nel paziente con HFrEF. In generale, gli effetti dei beta-bloccanti nei pazienti con SC sembrerebbero essere maggiori nei pazienti in ritmo sinusale rispetto a quelli con fibrillazione atriale (78).
L’efficacia sulla mortalità per ogni causa è stata inoltre confermata anche per i pazienti con HFmrEF (41-49%) ma non per quelli con HFpEF (78). Bisogna però sottolineare che in quest’ultimo caso una percentuale rilevante di pazienti dovrebbe essere comunque trattata con beta-bloccanti per la presenza di comorbidità quali ad esempio pregressi eventi ischemici miocardici, fibrillazione atriale ad elevata FC e ipertensione arteriosa. Anche in questi pazienti, infatti, una riduzione della FC legata alla terapia beta-bloccante è stata associata ad un minor rischio di ospedalizzazione per cause CV e dell’end point combinato di ospedalizzazioni/mortalità CV (Figura 7) (78). Ad esempio, nello studio di Nodari et al. in 30 pazienti con ipertensione arteriosa e HFpEF trattati con nebivololo o atenololo, solo il primo ha migliorato significativamente la tolleranza allo sforzo, la funzione diastolica ed i parametri emodinamici (aumento della gittata sistolica, mantenimento dell’indice cardiaco, riduzione della pressione capillare polmonare e delle resistenze periferiche) (79).
Nelle ultime linee guida europee sullo SC i beta-bloccanti sono raccomandati in Classe IIB nei pazienti con HFmrEF. Nei pazienti con HFpEF trovano invece indicazione per il trattamento delle comorbidità CV e non (Classe I) (Figura 8) (3).
Tuttavia, uno studio pubblicato nel 2024 ha dimostrato che l’utilizzo di beta-bloccanti è associato ad un rischio inferiore per il composito primario di eventi cardiaci avversi, come il peggioramento dello scompenso cardiaco o la morte cardiovascolare, in pazienti con HFmrEF o HFpEF (62). Questa associazione è rimasta significativa anche dopo l’aggiustamento per variabili demografiche e prognostiche iniziali e in analisi di sensibilità. Inoltre, l’effetto benefico dei beta-bloccanti non è stato influenzato dalla FE VS.
La terapia con beta-bloccanti dovrebbe essere iniziata nei pazienti emodinamicamente stabili, ad un basso dosaggio e gradualmente aumentata fino al raggiungimento del massimo dosaggio tollerato, idealmente corrispondente al dosaggio target definito dagli studi randomizzati e controllati (Tabella 3) (3,80).
Va sottolineato, tuttavia, che anche l’utilizzo di basse dosi iniziali del farmaco ha comunque dimostrato un effetto benefico sul tasso di mortalità e di ospedalizzazione a 30 giorni dalla randomizzazione (81). La titolazione del dosaggio della terapia con beta-bloccanti (bisoprololo, carvedilolo, nebivololo, metoprololo) che hanno indicazione nello SC, si effettua tenendo conto di FC target, pressione arteriosa e tollerabilità. Il raggiungimento di una FC < 70 bpm (e > 50 bpm) può essere considerato l’obiettivo target della terapia con beta-bloccanti nel paziente in ritmo sinusale. La FC rappresenta il principale fattore da monitorare durante la terapia con beta-bloccanti insieme ai valori di pressione arteriosa e alla tollerabilità clinica del farmaco (ad esempio, la comparsa di sintomi o di altri effetti collaterali). È stato peraltro dimostrato come la riduzione della FC, e non il dosaggio totale di beta-bloccante somministrato, sia correlata in maniera direttamente proporzionale alla riduzione della mortalità (82).
Va ricordato in particolare che i beta-bloccanti non sono tutti ugualmente tollerati nei pazienti anziani, che rappresentano la più ampia quota di pazienti con HFpEF, per cui è necessario personalizzare l’intervento terapeutico in termini di tollerabilità e titolazione del farmaco. L’età del paziente deve essere tenuta in considerazione in quanto si è dimostrata essere un fattore significativamente associato al mancato raggiungimento del target terapeutico. In questo contesto, le maggiori evidenze sono a favore del nebivololo sia in HFrEF che in HFmrEF (83). Dal punto di vista clinico, in categorie particolari di pazienti (ad esempio anziani, con BPCO) la maneggevolezza del dosaggio, la possibilità di mono-somministrazione e la selettività per i recettori b1 (metoprololo, bisoprololo, nebivololo) vanno tenute in considerazione.
In conclusione, i beta-bloccanti giocano un ruolo fondamentale nella gestione terapeutica del paziente con SC indipendentemente dalla FE VS in quanto associati ad un considerevole miglioramento clinico e ad una sostanziale riduzione della mortalità e morbilità. La titolazione graduale del beta-bloccante è un procedimento fondamentale per assicurare l’aderenza alla terapia e ridurre la possibile insorgenza di effetti collaterali, soprattutto nei pazienti anziani e con particolari comorbidità.
6. I Beta-bloccanti non sono tutti uguali: il ruolo del nebivololo
La grande famiglia dei beta-bloccanti è composta da molte molecole con caratteristiche fra loro diverse. Questo comporta nella ricerca del miglior risultato clinico di scegliere la molecola più adatta per quel determinato paziente e quindi di conoscere a fondo sia la farmacologia dei vari beta-bloccanti disponibili che la fisiopatologia del nostro paziente. Purtroppo, studi di comparazione fra i vari beta-bloccanti nelle diverse patologie in cui i beta-bloccanti sono raccomandati sono pochissimi e quindi il processo di accoppiamento farmaco-paziente è per lo più induttivo e lasciato alla buona volontà del medico e viene raramente applicato in clinica.
Il nebivololo è indicato nel trattamento della ipertensione arteriosa e dello SC cronico stabile di grado lieve e moderato in aggiunta alle terapie standard in pazienti anziani di età ≥ 70 anni. Insieme a carvedilolo, metoprololo e bisoprololo è il quarto beta-bloccante per il quale è stata provata l’efficacia clinica. Per quanto concerne il nebivololo, lo studio SENIORS ha dimostrato in una popolazione di pazienti anziani con SC cronico di ridurre l’endpoint primario combinato di mortalità per tutte le cause e i ricoveri per cause cardiovascolari rispetto al placebo con una diminuzione del rischio relativo del 14% (77,84).
Il nebivololo è un beta-bloccante dotato di rilevante b1 selettività ed ha la caratteristica unica fra i beta-boccanti di liberare nitrossido. La rilevante b1 selettività, la più alta tra i beta-bloccanti di generazioni precedenti che si possono prescrivere nello SC comporta l’assenza del blocco dei b2 recettori presenti sulle cellule alveolari, sia di tipo 1 che di tipo 2, dove i b2 recettori stimolano varie pompe ioniche o canali ionici la cui azione è di ridurre la quantità di fluidi presenti sugli alveoli. Questo permette una più rapida risoluzione dell’edema polmonare ed un miglior mantenimento della omeostasi dei fluidi intratoracici, entrambe condizioni molto importanti nello SC. Questa informazione è misurabile in termini di diffusione alveolo-capillare del monossido di carbonio (DLCO) che è minore quando si utilizza un beta-bloccante che agisce su entrambi i b1 e b2 recettori rispetto ad un beta-bloccante b1-selettivo. Un altro aspetto è che l’assenza di azione sui b2 recettori comporta un minor o assente effetto sulla regolazione riflessa della ventilazione che è una delle cause principali della iperventilazione nello SC. Quest’ultima è associata ad aumento della mortalità ed alla gravità dello scompenso stesso. Lo studio CARNEBI ha dimostrato la diversa attivazione dei chemorettori periferici per ossigeno e centrali per anidride carbolica in pazienti con SC trattati con bisoprololo, carvedilolo e nebivololo (Tabella 4) (85). Fra i 3, il nebivololo ha una situazione intermedia.
Da un punto di vista pratico, considerando sia gli effetti sulla diffusione alveolo-capillare che quelli sui chemorecettori, è stato proposto uno schema per la scelta del beta-bloccante più adatto nel paziente con SC dove il nebivololo risulta tra i preferibili in caso di paziente anziano con DLCO normale o in tutti i casi di paziente con DLCO ridotta (Figura 9) (86).
La liberazione di nitrossido è, tra i farmaci beta-bloccanti, presente solo nel nebivololo. Questa è una caratteristica unica che si associa ad una preservata funzione endoteliale. Una ipotesi di lavoro potrebbe essere l’utilizzo del nebivololo in soggetti di genere femminile in menopausa che necessitano di terapia betabloccante, in considerazione della fisiologica riduzione del nitrossido tissutale, del progressivo degradamento della funzione endoteliale e dell’incremento dello stress ossidativo e dell’overdrive adrenergico (87,88). Questo approccio è molto attuale in considerazione del ruolo che lo stress ossidativo ha nella pressoché totalità delle patologie CV acquisite. Un’altra ipotesi di lavoro potrebbe anche riguardare il trattamento dell’ipertensione polmonare in considerazione dell’effetto sull’ endotelio e sulla cessione di ossigeno in periferia, come suggerito da alcuni esperti (89).
Inoltre, rispetto a molti altri beta-bloccanti il nebivololo ha un minore effetto cronotropo negativo cosicché il suo uso si associa raramente a frequenze cardiache molto basse che tanto, ed a volte inutilmente, spaventano i pazienti e gli operatori sanitari. Da notare che la riduzione ancorché lieve della FC a riposo e di quella al picco dell’esercizio fanno sì che l’incremento della FC durante esercizio sia mantenuto. A questo proposito, nei pazienti con SC cronico, quando trattati con nebivololo, la capacità di esercizio è simile a quella ottenuta con bisoprololo e superiore a quella osservata con carvedilolo (85).
L’insieme di queste caratteristiche farmacologiche, e cioè la b1 selettività che permette di preservare lo scambio dei gas a livello della barriera alveolo-capillare, la limitata interferenza con i chemorecettori centrali e periferici, la possibilità di somministrarlo in caso di bronchite cronica, la capacità di liberare nitrossido e la conseguente preservata funzione endoteliale ed il ridotto effetto cronotropo negativo fanno sì che il nebivololo possa essere definito un beta-bloccante con caratteristiche di particolare interesse sia per la sua particolare efficacia che per la sua tollerabilità.
Bibliografia
- Becher PM, Lund LH, Coats AJS, Savarese G. An update on global epidemiology in heart failure. Eur Heart J. 2022 Aug 21;43(32):3005–7.
- Bozkurt B, Ahmad T, Alexander KM, Baker WL, Bosak K, Breathett K, et al. Heart Failure Epidemiology and Outcomes Statistics: A Report of the Heart Failure Society of America. J Card Fail. 2023 Oct;29(10):1412–51.
- McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Böhm M, et al. 2023 Focused Update of the 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2023 Oct 1;44(37):3627–39.
- Najafi F, Jamrozik K, Dobson AJ. Understanding the ‘epidemic of heart failure’: a systematic review of trends in determinants of heart failure. Eur J Heart Fail. 2009 May 22;11(5):472–9.
- Vaduganathan M, Claggett BL, Jhund PS, Cunningham JW, Pedro Ferreira J, Zannad F, et al. Estimating lifetime benefits of comprehensive disease-modifying pharmacological therapies in patients with heart failure with reduced ejection fraction: a comparative analysis of three randomised controlled trials. The Lancet. 2020 Jul;396(10244):121–8.
- Gori M, Marini M, De Maria R, Gonzini L, Gorini M, Cassaniti L, et al. Age-related changes in clinical characteristics and outcomes of chronic heart failure outpatients in a cardiology setting. A report from the Italian Network on Heart Failure. Int J Cardiol. 2022 Jan;346:36–44.
- Di Lenarda A, Cittar M, Cappelletto C, et al. Dai trial al mondo reale: uno sguardo all’HFpEF dall’Osservatorio Cardiovascolare del Friuli-Venezia Giulia. G Ital Cardiol 2024 submitted.
- Butler J, Usman MS, Anstrom KJ, Blaustein RO, Bonaca MP, Ezekowitz JA, et al. Soluble guanylate cyclase stimulators in patients with heart failure with reduced ejection fraction across the risk spectrum. Eur J Heart Fail. 2022 Nov 16;24(11):2029–36.
- Hessel FP. Overview of the socio-economic consequences of heart failure. Cardiovasc Diagn Ther. 2021 Feb;11(1):254–62.
- Programma Nazionale Esiti. Edizione 2023. [Internet]. [cited 2024 Jan 15]. Available from: https://pne.agenas.it/ospedaliera/indicatori?noso=cardiovascolare&cond=scompenso%20cardiaco
- Mamas MA, Sperrin M, Watson MC, Coutts A, Wilde K, Burton C, et al. Do patients have worse outcomes in heart failure than in cancer? A primary care‐based cohort study with 10‐year follow‐up in Scotland. Eur J Heart Fail. 2017 Sep 3;19(9):1095–104.
- Remme WJ, McMurray JJV, Rauch B, Zannad F, Keukelaar K, Cohen-Solal A, et al. Public awareness of heart failure in Europe: first results from SHAPE. Eur Heart J. 2005 Nov 1;26(22):2413–21.
- Bozkurt B, Coats AJ, Tsutsui H, et al. Universal Definition and Classification of Heart Failure: A Report of the Heart Failure Society of America, Heart Failure Association of the European Society of Cardiology, Japanese Heart Failure Society and Writing Committee of the Universal Definition of Heart Failure. J Card Fail 2021:S1071-9164(21)00050-6.
- Vasan RS, Xanthakis V, Lyass A, Andersson C, Tsao C, Cheng S, et al. Epidemiology of Left Ventricular Systolic Dysfunction and Heart Failure in the Framingham Study. JACC Cardiovasc Imaging. 2018 Jan;11(1):1–11.
- Simmonds SJ, Cuijpers I, Heymans S, Jones EA V. Cellular and Molecular Differences between HFpEF and HFrEF: A Step Ahead in an Improved Pathological Understanding. Cells. 2020 Jan 18;9(1):242.
- Khan MS, Samman Tahhan A, Vaduganathan M, Greene SJ, Alrohaibani A, Anker SD, et al. Trends in prevalence of comorbidities in heart failure clinical trials. Eur J Heart Fail. 2020 Jun 15;22(6):1032–42.
- Desai AS, Jhund PS, Claggett BL, Vaduganathan M, Miao ZM, Kondo T, et al. Effect of Dapagliflozin on Cause-Specific Mortality in Patients With Heart Failure Across the Spectrum of Ejection Fraction: A Participant-Level Pooled Analysis of DAPA-HF and DELIVER. JAMA Cardiol. 2022 Dec 1;7(12):1227–34.
- Mentz RJ, Felker GM. Noncardiac Comorbidities and Acute Heart Failure Patients. Heart Fail Clin. 2013 Jul;9(3):359–67.
- Moser M, Hebert PR. Prevention of disease progression, left ventricular hypertrophy and congestive heart failure in hypertension treatment trials. J Am Coll Cardiol. 1996 Apr;27(5):1214–8.
- Yusuf S, Hawken S, Ounpuu S, Dans T, Avezum A, Lanas F, et al. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case-control study. Lancet. 364(9438):937–52.
- Frohlich ED, Apstein C, Chobanian A V, Devereux RB, Dustan HP, Dzau V, et al. The heart in hypertension. N Engl J Med. 1992 Oct 1;327(14):998–1008.
- Agno FS, Chinali M, Bella JN, Liu JE, Arnett DK, Kitzman DW, et al. Aortic valve sclerosis is associated with preclinical cardiovascular disease in hypertensive adults: the Hypertension Genetic Epidemiology Network study. J Hypertens. 2005 Apr;23(4):867–73.
- Kannel WB. Incidence and epidemiology of heart failure. Heart Fail Rev. 2000 Jun;5(2):167–73.
- Kenchaiah S, Narula J, Vasan RS. Risk factors for heart failure. Med Clin North Am. 2004 Sep;88(5):1145–72.
- Mahmood SS, Wang TJ. The epidemiology of congestive heart failure: the Framingham Heart Study perspective. Glob Heart. 2013 Mar 1;8(1):77–82.
- Tocci G, Sciarretta S, Volpe M. Development of heart failure in recent hypertension trials. J Hypertens. 2008 Jul;26(7):1477–86.
- Campbell RT, Jhund PS, Castagno D, Hawkins NM, Petrie MC, McMurray JJ V. What have we learned about patients with heart failure and preserved ejection fraction from DIG-PEF, CHARM-preserved, and I-PRESERVE? J Am Coll Cardiol. 2012 Dec 11;60(23):2349–56.
- Drazner MH. The progression of hypertensive heart disease. Circulation. 2011 Jan 25;123(3):327–34.
- Giampietri C, Petrungaro S, Musumeci M, Coluccia P, Antonangeli F, De Cesaris P, et al. c-Flip overexpression reduces cardiac hypertrophy in response to pressure overload. J Hypertens. 2008 May;26(5):1008–16.
- Díez J, González A, López B, Querejeta R. Mechanisms of disease: pathologic structural remodeling is more than adaptive hypertrophy in hypertensive heart disease. Nat Clin Pract Cardiovasc Med. 2005 Apr;2(4):209–16.
- López B, González A, Querejeta R, Larman M, Díez J. Alterations in the pattern of collagen deposition may contribute to the deterioration of systolic function in hypertensive patients with heart failure. J Am Coll Cardiol. 2006 Jul 4;48(1):89–96.
- López B, Querejeta R, González A, Larman M, Díez J. Collagen cross-linking but not collagen amount associates with elevated filling pressures in hypertensive patients with stage C heart failure: potential role of lysyl oxidase. Hypertension. 2012 Sep;60(3):677–83.
- Díez J. Arterial hypertension in patients with heart failure. Heart Fail Clin. 2014 Apr;10(2):233–42.
- Steeds RP. Multimodality imaging in heart failure patients. Curr Opin Cardiol. 2013 Mar;28(2):209–15.
- Pozzoli M, Traversi E, Cioffi G, Stenner R, Sanarico M, Tavazzi L. Loading manipulations improve the prognostic value of Doppler evaluation of mitral flow in patients with chronic heart failure. Circulation. 1997 Mar 4;95(5):1222–30.
- Giannuzzi P, Temporelli PL, Bosimini E, Silva P, Imparato A, Corrà U, et al. Independent and incremental prognostic value of Doppler-derived mitral deceleration time of early filling in both symptomatic and asymptomatic patients with left ventricular dysfunction. J Am Coll Cardiol. 1996 Aug;28(2):383–90.
- Ohtani T, Mohammed SF, Yamamoto K, Dunlay SM, Weston SA, Sakata Y, et al. Diastolic stiffness as assessed by diastolic wall strain is associated with adverse remodelling and poor outcomes in heart failure with preserved ejection fraction. Eur Heart J. 2012 Jul;33(14):1742–9.
- Armstrong AC, Gidding S, Gjesdal O, Wu C, Bluemke DA, Lima JAC. LV mass assessed by echocardiography and CMR, cardiovascular outcomes, and medical practice. JACC Cardiovasc Imaging. 2012 Aug;5(8):837–48.
- Georgiopoulou V V, Kalogeropoulos AP, Butler J. Heart failure in hypertension: prevention and treatment. Drugs. 2012 Jul 9;72(10):1373–98.
- Sciarretta S, Palano F, Tocci G, Baldini R, Volpe M. Antihypertensive treatment and development of heart failure in hypertension: a Bayesian network meta-analysis of studies in patients with hypertension and high cardiovascular risk. Arch Intern Med. 2011 Mar 14;171(5):384–94.
- CONSENSUS Trial Study Group. Effects of enalapril on mortality in severe congestive heart failure. Results of the Cooperative North Scandinavian Enalapril Survival Study (CONSENSUS). N Engl J Med. 1987 Jun 4;316(23):1429–35.
- SOLVD Investigators, Yusuf S, Pitt B, Davis CE, Hood WB, Cohn JN. Effect of enalapril on survival in patients with reduced left ventricular ejection fractions and congestive heart failure. N Engl J Med. 1991 Aug 1;325(5):293–302.
- Packer M, Bristow MR, Cohn JN, Colucci WS, Fowler MB, Gilbert EM, et al. The effect of carvedilol on morbidity and mortality in patients with chronic heart failure. U.S. Carvedilol Heart Failure Study Group. N Engl J Med. 1996 May 23;334(21):1349–55.
- Brophy JM, Joseph L, Rouleau JL. Beta-blockers in congestive heart failure. A Bayesian meta-analysis. Ann Intern Med. 2001 Apr 3;134(7):550–60.
- McMurray JJ V, Adamopoulos S, Anker SD, Auricchio A, Böhm M, Dickstein K, et al. ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail. 2012 Aug;14(8):803–69.
- Mancia G, Kreutz R, Brunström M, Burnier M, Grassi G, Januszewicz A, et al. 2023 ESH Guidelines for the management of arterial hypertension The Task Force for the management of arterial hypertension of the European Society of Hypertension: Endorsed by the International Society of Hypertension (ISH) and the European Renal Association (ERA). J Hypertens. 2023 Dec 1;41(12):1874–2071.
- Czuriga I, Riecansky I, Bodnar J, Fulop T, Kruzsicz V, Kristof E, et al. Comparison of the new cardioselective beta-blocker nebivolol with bisoprolol in hypertension: the Nebivolol, Bisoprolol Multicenter Study (NEBIS). Cardiovasc Drugs Ther. 2003 May;17(3):257–63.
- Sorrentino SA, Doerries C, Manes C, Speer T, Dessy C, Lobysheva I, et al. Nebivolol exerts beneficial effects on endothelial function, early endothelial progenitor cells, myocardial neovascularization, and left ventricular dysfunction early after myocardial infarction beyond conventional β1-blockade. J Am Coll Cardiol. 2011 Feb 1;57(5):601–11.
- Van Bortel LM, Fici F, Mascagni F. Efficacy and tolerability of nebivolol compared with other antihypertensive drugs: a meta-analysis. Am J Cardiovasc Drugs. 2008;8(1):35–44.
- Schmidt AC, Graf C, Brixius K, Scholze J. Blood pressure-lowering effect of nebivolol in hypertensive patients with type 2 diabetes mellitus: the YESTONO study. Clin Drug Investig. 2007;27(12):841–9.
- Borlaug BA. Evaluation and management of heart failure with preserved ejection fraction. Nat Rev Cardiol. 2020 Sep;17(9):559–73.
- Pfeffer MA, Shah AM, Borlaug BA. Heart Failure With Preserved Ejection Fraction In Perspective. Circ Res. 2019 May 24;124(11):1598–617.
- Shah SJ, Kitzman DW, Borlaug BA, van Heerebeek L, Zile MR, Kass DA, et al. Phenotype-Specific Treatment of Heart Failure With Preserved Ejection Fraction: A Multiorgan Roadmap. Circulation. 2016 Jul 5;134(1):73–90.
- Heidenreich PA, Bozkurt B, Aguilar D, Allen LA, Byun JJ, Colvin MM, et al. 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure: Executive Summary: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2022 May 3;145(18):e876–94.
- Lüscher TF. Lumpers and splitters: the bumpy road to precision medicine. Eur Heart J. 2019 Oct 21;40(40):3292–6.
- Ho JE, Zern EK, Wooster L, Bailey CS, Cunningham T, Eisman AS, et al. Differential Clinical Profiles, Exercise Responses, and Outcomes Associated With Existing HFpEF Definitions. Circulation. 2019 Jul 30;140(5):353–65.
- Eisman AS, Shah R V, Dhakal BP, Pappagianopoulos PP, Wooster L, Bailey C, et al. Pulmonary Capillary Wedge Pressure Patterns During Exercise Predict Exercise Capacity and Incident Heart Failure. Circ Heart Fail. 2018 May;11(5):e004750.
- Dorfs S, Zeh W, Hochholzer W, Jander N, Kienzle RP, Pieske B, et al. Pulmonary capillary wedge pressure during exercise and long-term mortality in patients with suspected heart failure with preserved ejection fraction. Eur Heart J. 2014 Nov 21;35(44):3103–12.
- Castiglione V, Aimo A, Vergaro G, Saccaro L, Passino C, Emdin M. Biomarkers for the diagnosis and management of heart failure. Heart Fail Rev. 2022 Mar;27(2):625–43.
- Albani S, Zilio F, Scicchitano P, Musella F, Ceriello L, Marini M, et al. Comprehensive diagnostic workup in patients with suspected heart failure and preserved ejection fraction. Hellenic J of Cardiology 2023 Sep 22:S1109-9666(23)00184-7.
- Ahmad T, Desai NR, Januzzi JL. Heart Failure With Preserved Ejection Fraction. JACC Heart Fail. 2020 Mar;8(3):185–7.
- Peikert A, Bart BA, Vaduganathan M, Claggett BL, Kulac IJ, Kosiborod MN, et al. Contemporary Use and Implications of Beta-Blockers in Patients With HFmrEF or HFpEF. JACC Heart Fail. 2024 Apr;12(4):631–44.
- Anker SD, Butler J, Filippatos G, Shahzeb Khan M, Ferreira JP, Bocchi E, et al. Baseline characteristics of patients with heart failure with preserved ejection fraction in the EMPEROR‐Preserved trial. Eur J Heart Fail. 2020 Dec 8;22(12):2383–92.
- Solomon SD, Vaduganathan M, Claggett BL, de Boer RA, DeMets D, Hernandez AF, et al. Baseline Characteristics of Patients With HF With Mildly Reduced and Preserved Ejection Fraction. JACC Heart Fail. 2022 Mar;10(3):184–97.
- Brixius K, Middeke M, Lichtenthal A, Jahn E, Schwinger RHG. Nitric oxide, erectile dysfunction and beta-blocker treatment (MR NOED study): benefit of nebivolol versus metoprolol in hypertensive men. Clin Exp Pharmacol Physiol. 2007 Apr;34(4):327–31.
- Chan You S, Krumholz HM, Suchard MA, Schuemie MJ, Hripcsak G, Chen R, et al. Comprehensive Comparative Effectiveness and Safety of First-Line β-Blocker Monotherapy in Hypertensive Patients: A Large-Scale Multicenter Observational Study. Hypertension. 2021 May 5;77(5):1528–38.
- Huck DM, Rosenberg MA, Stauffer BL. Nebivolol and incident cardiovascular events in hypertensive patients compared with nonvasodilatory beta blockers. J Hypertens. 2022 May 1;40(5):1019–29.
- Knuuti J, Wijns W, Saraste A, Capodanno D, Barbato E, Funck-Brentano C, et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J. 2020 Jan 14;41(3):407–77.
- Dahl Aarvik M, Sandven I, Dondo TB, Gale CP, Ruddox V, Munkhaugen J, et al. Effect of oral β-blocker treatment on mortality in contemporary post-myocardial infarction patients: a systematic review and meta-analysis. Eur Heart J Cardiovasc Pharmacother. 2019 Jan 1;5(1):12–20.
- Misumida N, Harjai K, Kernis S, Kanei Y. Does Oral Beta-Blocker Therapy Improve Long-Term Survival in ST-Segment Elevation Myocardial Infarction With Preserved Systolic Function? A Meta-Analysis. J Cardiovasc Pharmacol Ther. 2016 May;21(3):280–5.
- Hindricks G, Potpara T, Dagres N, Arbelo E, Bax JJ, Blomström-Lundqvist C, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2021 Feb 1;42(5):373–498.
- Gillman MW, Kannel WB, Belanger A, D’Agostino RB. Influence of heart rate on mortality among persons with hypertension: the Framingham Study. Am Heart J. 1993 Apr;125(4):1148–54.
- Esler M, Kjeldsen SE, Pathak A, Grassi G, Kreutz R, Mancia G. Diverse pharmacological properties, trial results, comorbidity prescribing and neural pathophysiology suggest European hypertension guideline downgrading of beta-blockers is not justified. Blood Press. 2022 Dec 31;31(1):210–24.
- Oba Y, Kabutoya T, Kohro T, Imai Y, Kario K, Sato H, et al. Relationships Among Heart Rate, β-Blocker Dosage, and Prognosis in Patients With Coronary Artery Disease in a Real-World Database Using a Multimodal Data Acquisition System. Circ J. 2023 Jan 25;87(2):336–44.
- Effect of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL Randomised Intervention Trial in Congestive Heart Failure (MERIT-HF). Lancet. 1999 Jun 12;353(9169):2001–7.
- The Cardiac Insufficiency Bisoprolol Study II (CIBIS-II): a randomised trial. Lancet. 1999 Jan 2;353(9146):9–13.
- Flather MD, Shibata MC, Coats AJS, Van Veldhuisen DJ, Parkhomenko A, Borbola J, et al. Randomized trial to determine the effect of nebivolol on mortality and cardiovascular hospital admission in elderly patients with heart failure (SENIORS). Eur Heart J. 2005 Feb;26(3):215–25.
- Cleland JGF, Bunting K V, Flather MD, Altman DG, Holmes J, Coats AJS, et al. Beta-blockers for heart failure with reduced, mid-range, and preserved ejection fraction: an individual patient-level analysis of double-blind randomized trials. Eur Heart J. 2018 Jan 1;39(1):26–35.
- Nodari S, Metra M, Dei Cas L. Beta-blocker treatment of patients with diastolic heart failure and arterial hypertension. A prospective, randomized, comparison of the long-term effects of atenolol vs. nebivolol. Eur J Heart Fail. 2003 Oct;5(5):621–7.
- Swedberg K, Cleland J, Dargie H, Drexler H, Follath F, Komajda M, et al. Guidelines for the diagnosis and treatment of chronic heart failure: executive summary (update 2005): The Task Force for the Diagnosis and Treatment of Chronic Heart Failure of the European Society of Cardiology. Eur Heart J. 2005 Jun;26(11):1115–40.
- Packer M, McMurray JJ V. Rapid evidence-based sequencing of foundational drugs for heart failure and a reduced ejection fraction. Eur J Heart Fail. 2021 Jun;23(6):882–94.
- McAlister FA, Wiebe N, Ezekowitz JA, Leung AA, Armstrong PW. Meta-analysis: beta-blocker dose, heart rate reduction, and death in patients with heart failure. Ann Intern Med. 2009 Jun 2;150(11):784–94.
- van Veldhuisen DJ, Cohen-Solal A, Böhm M, Anker SD, Babalis D, Roughton M, et al. Beta-blockade with nebivolol in elderly heart failure patients with impaired and preserved left ventricular ejection fraction: Data From SENIORS (Study of Effects of Nebivolol Intervention on Outcomes and Rehospitalization in Seniors With Heart Failure). J Am Coll Cardiol. 2009 Jun 9;53(23):2150–8.
- Tavazzi L. Il trial SENIORS nel contesto della terapia dello scompenso cardiaco nel paziente anziano. G Gerontol 2005;53:248-252.
- Contini M, Apostolo A, Cattadori G, Paolillo S, Iorio A, Bertella E, et al. Multiparametric comparison of CARvedilol, vs. NEbivolol, vs. BIsoprolol in moderate heart failure: the CARNEBI trial. Int J Cardiol. 2013 Oct 3;168(3):2134–40.
- Sinagra G, Corrà U, Contini M, Magrì D, Paolillo S, Perrone Filardi P, et al. Choosing among β-blockers in heart failure patients according to β-receptors’ location and functions in the cardiopulmonary system. Pharmacol Res. 2020 Jun;156:104785.
- Sciomer S, De Carlo C, Moscucci F, Maffei S. Age at menopause: A fundamental data of interest to acquire in female patients’ anamnesis. Int J Cardiol. 2016 Jul 15;215:358–9.
- Sciomer S, Moscucci F, Maffei S, Gallina S, Mattioli A V. Prevention of cardiovascular risk factors in women: The lifestyle paradox and stereotypes we need to defeat. Eur J Prev Cardiol. 2019 Apr;26(6):609–10.
- Badagliacca R, Mercurio V, Romeo E, Correale M, Masarone D, Papa S, et al. Beta-blockers in pulmonary arterial hypertension: Time for a second thought? Vascul Pharmacol. 2022 Jun;144:106974.
Related papers
Lo scenario della medicina attuale è caratterizzato da elementi di complessità generale inimmaginabili due decenni fa ed in grado di rendere molto più difficile la pratica clinica giornaliera. In particolare, la coesistenza di multiple condizioni passibili di un trattamento farmacologico nello stesso soggetto condiziona in maniera forzata alcune delle scelte terapeutiche spingendo alla ricerca di [more info]
Premessa Nell’ultimo decennio l’orizzonte della terapia ipolipemizzante si è arricchita di formidabili strumenti terapeutici quali ezitimibe, inibitori della proteina PCSK9 (PCSK9i) e acido bempedoico. Gli studi su queste molecole hanno permesso non solo di dimostrarne l’efficacia, ma hanno fornito importanti informazioni sull’importanza dell’abbassamento delle LDL nella riduzione del rischio cardiovascolare (CV) e costituiscono la base [more info]
Colesterolemia subottimale come fattore di rischio per le malattie cardiovascolari Il miglioramento delle abitudini alimentari e l’ottimizzazione dei livelli di colesterolo LDL nel sangue – fattore causale e cumulativo - sembrano essere strumenti efficaci per ridurre il rischio di malattie cardiovascolari su base aterosclerotica, che ancora oggi rappresentano una delle principali cause di morte e [more info]