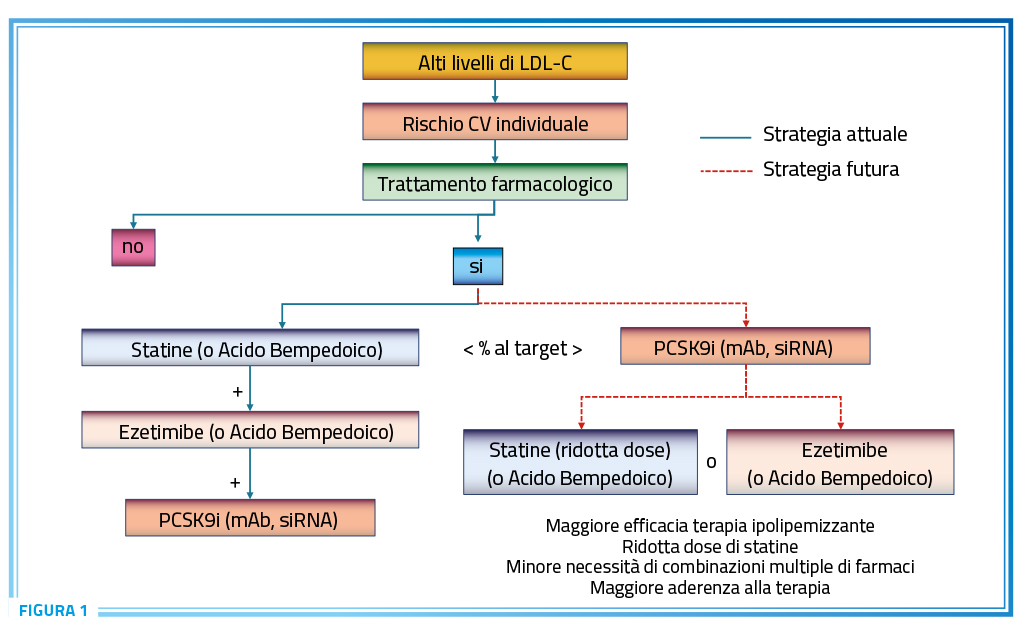
Il trattamento delle dislipidemie rappresenta uno dei cardini centrali della strategia di prevenzione cardiovascolare. La riduzione dei livelli di LDL-C determina una riduzione della incidenza di cardiopatia ischemica e ictus che risulta proporzionale sia alla riduzione dei livelli di colesterolo che alla concentrazione lipidica raggiunta in risposta al trattamento. In particolare la lettura cumulativa dei dati derivanti dagli studi clinici, ha dimostrato molto chiaramente come esista una correlazione lineare tra le modificazioni dei livelli di LDL-C e il rischio relativo di complicanze cardiovascolari maggiori secondo una logica lineare che può essere letta alla stregua di una funzione matematica in base alla quale, data la entità della risposta ipolipemizzante, è possibile derivare quale sarà l’impatto preventivo in termini di riduzione del rischio di cardiopatia ischemica o malattia cerebrovascolare. Su questa funzione lineare poggiano le raccomandazioni delle più recenti linee guida ESC-EAS che riportano in forma estremamente pratica quale siano le possibili strategie terapeutiche in grado di raggiungere i livelli di colesterolo adeguati per prevenire il rischio cardiovascolare a partire dal valore di base di LDL-C e del rischio cardiovascolare globale. In particolare, la acquisizione dei livelli lipidici corretti si basa sull’utilizzo nella maggior parte dei pazienti di combinazioni di farmaci ipolipemizzanti dotati di meccanismi d’azione diversi e complementari e per questo motivo in grado di promuovere una riduzione dei livelli di LDL-C che non potrebbero essere acquisiti con un singolo farmaco anche se utilizzato ad alte dosi. Tuttavia, nonostante gli innegabili risultati ottenuti da questa strategia, c’è un aspetto che si deve tenere in conto e che potrebbe indirizzare in una direzione diversa le modalità di approccio futuro al trattamento delle dislipidemie. La logica proposta dalle linee guida che vuole l’impiego iniziale di una statina di elevata potenza (o ac. bempedoico in caso di intolleranza) seguita dalla aggiunta di ezetimibe ed eventualmente di inibitori di PCSK) (alirocumab, evolocumab o inclisiran) è una logica derivata dai risultati dei trial clinici la cui base teorica e pratica è la logica di “add-on” ossia quella di individuare una terapia efficace di base (in questo caso le statine) e di procedere dimostrando come ogni aggiunta terapeutica alla strategia di base possa aggiungere un vantaggio ulteriore in termini di benefici clinici. Tuttavia, questo approccio sicuramente efficace non tiene conto di due aspetti fondamentali. Il primo è la risposta individuale che cambia da soggetto a soggetto con solo il 50% in media di rispondere alle statine o all’ezetimibe, mentre gli studi di waterfall plot dimostrano come il restante 50% presenti una risposta di modesta entità o addirittura un incremento paradosso dei livelli di LDL-C. Tutto questo dipende da alcuni aspetti del profilo genetico individuale che rendono alcuni soggetti iperresponsivi ad un certo tipo di farmaco (ad esempio iperespressione del target farmacologico di ezetimibe nei pazienti diabetici) e dalla attivazione di alcuni meccanismi di controregolazione finalizzati ad opporsi alla riduzione dei livelli di LDL-C come, ad esempio, il rilascio della proteina PCSK9. Questo implica che la applicazione del medesimo schema di terapia a tutti i soggetti con ipercolesterolemia potrebbe rivelarsi solo parzialmente efficace con una percentuale non trascurabile di pazienti che a fronte di uno schema terapeutico potenzialmente efficace, rispondano in maniera limitata all’atto pratico. Il secondo aspetto è la mancanza pressoché totale di studi che dimostrino quale dovrebbe essere la terapia iniziale a più ampio spettro di efficacia e come tale quella di introdurre come primo step nel trattamento delle dislipidemie al di là della logica di applicazione delle risultanze dirette dei trial che si basano solo su un effetto cronologico, il classico “fist come, first serve”. In questa logica sono oggi disponibili dati assai interessanti derivati da studi condotti con inbitori di PCSK9 sia anticorpi (evolocumab) sia siRNA (inclisiran) che dimostrano come la riduzione dei livelli di LDL-C con queste due classi di farmaci sia esattamente sovrapponibile sia nei pazienti trattati in contemporanea con statine, sia in coloro che non assumevano tali farmaci. Questi risultati dovrebbero essere considerati con grande attenzione perché percentuale di pazienti, la riduzione di LDL-C indotta da inibitori di PCSK9 possa includere nel suo meccanismo d’azione anche l’effetto ipolipemizzante delle statine o di ezetimibe probabilmente in ragione della supremazia del meccanismo di sintesi e rilascio della proteina PCSK9 nell’ambito del sistema di controregolazione alla base della efficacia solo parziale di statine ed ezetimibe (ad esempio la famosa “regole del 6” per cui ogni raddoppio della dose di statina produce solo un 6% di riduzione dei livelli di LDL-C). In pratica la inibizione iniziale di PCSK9 non solo migliorerebbe sostanzialmente il profilo lipidico di tutti coloro che presentano una iperespressione di tale meccanismo pro-colesterolomizzante, ma al tempo stesso rappresenterebbe la base affinché ulteriori aggiunte di farmaci in grado di influire favorevolmente sul profilo lipidico possano esplicare fino in fondo la loro efficacia nei confronti dei livelli di LDL-C senza vedere tarpata una quota consistente del potenziale beneficio del loro intervento (Figura 1). La contropartita di tutto ciò sarebbe naturalmente un aumento dei costi del trattamento (che però potrebbero diventare oggetto di negoziazione se i farmaci più moderni diventassero di prima scelta) ampiamente controbilanciata dalla maggiore efficacia della terapia, dalla potenzialità di impiego di dosi più contenute di statine, dalla minore necessità di ricorrere a terapie di combinazione e il miglioramento significativo della aderenza al trattamento stante le modalità di somministrazione dilatata dei farmaci iniettabili da 30-40 gg fino ai 6 mesi per inclisiran.
Questo atteggiamento naturalmente richiede un accordo tra i molti soggetti coinvolti nel trattamento delle dislipidemie sia a livello clinico che regolatorio, ma sarebbe una scelta rivoluzionaria, basata su quanto ci dicono la genetica e la farmacologia e non semplicemente la sequenza forzata degli studi clinici controllati, la cui capacità di intercettare le reali potenzialità delle diverse classi farmacologiche è spesso limitata dal dettato metodologico che ogni nuovo farmaco in un certo ambito deve dimostrare di aggiungere efficacia a quella dimostrata da quelli di uso corrente, mentre molto poco spazio è lasciato alla dimostrazione che il benefico corrente possa essere utilmente riassorbito con un ulteriore vantaggio dai nuovi farmaci che la ricerca giornalmente ci propone. Un esempio? Sacubitril-valsartan nella HFrEF se lo avessimo associato alla terapia esistente e consolidata in luogo di proporre un confronto testa a testa probabilmente oggi sarebbe rinchiuso in un cassetto e la sua storia limitata ad un paio di lavori sul New England Journal of Medicine, rivista sicuramente prestigiosa, ma del tutto incapace di migliorare la sopravvivenza e la qualità della vita dei pazienti. Ogni matassa ha due bandoli e non è detto che il primo che si individua sia quello che permetterà di riavvolgerla nel modo corretto.
Il trattamento delle dislipidemie rappresenta uno dei cardini centrali della strategia di prevenzione cardiovascolare. La riduzione dei livelli di LDL-C determina una riduzione della incidenza di cardiopatia ischemica e ictus che risulta proporzionale sia alla riduzione dei livelli di colesterolo che alla concentrazione lipidica raggiunta in risposta al trattamento. In particolare la lettura cumulativa dei dati derivanti dagli studi clinici, ha dimostrato molto chiaramente come esista una correlazione lineare tra le modificazioni dei livelli di LDL-C e il rischio relativo di complicanze cardiovascolari maggiori secondo una logica lineare che può essere letta alla stregua di una funzione matematica in base alla quale, data la entità della risposta ipolipemizzante, è possibile derivare quale sarà l’impatto preventivo in termini di riduzione del rischio di cardiopatia ischemica o malattia cerebrovascolare. Su questa funzione lineare poggiano le raccomandazioni delle più recenti linee guida ESC-EAS che riportano in forma estremamente pratica quale siano le possibili strategie terapeutiche in grado di raggiungere i livelli di colesterolo adeguati per prevenire il rischio cardiovascolare a partire dal valore di base di LDL-C e del rischio cardiovascolare globale. In particolare, la acquisizione dei livelli lipidici corretti si basa sull’utilizzo nella maggior parte dei pazienti di combinazioni di farmaci ipolipemizzanti dotati di meccanismi d’azione diversi e complementari e per questo motivo in grado di promuovere una riduzione dei livelli di LDL-C che non potrebbero essere acquisiti con un singolo farmaco anche se utilizzato ad alte dosi. Tuttavia, nonostante gli innegabili risultati ottenuti da questa strategia, c’è un aspetto che si deve tenere in conto e che potrebbe indirizzare in una direzione diversa le modalità di approccio futuro al trattamento delle dislipidemie. La logica proposta dalle linee guida che vuole l’impiego iniziale di una statina di elevata potenza (o ac. bempedoico in caso di intolleranza) seguita dalla aggiunta di ezetimibe ed eventualmente di inibitori di PCSK) (alirocumab, evolocumab o inclisiran) è una logica derivata dai risultati dei trial clinici la cui base teorica e pratica è la logica di “add-on” ossia quella di individuare una terapia efficace di base (in questo caso le statine) e di procedere dimostrando come ogni aggiunta terapeutica alla strategia di base possa aggiungere un vantaggio ulteriore in termini di benefici clinici. Tuttavia, questo approccio sicuramente efficace non tiene conto di due aspetti fondamentali. Il primo è la risposta individuale che cambia da soggetto a soggetto con solo il 50% in media di rispondere alle statine o all’ezetimibe, mentre gli studi di waterfall plot dimostrano come il restante 50% presenti una risposta di modesta entità o addirittura un incremento paradosso dei livelli di LDL-C. Tutto questo dipende da alcuni aspetti del profilo genetico individuale che rendono alcuni soggetti iperresponsivi ad un certo tipo di farmaco (ad esempio iperespressione del target farmacologico di ezetimibe nei pazienti diabetici) e dalla attivazione di alcuni meccanismi di controregolazione finalizzati ad opporsi alla riduzione dei livelli di LDL-C come, ad esempio, il rilascio della proteina PCSK9. Questo implica che la applicazione del medesimo schema di terapia a tutti i soggetti con ipercolesterolemia potrebbe rivelarsi solo parzialmente efficace con una percentuale non trascurabile di pazienti che a fronte di uno schema terapeutico potenzialmente efficace, rispondano in maniera limitata all’atto pratico. Il secondo aspetto è la mancanza pressoché totale di studi che dimostrino quale dovrebbe essere la terapia iniziale a più ampio spettro di efficacia e come tale quella di introdurre come primo step nel trattamento delle dislipidemie al di là della logica di applicazione delle risultanze dirette dei trial che si basano solo su un effetto cronologico, il classico “fist come, first serve”. In questa logica sono oggi disponibili dati assai interessanti derivati da studi condotti con inbitori di PCSK9 sia anticorpi (evolocumab) sia siRNA (inclisiran) che dimostrano come la riduzione dei livelli di LDL-C con queste due classi di farmaci sia esattamente sovrapponibile sia nei pazienti trattati in contemporanea con statine, sia in coloro che non assumevano tali farmaci. Questi risultati dovrebbero essere considerati con grande attenzione perché percentuale di pazienti, la riduzione di LDL-C indotta da inibitori di PCSK9 possa includere nel suo meccanismo d’azione anche l’effetto ipolipemizzante delle statine o di ezetimibe probabilmente in ragione della supremazia del meccanismo di sintesi e rilascio della proteina PCSK9 nell’ambito del sistema di controregolazione alla base della efficacia solo parziale di statine ed ezetimibe (ad esempio la famosa “regole del 6” per cui ogni raddoppio della dose di statina produce solo un 6% di riduzione dei livelli di LDL-C). In pratica la inibizione iniziale di PCSK9 non solo migliorerebbe sostanzialmente il profilo lipidico di tutti coloro che presentano una iperespressione di tale meccanismo pro-colesterolomizzante, ma al tempo stesso rappresenterebbe la base affinché ulteriori aggiunte di farmaci in grado di influire favorevolmente sul profilo lipidico possano esplicare fino in fondo la loro efficacia nei confronti dei livelli di LDL-C senza vedere tarpata una quota consistente del potenziale beneficio del loro intervento (Figura 1). La contropartita di tutto ciò sarebbe naturalmente un aumento dei costi del trattamento (che però potrebbero diventare oggetto di negoziazione se i farmaci più moderni diventassero di prima scelta) ampiamente controbilanciata dalla maggiore efficacia della terapia, dalla potenzialità di impiego di dosi più contenute di statine, dalla minore necessità di ricorrere a terapie di combinazione e il miglioramento significativo della aderenza al trattamento stante le modalità di somministrazione dilatata dei farmaci iniettabili da 30-40 gg fino ai 6 mesi per inclisiran.
Questo atteggiamento naturalmente richiede un accordo tra i molti soggetti coinvolti nel trattamento delle dislipidemie sia a livello clinico che regolatorio, ma sarebbe una scelta rivoluzionaria, basata su quanto ci dicono la genetica e la farmacologia e non semplicemente la sequenza forzata degli studi clinici controllati, la cui capacità di intercettare le reali potenzialità delle diverse classi farmacologiche è spesso limitata dal dettato metodologico che ogni nuovo farmaco in un certo ambito deve dimostrare di aggiungere efficacia a quella dimostrata da quelli di uso corrente, mentre molto poco spazio è lasciato alla dimostrazione che il benefico corrente possa essere utilmente riassorbito con un ulteriore vantaggio dai nuovi farmaci che la ricerca giornalmente ci propone. Un esempio? Sacubitril-valsartan nella HFrEF se lo avessimo associato alla terapia esistente e consolidata in luogo di proporre un confronto testa a testa probabilmente oggi sarebbe rinchiuso in un cassetto e la sua storia limitata ad un paio di lavori sul New England Journal of Medicine, rivista sicuramente prestigiosa, ma del tutto incapace di migliorare la sopravvivenza e la qualità della vita dei pazienti. Ogni matassa ha due bandoli e non è detto che il primo che si individua sia quello che permetterà di riavvolgerla nel modo corretto.
Related papers
Lo scenario della medicina attuale è caratterizzato da elementi di complessità generale inimmaginabili due decenni fa ed in grado di rendere molto più difficile la pratica clinica giornaliera. In particolare, la coesistenza di multiple condizioni passibili di un trattamento farmacologico nello stesso soggetto condiziona in maniera forzata alcune delle scelte terapeutiche spingendo alla ricerca di [more info]
Premessa Nell’ultimo decennio l’orizzonte della terapia ipolipemizzante si è arricchita di formidabili strumenti terapeutici quali ezitimibe, inibitori della proteina PCSK9 (PCSK9i) e acido bempedoico. Gli studi su queste molecole hanno permesso non solo di dimostrarne l’efficacia, ma hanno fornito importanti informazioni sull’importanza dell’abbassamento delle LDL nella riduzione del rischio cardiovascolare (CV) e costituiscono la base [more info]
Colesterolemia subottimale come fattore di rischio per le malattie cardiovascolari Il miglioramento delle abitudini alimentari e l’ottimizzazione dei livelli di colesterolo LDL nel sangue – fattore causale e cumulativo - sembrano essere strumenti efficaci per ridurre il rischio di malattie cardiovascolari su base aterosclerotica, che ancora oggi rappresentano una delle principali cause di morte e [more info]