- Sistema Renina-Angiotensina-Aldosterone (SRAA) e ipertensione
Il Sistema Renina-Angiotensina-Aldosterone (SRAA) è un meccanismo ormonale di vitale importanza per la regolazione della pressione sanguigna e l’omeostasi idroelettrolitica. Il sistema viene innescato dalla secrezione dell’enzima renina, prodotto dai reni in risposta a stimoli quali ridotta pressione sanguigna, ipovolemia o scarsità di sodio (1). Al suo rilascio, consegue una reazione a catena che conduce alla produzione di angiotensina II ad opera dell’enzima di conversione dell’angiotensina (ACE), presente nelle cellule endoteliali di piccoli e grandi vasi. Angiotensina II è un potente vasocostrittore, attiva il sistema simpatico e stimola la secrezione surrenalica di aldosterone con conseguente ritenzione di sodio (1). L’angiotensina II può essere sia circolante che tissutale ed è responsabile dell’aumento della pressione sanguigna attraverso l’attivazione del suo recettore di tipo 1 (AT1) (3). ACE non è l’unico enzima che media la produzione di angiotensina II: anche il complesso enzimatico CAGE (enzima generante angiotensina II chemiostatico-sensibile), la chimasi e la catepsina G possono convertire angiotensina I in angiotensina II (4,5). Fondamentale è anche l’azione dell’aldosterone, ormone terminale del SRAA, che regola l’equilibrio dei liquidi corporei e di vari elettroliti, tra cui sodio e potassio (1). Il SRAA regola dunque la pressione sanguigna, mantiene la tonicità vascolare e l’omeostasi idroelettrolitica corporea fondamentale per un corretto funzionamento di cuore e reni, senza rispettivi sovraccarichi (2). Tuttavia, la sua attivazione cronica, in molteplici patologie, comporta svariati effetti negativi, soprattutto a livello cardiovascolare.
L’iperattivazione del SRAA ha un’azione fortemente vasocostrittiva, ipertrofica, pro-fibrotica e pro-infiammatoria, a livello della muscolatura liscia, e conduce all’ipertensione sistemica e al rimodellamento dei tessuti cardiovascolari e renali. Inoltre favorisce l’insorgenza e la progressione del danno cardiovascolare in patologie quali ipertensione, infarto miocardico acuto e insufficienza cardiaca cronica. L’attivazione cronica del SRAA è anche coinvolta nello sviluppo di malattie renali croniche, complicazioni epatiche (alimentate dall’azione pro-infiammatoria), obesità (per l’azione sugli adipociti), diabete e disturbi del sistema nervoso (2). Di fatto, la disregolazione del SRAA alimenta il rischio cardiovascolare e di danno d’organo a cui conseguono eventi clinici anche fatali. Per questa ragione, sono molti i farmaci ideati per agire sull’iperattivazione del SRAA: gli ACE-inibitori impediscono la conversione di angiotensina I in angiotensina II; i sartani bloccano il legame dell’angiotensina II al suo recettore AT1; e, infine, gli antagonisti dei recettori dei mineralcorticoidi agiscono a valle, frenando le conseguenze dell’azione dell’aldosterone.
- Farmaci antipertensivi: gli ACE-inibitori
Il primo farmaco ACE-inibitore messo in commercio per il trattamento dell’ipertensione è stato captopril, nel 1980, seguito rapidamente da numerosi altri quali enalapril, perindopril, lisinopril, ramipril, quinapril, benazepril, cilazapril, trandolapril, fosinopril, moexipril, imidapril e zofenopril (3). Tutte queste sono molecole analoghe alla 2-metilpropionil-L-prolina (6). Il target molecolare di questa classe di medicinali è l’enzima ACE, responsabile della conversione da angiotensina I ad angiotensina II. ACE è una zinco-metalloproteinasi, generalmente ancorata alla membrana cellulare – solo una piccola parte viene rilasciata in circolo – e localizzata in vari tessuti i cui principali sono l’endotelio, di piccoli e grandi vasi, e i tessuti polmonari (3,7).
Dato il suo strategico posizionamento, ACE regola la quantità di angiotensina II circolante, la quale ha un ruolo di potente vasocostrittore. Di conseguenza, gli ACE-inibitori attuano un significativo effetto vasodilatatore che riduce la resistenza anche di piccole arteriole. La riduzione di angiotensina II aumenta la natriuresi, abbassa la pressione sanguigna e previene il rimodellamento del muscolo liscio e dei miociti cardiaci; ne consegue una riduzione della pressione arteriosa e venosa che riduce il pre- e il post-carico del cuore (8). La gittata e il battito cardiaco rimangono invariati e non viene riportata ipotensione posturale. Inoltre, gli ACE-inibitori interferiscono con la degradazione della bradichinina ossia un peptide, anch’esso substrato di ACE, che induce la vasodilatazione stimolando il rilascio di ossido nitrico (3,6).
Le caratteristiche farmacocinetiche e farmacodinamiche di ciascun ACE-inibitore dipendono dalla loro specifica affinità, potenza, lipofilia e ritenzione da parte dei tessuti che esprimono ACE; tali fattori ne determinano il perdurare dell’inibizione. Sebbene gli ACE-inibitori non agiscano sulla produzione di angiotensina II che si verifica per vie enzimatiche alternative – le quali potrebbero attenuare l’effetto antipertensivo nel lungo termine (9) –, questa classe di farmaci dimostra un adeguato controllo pressorio per mesi o anni. Tale effetto sembra essere dovuto alla mancata degradazione di peptidi vasodilatatori, tra cui la bradichinina (3).
L’efficacia terapeutica antipertensiva degli ACE-inibitori riduce il rischio di quelle problematiche cardiovascolari e coronariche tipicamente associate ad elevati valori di pressione sanguigna (8). La loro azione correla con una riduzione dell’ipertrofia ventricolare sinistra, una riduzione dell’irrigidimento di piccole e grandi arterie e un miglioramento della funzione endoteliale (10,11). Inoltre, alcuni ACE-inibitori sembrano esercitare un effetto nefroprotettivo nei pazienti con nefropatia diabetica, grazie all’efficace riduzione della pressione sanguigna (3,12).
- Ramipril
3.1. Indicazioni e posologia
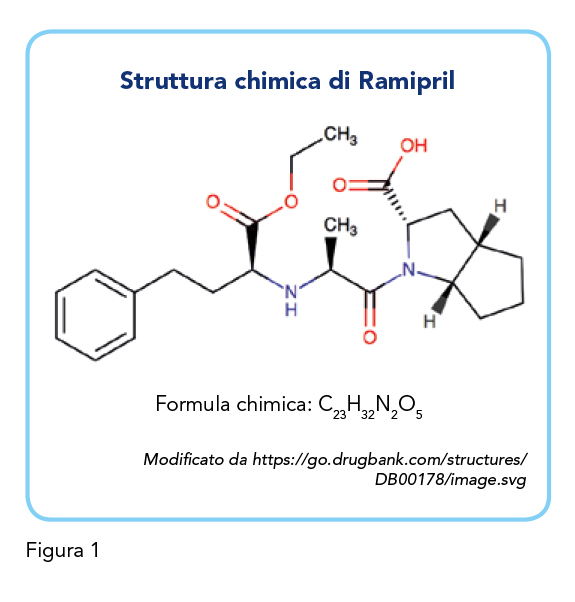
Ramipril, sviluppato alla fine degli anni ’80 (13), è un profarmaco appartenente alla classe degli ACE-inibitori. Ramipril (Figura 1) viene metabolizzato in ramiprilato, un potente inibitore competitivo di ACE nel fegato e, in misura minore, nei reni. Ramipril è indicato:
- per il trattamento dell’ipertensione;
- in prevenzione cardiovascolare;
- per il trattamento delle patologie renali;
- per il trattamento dell’insufficienza cardiaca sintomatica;
- in prevenzione secondaria dopo infarto miocardico acuto.
In prevenzione cardiovascolare, Ramipril ha mostrato di ridurre morbilità e mortalità in pazienti con patologie cardiovascolari aterotrombotiche conclamate (pregresse patologie coronariche o ictus, o patologie vascolari periferiche) o con diabete con almeno un fattore di rischio cardiovascolare. Per il trattamento delle patologie renali, Ramipril è indicato nello specifico nella nefropatia glomerulare diabetica incipiente, definita dalla presenza di microalbuminuria, nella nefropatia glomerulare diabetica conclamata, definita da macroproteinuria in pazienti con almeno un fattore di rischio cardiovascolare, e nella nefropatia glomerulare non diabetica conclamata (macroproteinuria ≥ 3 g/die). In prevenzione secondaria dopo infarto miocardico acuto, Ramipril ha mostrato efficacia di riduzione della mortalità dopo la fase acuta dell’infarto miocardico in pazienti con segni clinici di insufficienza cardiaca quando iniziato dopo 48 ore dall’insorgenza dell’infarto miocardico acuto.
L’RCP raccomanda che Ramipril venga assunto, deglutito per via orale con un liquido e non masticato o sbriciolato, ogni giorno alla stessa ora. Ramipril può essere assunto prima, durante o dopo i pasti, in considerazione del fatto che l’assunzione di cibo non modifica la sua biodisponibilità. Per quanto riguarda i pazienti adulti in trattamento con un diuretico, dopo l’inizio del trattamento con Ramipril è possibile che si verifichi ipotensione. Per questo motivo, è raccomandata cautela in quanto questi pazienti potrebbero presentare deplezione di volume plasmatico e/o di sali. Inoltre, il diuretico dovrebbe essere sospeso 2 o 3 giorni prima dell’inizio della terapia con Ramipril. Nell’eventualità in cui il diuretico non sia stato sospeso nei pazienti ipertesi, si raccomanda di iniziare la terapia con una dose di 1,25 mg di Ramipril, di monitorare la funzione renale e il potassio sierico e di aggiustare la dose successiva in base al valore della pressione arteriosa che si vuole raggiungere. Nel paziente iperteso, la dose deve essere individualizzata in accordo con il profilo del paziente e con il controllo della pressione arteriosa. Inoltre, Ramipril, che può essere usato in monoterapia o in combinazione con altre classi di farmaci antipertensivi, deve essere iniziato gradualmente con la dose raccomandata di 2,5 mg al giorno. I pazienti con una iperattivazione del SRAA possono presentare un calo eccessivo della pressione arteriosa dopo l’assunzione della prima dose, per cui si raccomanda di iniziare con una dose di 1,25 mg, sotto il controllo del medico. Tale dose può essere raddoppiata a intervalli di 2-4 settimane in modo da raggiungere progressivamente il valore richiesto di pressione arteriosa; non va comunque superata la dose massima di 10 mg al giorno. La dose viene di solito assunta in un’unica somministrazione giornaliera. Nel caso della prevenzione cardiovascolare, la dose iniziale raccomandata è di 2,5 mg una volta al giorno. Questo dosaggio deve essere gradualmente incrementato sulla base della tollerabilità del paziente al principio attivo. Si raccomanda di raddoppiare la dose dopo 1-2 settimane di trattamento e, dopo ulteriori 2-3 settimane, di incrementarla fino a raggiungere la dose target di mantenimento di 10 mg, sempre una volta al giorno. Per quanto riguarda il trattamento delle patologie renali, la dose iniziale raccomandata nei pazienti con diabete e microalbuminuria è di 1,25 mg una volta al giorno. Questo dosaggio va gradualmente aumentato sulla base della tollerabilità al principio attivo. Si raccomanda di raddoppiare la dose singola giornaliera a 2,5 mg dopo 2 settimane e a 5 mg dopo 2 ulteriori settimane. Nei pazienti con diabete e almeno un fattore di rischio cardiovascolare, la dose iniziale raccomandata è di 2,5 mg una volta al giorno, da incrementare gradualmente sulla base della tollerabilità. Nello specifico, si raccomanda di raddoppiare la dose singola giornaliera a 5 mg dopo 1-2 settimane e quindi a 10 mg − dose giornaliera target − dopo ulteriori 2-3 settimane. Nei pazienti con nefropatia non diabetica, definita da macroproteinuria ≥ 3 g/die, la dose iniziale raccomandata è 1,25 mg una volta al giorno, dosaggio che va gradualmente incrementato sulla base della tollerabilità. Si raccomanda di raddoppiare la dose singola giornaliera a 2,5 mg dopo 2 settimane e quindi a 5 mg dopo 2 ulteriori settimane. Per il trattamento dell’insufficienza cardiaca sintomatica, nei pazienti stabilizzati, con concomitante terapia diuretica, la dose iniziale raccomandata è di 1,25 mg al giorno. Ramipril deve essere titolato raddoppiando la dose ogni 1-2 settimane fino ad una dose massima giornaliera di 10 mg. In questa casistica, sono preferibili due somministrazioni al giorno. Nella prevenzione secondaria in pazienti con pregresso infarto miocardico acuto e con insufficienza cardiaca, dopo 48 ore dall’infarto del miocardio, quando clinicamente ed emodinamicamente stabili, la dose iniziale raccomandata è di 2,5 mg due volte al giorno per 3 giorni. Se questo dosaggio non è tollerato, deve essere somministrata una dose di 1,25 mg due volte al giorno per 2 giorni prima di aumentarla a 2,5 mg e a 5 mg due volte al giorno. Se la dose non può essere aumentata a 2,5 mg due volte al giorno, il trattamento deve essere interrotto. La dose giornaliera va successivamente aumentata raddoppiandola a intervalli da 1 a 3 giorni fino alla dose di mantenimento di 5 mg due volte al giorno. Quando possibile, la dose di mantenimento viene suddivisa in due somministrazioni al giorno. Al momento non esistono ancora dati sufficienti in pazienti con insufficienza cardiaca grave (New York Heart Association − NYHA − classification IV) immediatamente dopo infarto del miocardio. Se si decide di trattare questi pazienti si raccomanda di iniziare la terapia con una dose da 1,25 mg una volta al giorno e di incrementare la dose con particolare cautela. Nei pazienti con insufficienza renale la dose giornaliera deve essere basata sulla clearance della creatinina: se questa è ≥ 60 mL/min, non è necessario aggiustare la dose iniziale (2,5 mg/die) e la dose massima giornaliera è di 10 mg; se questa è compresa tra 30-60 mL/min non è necessario aggiustare la dose iniziale (2,5 mg/die) e la dose massima giornaliera è di 5 mg; se questa è compresa tra 10-30 mL/min, la dose iniziale è 1,25 mg/die e la dose massima giornaliera è di 5 mg. In pazienti ipertesi in emodialisi Ramipril è scarsamente dializzabile: la dose iniziale è quindi di 1,25 mg/die − dose massima giornaliera, 5 mg − da somministrare poche ore dopo la dialisi. Nei pazienti con insufficienza epatica, il trattamento con Ramipril deve essere iniziato solo sotto stretto controllo medico e la dose massima giornaliera è di 2,5 mg. Negli anziani, deve essere presa in considerazione una dose iniziale ridotta di 1,25 mg e la titolazione deve essere molto graduale a causa della maggiore probabilità di comparsa di effetti indesiderati in particolare in pazienti molto anziani o debilitati. La sicurezza e l’efficacia di Ramipril nei bambini non è stata ancora stabilita e non può quindi essere fatta alcuna raccomandazione specifica riguardante la posologia.
3.2. Meccanismo d’azione
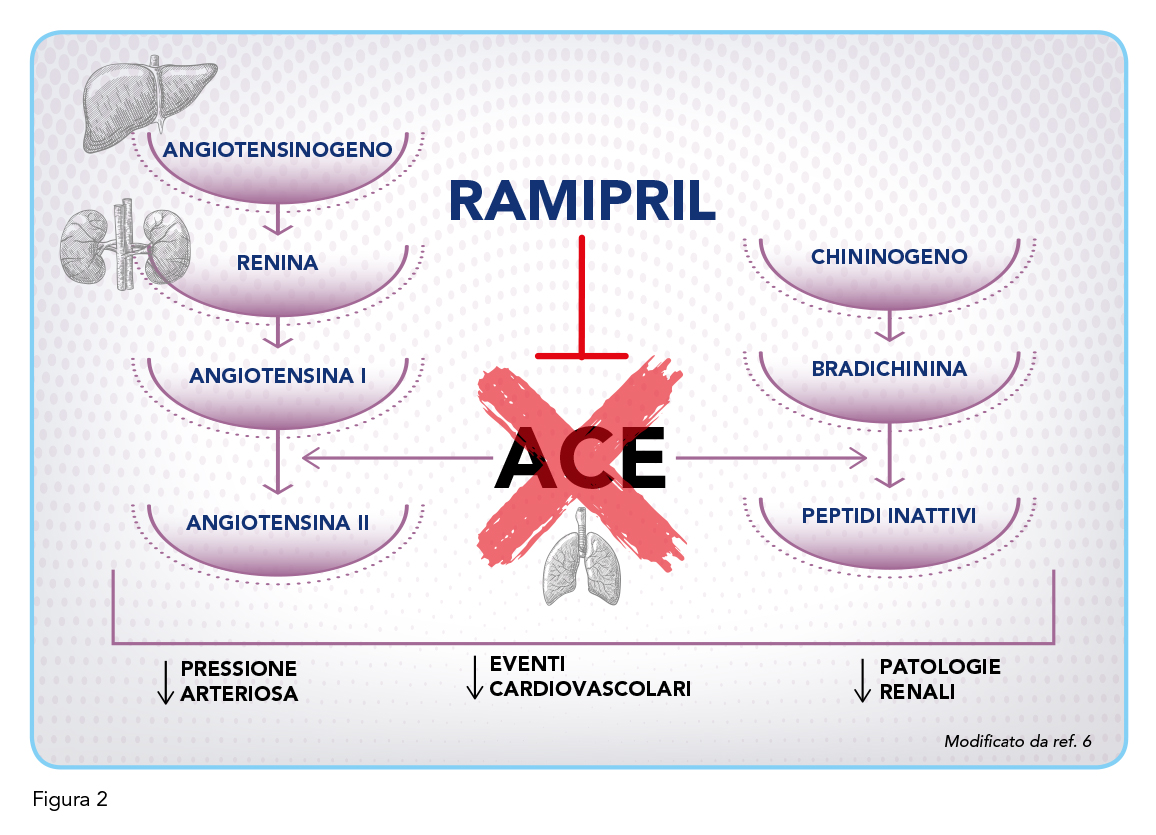
Il SRAA è un importante sistema di regolazione della pressione sanguigna, dell’emodinamica e dell’equilibrio idrico ed elettrolitico nel corpo umano. Quando l’angiotensina I passa attraverso i polmoni, viene ulteriormente convertita in angiotensina II da ACE, presente nelle cellule endoteliali vascolari dei polmoni. L’angiotensina II ha diversi effetti che contribuiscono all’ottimizzazione della pressione sanguigna: agisce nel cervello e aumenta il rilascio di vasopressina che, riassorbendo i liquidi dai reni, migliora la pressione sanguigna; provoca la vasocostrizione arteriolare che a sua volta aumenta la pressione sanguigna incrementando la resistenza periferica totale; agisce sulla corteccia surrenale e promuove il rilascio di aldosterone. L’aldosterone agisce ulteriormente sulle cellule tubulari renali e determina il riassorbimento del sodio, che provoca il riassorbimento dell’acqua nei dotti collettori, e aumenta il deflusso di adrenalina dal sistema nervoso centrale, con conseguente aumento della pressione sanguigna. Ramipril inibisce il SRAA legandosi ad ACE e inibendolo, impedendo così la conversione dell’angiotensina I in angiotensina II (14). La conseguente diminuzione dell’attività simpatica, la diminuzione del riassorbimento di sodio e acqua dai reni e il rilassamento della muscolatura liscia delle arteriole hanno l’effetto finale di diminuire la pressione sanguigna. Quando i livelli plasmatici di angiotensina II diminuiscono, si verifica una minore attivazione dei recettori accoppiati a proteine G dell’angiotensina I (AT1R) e dell’angiotensina II (AT2R). AT1R media la vasocostrizione, l’infiammazione, la fibrosi e lo stress ossidativo attraverso una serie di vie di segnalazione. La conseguente vasocostrizione e la riduzione dell’infiammazione mediano gli effetti nefroprotettivi, antipertensivi e cardioprotettivi di Ramipril. AT2R agisce in opposizione agli effetti di AT1R portando alla vasodilatazione. ACE è anche responsabile della degradazione della bradichinina, un vasodilatatore. Il conseguente accumulo di bradichinina dovuto all’inibizione di ACE, oltre a indurre una maggiore vasodilatazione e una riduzione della pressione sanguigna, è ritenuto anche responsabile della caratteristica tosse secca, effetto collaterale dei farmaci ACE-inibitori, incluso Ramipril.
3.3. Farmacocinetica
Ramipril è un profarmaco inattivo che viene convertito in ramiprilato nel fegato, principale sito di attivazione, e nei reni. L’entità dell’assorbimento di Ramipril è almeno del 50-60%. Il cibo diminuisce la velocità di assorbimento dal tratto gastrointestinale senza influenzarne l’entità. Le biodisponibilità assoluta di Ramipril e del ramiprilato sono rispettivamente del 28% e del 44% quando la somministrazione orale è confrontata con quella endovenosa. La concentrazione sierica di ramiprilato rimane invariata quando le capsule vengono aperte e il contenuto sciolto in acqua, in succo di mela o sospeso in salsa di mela. Il legame proteico di Ramipril è di circa il 73% e quello del ramiprilato di circa il 56%, ed è indipendente dalla concentrazione nell’intervallo 0,1 μg/mL – 10 μg/mL. Il 25% del metabolismo epatico produce il metabolita attivo ramiprilato attraverso gli enzimi epatici esterasi. Il 100% del metabolismo renale converte Ramipril in ramiprilato. Gli altri metaboliti sono inattivi. Dopo la somministrazione orale, circa il 60% della dose viene eliminata nelle urine come Ramipril immutato (< 2%) e i suoi metaboliti. Circa il 40% della dose si ritrova nelle feci, rappresentando sia il farmaco non assorbito che il farmaco e i metaboliti eliminati attraverso l’escrezione biliare. L’escrezione urinaria di Ramipril può essere ridotta nei pazienti con funzionalità renale compromessa. Il rapido declino iniziale rappresenta la distribuzione nei tessuti e ha un’emivita di 2-4 ore. L’emivita della fase di eliminazione apparente è di 9-18 ore, che si ritiene rappresenti la clearance del farmaco libero. L’emivita della fase di eliminazione terminale è > 50 ore e si ritiene che rappresenti la clearance del farmaco legato ad ACE a causa della sua lenta dissociazione. L’emivita di ramiprilato dopo dosi giornaliere multiple (DDM) è dose-dipendente e varia da 13-17 ore con DDM da 5-10 mg a 27-36 ore con DDM da 2,5 mg. La clearance renale di Ramipril e del ramiprilato è stata riportata a 7,2 e 77,4 mL/min/1,73 m2, rispettivamente, mentre in pazienti anziani sani con funzionalità renale normale è stata riportata a 10,7 e 126,8 mL/min/1,73 m2, rispettivamente; inoltre la concentrazione plasmatica massima del ramiprilato è circa il 20% più alta in questa popolazione. Mentre la farmacocinetica di Ramipril sembra non essere influenzata da una ridotta funzionalità renale, la concentrazione plasmatica e l’emivita del ramiprilato sono aumentate. Nei pazienti con insufficienza epatica la concentrazione di Ramipril è inizialmente aumentata mentre il tempo massimo necessario al raggiungimento della concentrazione plasmatica massima del ramiprilato è prolungato a causa della ridotta capacità di metabolizzare il farmaco. Tuttavia, le concentrazioni allo stato stazionario di ramiprilato sono le stesse nell’insufficienza epatica e nei pazienti sani.
3.4. Sicurezza e tollerabilità
Il profilo di sicurezza di Ramipril include tosse secca persistente e reazioni dovute all’ipotensione. Reazioni avverse gravi comprendono angioedema, angioedema intestinale (con dolore addominale con o senza nausea o vomito), iperkaliemia, compromissione epatica o renale, pancreatiti, reazioni cutanee gravi, sindrome da inappropriata secrezione di ormone anti-diuretico e conseguente iponatriemia e, più raramente, neutropenia/agranulocitosi, trombocitopenia, anemia, e depressione del midollo osseo. Tra le reazioni avverse meno gravi si notano tachicardia, congestione nasale e rinite, congiuntivite, tremore e orticaria. I sintomi associati al sovradosaggio di ACE-inibitori possono includere vasodilatazione periferica eccessiva (con marcata ipotensione, shock), bradicardia, alterazione degli elettroliti, scompenso renale. Alcuni effetti indesiderati (ad esempio sintomi del calo pressorio quali capogiri) possono interferire con la capacità di concentrazione e di reazione del paziente e perciò rappresentano un rischio in situazioni in cui queste capacità siano particolarmente importanti. Questo può verificarsi in modo particolare all’inizio del trattamento o quando si sta sostituendo un’altra terapia. Dopo la prima dose o incremento di dose non è consigliabile guidare o usare macchinari per diverse ore.
Ramipril è controindicato, oltre che nei casi di ipersensibilità al principio attivo, a uno qualsiasi degli eccipienti elencati in RCP, o ad altri ACE-inibitori, anche nei casi di riscontro anamnestico di angioedema (ereditario, idiopatico o pregresso angioedema con ACE-inibitori o sartani), nei trattamenti extracorporei che portano il sangue a contatto con superfici caricate negativamente, nei casi di stenosi bilaterale significativa dell’arteria renale o stenosi unilaterale in pazienti con rene unico funzionante, e in gravidanza. Per le pazienti che stanno pianificando una gravidanza si raccomanda di ricorrere a trattamenti antipertensivi alternativi, con comprovato profilo di sicurezza per l’uso in gravidanza, a meno che non sia considerato essenziale il proseguimento della terapia con Ramipril. Quando viene accertata una gravidanza, il trattamento deve essere interrotto immediatamente e, se appropriato, deve essere iniziata una terapia alternativa. Poiché le informazioni sull’uso di Ramipril durante l’allattamento sono insufficienti, esso non è raccomandato ed è preferibile ricorrere a trattamenti alternativi con profilo di sicurezza meglio stabilito durante l’allattamento, specialmente quando si allatta un neonato o un neonato pretermine. Ramipril è inoltre controindicato nei pazienti con ipotensione o emodinamicamente instabili, concomitantemente all’uso di medicinali contenenti aliskiren, e nei pazienti affetti da diabete mellito o compromissione renale (velocità di filtrazione glomerulare GFR < 60 mL/min/1,73 m2). Esiste inoltre l’evidenza che l’uso combinato di ACE-inibitori, sartani o aliskiren aumenta il rischio di ipotensione e iperkaliemia e riduce la funzionalità renale (insufficienza renale acuta inclusa). Il duplice blocco del SRAA attraverso l’uso combinato di ACE-inibitori, sartani o aliskiren non è pertanto raccomandato. Se la terapia del duplice blocco è considerata assolutamente necessaria, ciò deve avvenire solo sotto la supervisione di uno specialista e con uno stretto e frequente monitoraggio della funzionalità renale, degli elettroliti e della pressione sanguigna. Gli ACE-inibitori e i sartani non devono essere usati contemporaneamente in pazienti con nefropatia diabetica. I pazienti con iperattivazione del SRAA sono a rischio di forte ipotensione e deterioramento della funzione renale dovuto all’inibizione di ACE, specialmente quando l’ACE-inibitore o un diuretico in associazione sono somministrati per la prima volta o al primo incremento della dose. Deve essere prevista un’attivazione rilevante del SRAA ed è necessaria una supervisione medica che includa il monitoraggio della pressione per esempio in pazienti con ipertensione grave, pazienti con insufficienza cardiaca congestizia scompensata, pazienti con ostacolo emodinamicamente rilevante all’afflusso o al deflusso ventricolare sinistro (ad esempio stenosi valvolare aortica o mitralica), pazienti con stenosi unilaterale dell’arteria renale con secondo rene funzionante, pazienti in cui vi è o si può sviluppare deplezione di fluidi o di sali (inclusi i pazienti in trattamento con i diuretici), pazienti con cirrosi epatica e/o ascite, durante interventi chirurgici importanti o durante anestesia con farmaci che causano ipotensione. In genere si raccomanda di correggere la disidratazione, l’ipovolemia o la deplezione di sali prima di iniziare il trattamento (tuttavia nei pazienti con insufficienza cardiaca tale azione correttiva deve essere attentamente valutata contro il rischio di un sovraccarico). In caso di insufficienza cardiaca transitoria o persistente post infarto miocardico, e nei pazienti a rischio di ischemia cardiaca o cerebrale in caso di ipotensione acuta, la fase iniziale del trattamento richiede un attento controllo medico. Se possibile, si raccomanda di interrompere il trattamento con Ramipril un giorno prima dell’intervento chirurgico.
3.5. Studi più rilevanti
- Gli studi HOPE (15) e HOPE-TOO (16): l’efficacia a lungo termine di Ramipril nella prevenzione cardiovascolare
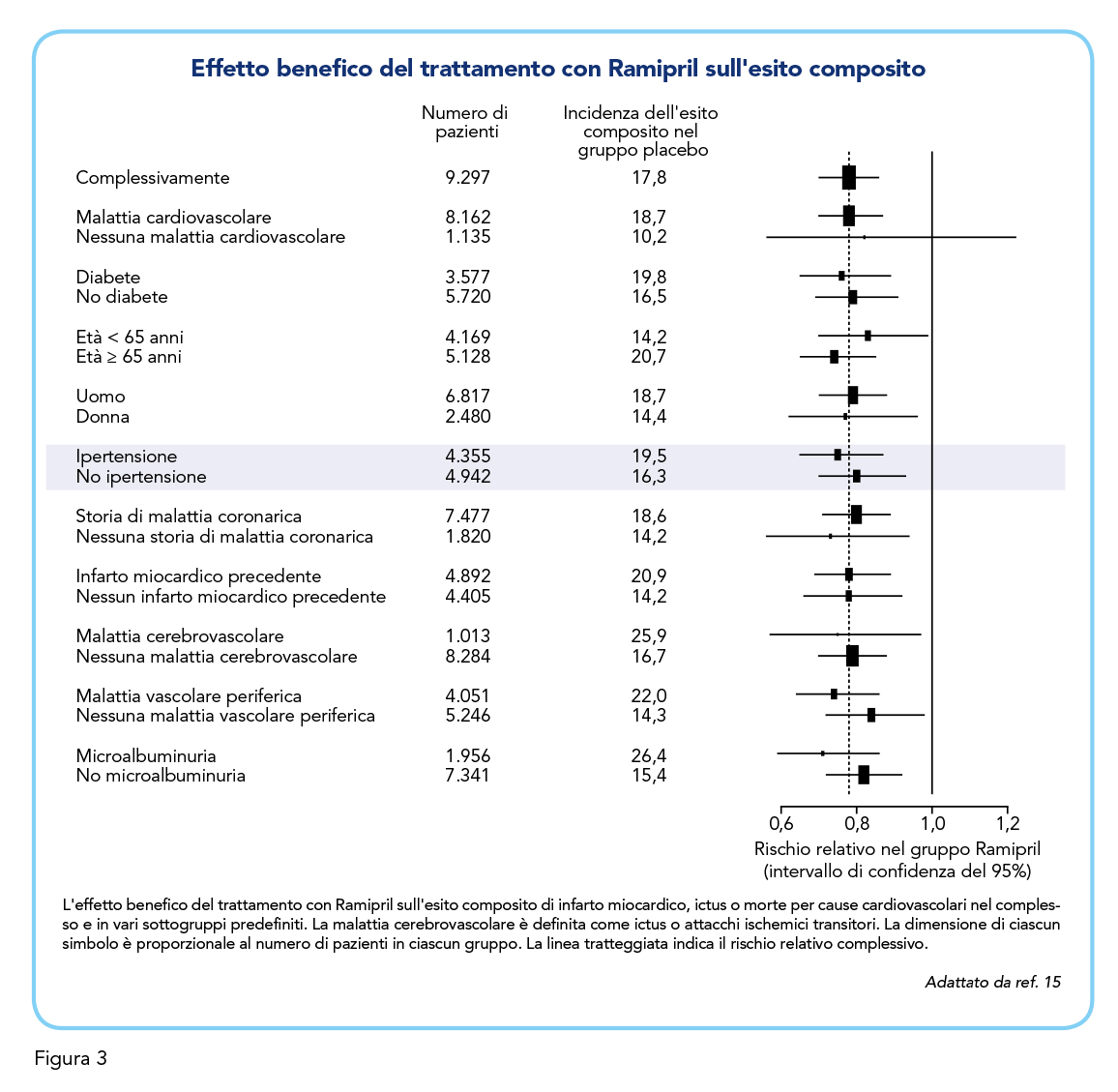
L’efficacia terapeutica di Ramipril nella prevenzione cardiovascolare è supportata da diversi studi (17,18), tra cui lo studio principale HOPE (Heart Outcomes Prevention Evaluation) (15) e lo studio secondario HOPE-TOO (HOPE-The Ongoing Outcome) (16). Lo studio HOPE (15), randomizzato in doppio cieco, ha coinvolto, per una media di 5 anni, un totale di 9.297 pazienti ≥ 55 anni ad alto rischio cardiovascolare. Di questi pazienti, 2.480 erano donne, 5.128 avevano almeno 65 anni, 8.162 erano affetti da malattie cardiovascolari, 4.355 (quindi circa il 50%) soffrivano di ipertensione controllata, 3.577 avevano il diabete. Lo studio ha valutato gli effetti del trattamento con Ramipril 10 mg vs placebo nel prevenire l’endpoint primario composito di infarto del miocardio, ictus o morte per cause cardiovascolari. Lo studio ha valutato inoltre gli effetti su ciascun esito separatamente e, come esiti secondari includeva il decesso per tutte le cause, la necessità di rivascolarizzazione, l’ospedalizzazione per angina instabile o insufficienza cardiaca e le complicanze legate al diabete, il peggioramento dell’angina, l’insufficienza cardiaca e lo sviluppo del diabete. Ramipril ha ridotto significativamente i tassi, sia individuali che compositi, di ictus, infarto del miocardio o morte cardiovascolare, in confronto al placebo (p < 0,001). Degno di nota, il 14% dei pazienti assegnati a Ramipril raggiungevano l’endpoint primario, contro il 18% di quelli assegnati al placebo. È stato inoltre riscontrato un rischio significativamente ridotto di mortalità per cause cardiovascolari, rivascolarizzazione, complicazioni legate al diabete, infarto del cardiaco, scompenso cardiaco per tutte le cause, peggioramento dell’angina o nuova diagnosi di diabete nei pazienti trattati con Ramipril rispetto a quelli trattati con placebo. Inoltre, in un’analisi sul sottogruppo di pazienti anziani di età ≥ 75 anni (n = 998), il trattamento con Ramipril riduceva il rischio cardiovascolare nella stessa entità dello studio principale, mentre non vi erano differenze significative tra i due gruppi di età (55-75 anni vs ≥ 75 anni) nei due outcome, primario e secondario, ad eccezione dell’incidenza di rivascolarizzazione che era significativamente minore nei pazienti più anziani (17.1% vs 10.7%) (19). Per riassumere, l’effetto benefico del trattamento con Ramipril sull’esito composito è stato costantemente osservato tra i seguenti sottogruppi predefiniti: donne e uomini (20), pazienti con ipertensione al basale e quelli senza, pazienti con evidenza di malattia cardiovascolare e quelli senza tale evidenza, pazienti di età inferiore a 65 anni e quelli di età pari o superiore a 65 anni, pazienti con diabete e quelli senza diabete, e pazienti con microalbuminuria e quelli senza (si vedano gli approfondimenti di questi ultimi due confronti nei prossimi paragrafi) (Figura 3). In aggiunta, un sottostudio ha valutato gli effetti di una bassa dose di Ramipril (2,5 mg al giorno vs 10 mg al giorno vs placebo) su un gruppo di 244 pazienti. Circa il 14% dei pazienti trattati con una bassa dose di Ramipril hanno raggiunto l’endpoint composito, contro il 13% di quelli assegnati all’assunzione di 10 mg di Ramipril al giorno e il 17% di quelli assegnati al placebo. L’inclusione dei dati del gruppo a basso dosaggio non ha modificato i risultati (15). I risultati dello studio HOPE (15) sono stati confermati anche dallo studio SECURE (Study to Evaluate Carotid Ultrasound changes in patients or calcium channel blockade on the circadian variation of heart rate variability, treated with Ramipril and vitamin E) (21) che ha mostrato, in aggiunta, l’efficacia di Ramipril e vitamina E nel rallentamento della progressione dell’aterosclerosi (i.e. i cambiamenti dell’ecografia carotidea).
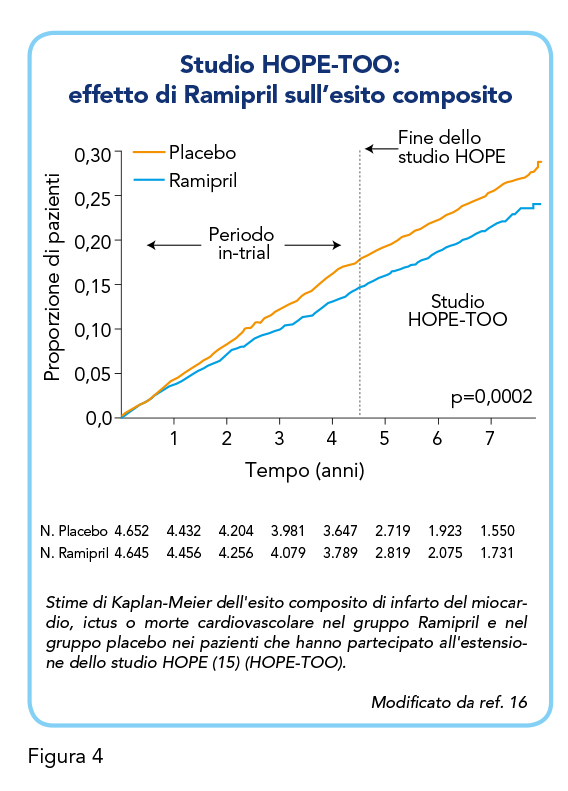
Per valutare se i benefici osservati nello studio HOPE (15) perdurassero, lo studio è stato prolungato di 2,6 anni, risultando nello studio di estensione HOPE-TOO (16). Dello studio principale, 4.528 pazienti hanno accettato di essere sottoposti a un ulteriore follow-up.
I pazienti erano equamente distribuiti tra gruppo di trattamento con Ramipril (72%) e gruppo placebo (68%). Durante questo follow-up, i pazienti assegnati a Ramipril hanno riportato un rischio relativo di infarto del miocardio ulteriormente ridotto del 19% (95% CI, da 0,65 a 1,01), un rischio relativo di rivascolarizzazione ridotto del 16% (95% CI, 0,70-0,99) e un ridotto rischio relativo di nuova diagnosi di diabete del 34% (95% CI, 0,46-0,95). Riduzioni simili dei rischi relativi degli eventi vascolari sono state osservate durante e dopo la fase attiva dello studio, indipendentemente dal rischio al basale o dai trattamenti accessori (aspirina, beta-bloccanti, ipoglicemizzanti), avvalorando i risultati dello studio principale HOPE (15) ed estendendoli nel lungo termine (Figura 4).
- Lo studio MICRO-HOPE (22): effetti nefroprotettivi di Ramipril
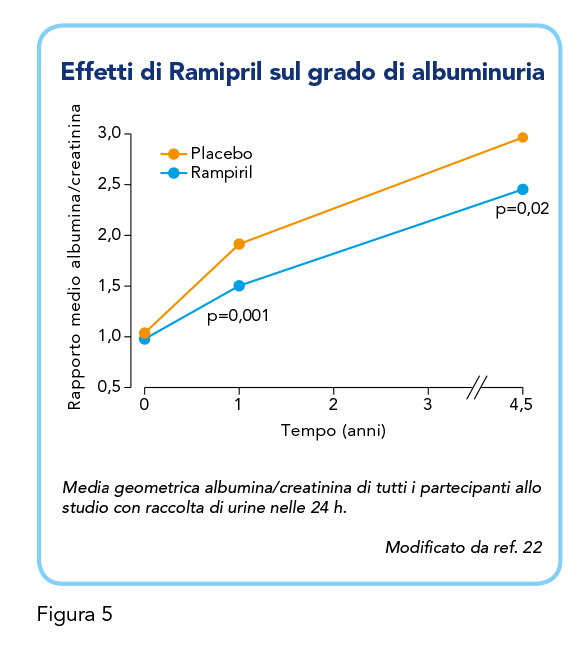
Lo studio MICRO-HOPE (Microalbuminuria, Cardiovascular and Renal Outcomes-HOPE) (22) ha invece misurato, in un totale di 3.577 pazienti ≥ 55 anni con diabete (sia di tipo 1 che di tipo 2, anche se l’esatta proporzione nel campione non è specificata) assegnati in modo casuale a Ramipril (10 mg/die) o placebo, e a vitamina E o placebo (confronto tra questi ultimi due n.s.), l’incidenza del rischio cardiovascolare e dello sviluppo di nefropatia. I pazienti avevano storia di un precedente evento cardiovascolare o almeno un altro fattore di rischio cardiovascolare, e non riportavano proteinuria clinica, insufficienza cardiaca o ridotta frazione di eiezione, e non assumevano ACE-inibitori. Lo studio, interrotto con 6 mesi di anticipo a causa di un consistente beneficio di Ramipril rispetto al placebo, ha mostrato come Ramipril abbia ridotto il rischio dell’endpoint primario composito del 25%, di infarto miocardico del 22%, di ictus del 33%, di morte cardiovascolare del 37%, di mortalità totale del 24%, di rivascolarizzazione del 17%. Importante, Ramipril ha ridotto del 24% il rischio di nefropatia conclamata sia nei partecipanti che presentavano sia in quelli che non presentavano microalbuminuria al basale. Inoltre, il trattamento con Ramipril ha portato a un rapporto albumina/creatinina più basso rispetto al placebo a 1 anno e alla fine dello studio (Figura 5). Ramipril si è quindi dimostrato efficace non solo nella riduzione degli eventi cardiovascolari ma anche della nefropatia conclamata nelle persone con diabete. Da notare, tuttavia, che Ramipril non ha avuto alcun effetto sullo sviluppo della microalbuminuria in pazienti normoalbuminurici al basale. Inoltre, a sostegno dei risultati degli studi principali, il beneficio cardiovascolare era maggiore di quello attribuibile alla mera riduzione della pressione arteriosa. Ramipril ha quindi sia effetti cardioprotettivi che nefroprotettivi nei pazienti con diabete. Questi risultati sono stati confermati anche da studi successivi, ponendo l’attenzione sul ruolo di Ramipril nella modulazione del SRAA, la cui azione non solo comporta la regolazione della pressione sanguigna e del metabolismo idrosalino, ma svolge anche un ruolo importante nello sviluppo della nefropatia diabetica (23).
- Ramipril riduce l’incidenza di sviluppo di diabete di nuova insorgenza in pazienti con malattia vascolare
Considerando che gli studi precedentemente riportati coinvolgevano anche pazienti con diabete (22), entrando ancora più nel merito dell’argomento, una sottoanalisi del 2001 dello stesso gruppo di lavoro dello studio HOPE (15) ha valutato gli effetti di Ramipril sullo sviluppo di diabete di nuova insorgenza (24). Degli oltre 9.000 pazienti con malattia vascolare coinvolti nello studio HOPE (15), oltre un terzo presentava diabete e sono quindi stati esclusi da questa sottoanalisi. I restanti pazienti senza diabete erano distribuiti equamente tra gruppo con trattamento con Ramipril 10 mg e gruppo placebo. Solo il 3,6% dei pazienti inclusi nel gruppo Ramipril, contro il 5,4% di quelli inclusi nel gruppo placebo, hanno sviluppato diabete ex novo negli anni a venire (Figura 6). Tale diagnosi era documentata da livelli di emoglobina glicosilata HbA1c maggiori rispetto al limite superiore dell’intervallo normale e dalla prescrizione di un farmaco ipoglicemizzante o insulina: il confronto tra i due gruppi su entrambe queste misure era significativo (cumulativamente p < 0,003). Inoltre, il glucosio a digiuno aumentava maggiormente durante il trattamento con placebo che con Ramipril. Poiché Ramipril ha ridotto il rischio di eventi cardiovascolari e di nefropatia diabetica − da notare come questi risultati siano paralleli a quelli dello studio MICRO-HOPE (22) in pazienti che al contrario avevano diabete − gli autori di questo studio hanno anche valutato se la maggiore incidenza di questi eventi clinici nei pazienti con diabete fosse responsabile dell’aumentata probabilità di sviluppare diabete, ma questo non si è rivelato essere il caso. I risultati in merito agli effetti di Ramipril su pazienti con diabete sono stati confermati anche da studi più recenti (e.g. 25).
Conclusioni
Ramipril, un profarmaco approvato alla fine degli anni ’80, viene metabolizzato in ramiprilato, un potente inibitore competitivo di ACE nel fegato e, in misura minore, nei reni. Ramipril è indicato per il trattamento dell’ipertensione, in prevenzione cardiovascolare, per il trattamento delle patologie renali, per il trattamento dell’insufficienza cardiaca sintomatica e in prevenzione secondaria dopo infarto miocardico acuto. Ramipril è efficace nella prevenzione cardiovascolare in pazienti con età uguale o superiore ai 55 anni ad alto rischio cardiovascolare, in egual misura nei pazienti con ipertensione e nei pazienti più anziani. Questa efficacia, inoltre, è stata dimostrata perdurare nel lungo termine. Ramipril ha inoltre effetti cardioprotettivi e nefroprotettivi nei pazienti con diabete, riducendone l’incidenza del rischio di nefropatia conclamata. nei pazienti senza diabete, invece, Ramipril riduce l’incidenza di sviluppo di diabete di nuova insorgenza, dimostrando ancora una volta le sue proprietà preventive.
Bibliografia
- Ames MK, Atkins CE, Pitt B. The renin-angiotensin-aldosterone system and its suppression. J Vet Intern Med. 2019 Mar;33(2):363–82.
- Patel S, Rauf A, Khan H, Abu-Izneid T. Renin-angiotensin-aldosterone (RAAS): The ubiquitous system for homeostasis and pathologies. Biomed Pharmacother. 2017 Oct;94:317–25.
- Laurent S. Antihypertensive drugs. Pharmacol Res. 2017 Oct;124:116–25.
- Ram CVS. Angiotensin receptor blockers: current status and future prospects. Am J Med. 2008 Aug;121(8):656–63.
- Borghi, C. B., Rossi, F. R., & Trimarco, B. T. (2015). Ruolo Del Sistema Renina Angiotensina Aldosterone E Dei Farmaci Che Inibiscono Tale Sistema Nelle Malattie Cardiovascolari: Complessità E Criticità. Position Paper SIF – SIIA. Disponibile al sito: https://siia.it/wp-content/uploads/2015/07/03-PositionPaper-43-71.pdf”
- Piepho RW. Overview of the angiotensin-converting-enzyme inhibitors. American Journal of Health-System Pharmacy. 2000 Oct 1;57(suppl_1):S3–7.
- Dzau VJ. Mechanism of action of angiotensin-converting enzyme (ACE) inhibitors in hypertension and heart failure. Role of plasma versus tissue ACE. Drugs. 1990;39 Suppl 2:11–6.
- Herman LL, Padala SA, Ahmed I, Bashir K. Angiotensin Converting Enzyme Inhibitors (ACEI). In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 [cited 2022 Jul 6]. Available from: http://www.ncbi.nlm.nih.gov/books/NBK431051/
- Petrie MC, Padmanabhan N, McDonald JE, Hillier C, Connell JM, McMurray JJ. Angiotensin converting enzyme (ACE) and non-ACE dependent angiotensin II generation in resistance arteries from patients with heart failure and coronary heart disease. J Am Coll Cardiol. 2001 Mar 15;37(4):1056–61.
- Tropeano AI, Boutouyrie P, Pannier B, Joannides R, Balkestein E, Katsahian S, et al. Brachial pressure-independent reduction in carotid stiffness after long-term angiotensin-converting enzyme inhibition in diabetic hypertensives. Hypertension. 2006 Jul;48(1):80–6.
- Agabiti-Rosei E, Heagerty AM, Rizzoni D. Effects of antihypertensive treatment on small artery remodelling. J Hypertens. 2009 Jun;27(6):1107–14.
- Lewis EJ, Hunsicker LG, Bain RP, Rohde RD. The effect of angiotensin-converting-enzyme inhibition on diabetic nephropathy. The Collaborative Study Group. N Engl J Med. 1993 Nov 11;329(20):1456–
- Vasmant D, Bender N. The renin-angiotensin system and ramipril, a new converting enzyme inhibitor. J Cardiovasc Pharmacol. 1989;14 Suppl 4(SUPPL. 4). doi:10.1097/00005344-198900000-00011
- Renin and Angiotensin | Goodman & Gilman’s: The Pharmacological Basis of Therapeutics, 13e | AccessMedicine | McGraw Hill Medical. Accessed August 31, 2022. https://accessmedicine.mhmedical.com/content.aspx?sectionid=170106980&bookid=2189#194547191
- Yusuf, Sleight, Pogue, Bosch, Davies, Dagenais. Effects Of An Angiotensin-Converting-Enzyme Inhibitor, Ramipril, On Cardiovascular Events In High-Risk Patients. The New England Journal of Medicine . Published online 2000.
- Bosch J, Lonn E, Pogue J, Arnold JMO, Dagenais GR, Yusuf S. Long-Term Effects of Ramipril on Cardiovascular Events and on Diabetes. Circulation. 2005;112(9):1339-1346. doi:10.1161/CIRCULATIONAHA.105.548461
- Anderson VR, Perry CM, Robinson DM, Bertrand ME. Ramipril A Review of its Use in Preventing Cardiovascular Outcomes in High-Risk Patients. Am J Cardiovasc Drugs. 2006;6(6):417-432.
- Frampton lames E, Peters DH, Ball S, et al. DRUG EVALUATION Ramipril An Updated Review of Its Therapeutic Use in Essential Hypertension and Heart Failure. Vol 49.; 1995.
- Bosch J, Probstfield J. Beneficial effects of ramipril on cardiovascular events in high-risk patients older than 75 years of age: Secondary outcomes from the HOPE trial. J Am Coll Cardiol. 2003;41(6):154. doi:10.1016/s0735-1097(03)81763-1
- Lonn E, Roccaforte R, Yi Q, et al. Angiotensin Antagonism Effect of Long-Term Therapy With Ramipril in High-Risk Women.; 2002.
- Lonn EM, Yusuf S, Dzavik V, et al. Effects of Ramipril and Vitamin E on Atherosclerosis. Circulation. 2001;103(7):919-925. doi:10.1161/01.CIR.103.7.919
- Gerstein HC, Yusuf S, Mann JFE, et al. Effects of ramipril on cardiovascular and microvascular outcomes in people with diabetes mellitus: Results of the HOPE study and MICRO-HOPE substudy. Lancet. 2000;355(9200):253-259. doi:10.1016/S0140-6736(99)12323-7
- Aladár Megyei Oktató Kórház P, Osztály K. The role of ramipril in the therapy of diabetic nephropathy. Orv Hetil. 2014;155(7):263-269. doi:10.1556/OH.2014.29827
- Yusuf S, Gerstein H, Hoogwerf B, et al. Ramipril and the Development of Diabetes. J Am Med Assoc. Published online 2001. https://jamanetwork.com/
- Bhardwaj RK, Kazal HL, Kohli K, et al. Effects of antihypertensive agents on the quality of life in diabetic hypertensive patients: A prospective study. Perspect Clin Res. 2022;13(3):137-144. doi:10.4103/picr.PICR_15_20
- Sistema Renina-Angiotensina-Aldosterone (SRAA) e ipertensione
Il Sistema Renina-Angiotensina-Aldosterone (SRAA) è un meccanismo ormonale di vitale importanza per la regolazione della pressione sanguigna e l’omeostasi idroelettrolitica. Il sistema viene innescato dalla secrezione dell’enzima renina, prodotto dai reni in risposta a stimoli quali ridotta pressione sanguigna, ipovolemia o scarsità di sodio (1). Al suo rilascio, consegue una reazione a catena che conduce alla produzione di angiotensina II ad opera dell’enzima di conversione dell’angiotensina (ACE), presente nelle cellule endoteliali di piccoli e grandi vasi. Angiotensina II è un potente vasocostrittore, attiva il sistema simpatico e stimola la secrezione surrenalica di aldosterone con conseguente ritenzione di sodio (1). L’angiotensina II può essere sia circolante che tissutale ed è responsabile dell’aumento della pressione sanguigna attraverso l’attivazione del suo recettore di tipo 1 (AT1) (3). ACE non è l’unico enzima che media la produzione di angiotensina II: anche il complesso enzimatico CAGE (enzima generante angiotensina II chemiostatico-sensibile), la chimasi e la catepsina G possono convertire angiotensina I in angiotensina II (4,5). Fondamentale è anche l’azione dell’aldosterone, ormone terminale del SRAA, che regola l’equilibrio dei liquidi corporei e di vari elettroliti, tra cui sodio e potassio (1). Il SRAA regola dunque la pressione sanguigna, mantiene la tonicità vascolare e l’omeostasi idroelettrolitica corporea fondamentale per un corretto funzionamento di cuore e reni, senza rispettivi sovraccarichi (2). Tuttavia, la sua attivazione cronica, in molteplici patologie, comporta svariati effetti negativi, soprattutto a livello cardiovascolare.
L’iperattivazione del SRAA ha un’azione fortemente vasocostrittiva, ipertrofica, pro-fibrotica e pro-infiammatoria, a livello della muscolatura liscia, e conduce all’ipertensione sistemica e al rimodellamento dei tessuti cardiovascolari e renali. Inoltre favorisce l’insorgenza e la progressione del danno cardiovascolare in patologie quali ipertensione, infarto miocardico acuto e insufficienza cardiaca cronica. L’attivazione cronica del SRAA è anche coinvolta nello sviluppo di malattie renali croniche, complicazioni epatiche (alimentate dall’azione pro-infiammatoria), obesità (per l’azione sugli adipociti), diabete e disturbi del sistema nervoso (2). Di fatto, la disregolazione del SRAA alimenta il rischio cardiovascolare e di danno d’organo a cui conseguono eventi clinici anche fatali. Per questa ragione, sono molti i farmaci ideati per agire sull’iperattivazione del SRAA: gli ACE-inibitori impediscono la conversione di angiotensina I in angiotensina II; i sartani bloccano il legame dell’angiotensina II al suo recettore AT1; e, infine, gli antagonisti dei recettori dei mineralcorticoidi agiscono a valle, frenando le conseguenze dell’azione dell’aldosterone.
- Farmaci antipertensivi: gli ACE-inibitori
Il primo farmaco ACE-inibitore messo in commercio per il trattamento dell’ipertensione è stato captopril, nel 1980, seguito rapidamente da numerosi altri quali enalapril, perindopril, lisinopril, ramipril, quinapril, benazepril, cilazapril, trandolapril, fosinopril, moexipril, imidapril e zofenopril (3). Tutte queste sono molecole analoghe alla 2-metilpropionil-L-prolina (6). Il target molecolare di questa classe di medicinali è l’enzima ACE, responsabile della conversione da angiotensina I ad angiotensina II. ACE è una zinco-metalloproteinasi, generalmente ancorata alla membrana cellulare – solo una piccola parte viene rilasciata in circolo – e localizzata in vari tessuti i cui principali sono l’endotelio, di piccoli e grandi vasi, e i tessuti polmonari (3,7).
Dato il suo strategico posizionamento, ACE regola la quantità di angiotensina II circolante, la quale ha un ruolo di potente vasocostrittore. Di conseguenza, gli ACE-inibitori attuano un significativo effetto vasodilatatore che riduce la resistenza anche di piccole arteriole. La riduzione di angiotensina II aumenta la natriuresi, abbassa la pressione sanguigna e previene il rimodellamento del muscolo liscio e dei miociti cardiaci; ne consegue una riduzione della pressione arteriosa e venosa che riduce il pre- e il post-carico del cuore (8). La gittata e il battito cardiaco rimangono invariati e non viene riportata ipotensione posturale. Inoltre, gli ACE-inibitori interferiscono con la degradazione della bradichinina ossia un peptide, anch’esso substrato di ACE, che induce la vasodilatazione stimolando il rilascio di ossido nitrico (3,6).
Le caratteristiche farmacocinetiche e farmacodinamiche di ciascun ACE-inibitore dipendono dalla loro specifica affinità, potenza, lipofilia e ritenzione da parte dei tessuti che esprimono ACE; tali fattori ne determinano il perdurare dell’inibizione. Sebbene gli ACE-inibitori non agiscano sulla produzione di angiotensina II che si verifica per vie enzimatiche alternative – le quali potrebbero attenuare l’effetto antipertensivo nel lungo termine (9) –, questa classe di farmaci dimostra un adeguato controllo pressorio per mesi o anni. Tale effetto sembra essere dovuto alla mancata degradazione di peptidi vasodilatatori, tra cui la bradichinina (3).
L’efficacia terapeutica antipertensiva degli ACE-inibitori riduce il rischio di quelle problematiche cardiovascolari e coronariche tipicamente associate ad elevati valori di pressione sanguigna (8). La loro azione correla con una riduzione dell’ipertrofia ventricolare sinistra, una riduzione dell’irrigidimento di piccole e grandi arterie e un miglioramento della funzione endoteliale (10,11). Inoltre, alcuni ACE-inibitori sembrano esercitare un effetto nefroprotettivo nei pazienti con nefropatia diabetica, grazie all’efficace riduzione della pressione sanguigna (3,12).
- Ramipril
3.1. Indicazioni e posologia
Ramipril, sviluppato alla fine degli anni ’80 (13), è un profarmaco appartenente alla classe degli ACE-inibitori. Ramipril (Figura 1) viene metabolizzato in ramiprilato, un potente inibitore competitivo di ACE nel fegato e, in misura minore, nei reni. Ramipril è indicato:
- per il trattamento dell’ipertensione;
- in prevenzione cardiovascolare;
- per il trattamento delle patologie renali;
- per il trattamento dell’insufficienza cardiaca sintomatica;
- in prevenzione secondaria dopo infarto miocardico acuto.
In prevenzione cardiovascolare, Ramipril ha mostrato di ridurre morbilità e mortalità in pazienti con patologie cardiovascolari aterotrombotiche conclamate (pregresse patologie coronariche o ictus, o patologie vascolari periferiche) o con diabete con almeno un fattore di rischio cardiovascolare. Per il trattamento delle patologie renali, Ramipril è indicato nello specifico nella nefropatia glomerulare diabetica incipiente, definita dalla presenza di microalbuminuria, nella nefropatia glomerulare diabetica conclamata, definita da macroproteinuria in pazienti con almeno un fattore di rischio cardiovascolare, e nella nefropatia glomerulare non diabetica conclamata (macroproteinuria ≥ 3 g/die). In prevenzione secondaria dopo infarto miocardico acuto, Ramipril ha mostrato efficacia di riduzione della mortalità dopo la fase acuta dell’infarto miocardico in pazienti con segni clinici di insufficienza cardiaca quando iniziato dopo 48 ore dall’insorgenza dell’infarto miocardico acuto.
L’RCP raccomanda che Ramipril venga assunto, deglutito per via orale con un liquido e non masticato o sbriciolato, ogni giorno alla stessa ora. Ramipril può essere assunto prima, durante o dopo i pasti, in considerazione del fatto che l’assunzione di cibo non modifica la sua biodisponibilità. Per quanto riguarda i pazienti adulti in trattamento con un diuretico, dopo l’inizio del trattamento con Ramipril è possibile che si verifichi ipotensione. Per questo motivo, è raccomandata cautela in quanto questi pazienti potrebbero presentare deplezione di volume plasmatico e/o di sali. Inoltre, il diuretico dovrebbe essere sospeso 2 o 3 giorni prima dell’inizio della terapia con Ramipril. Nell’eventualità in cui il diuretico non sia stato sospeso nei pazienti ipertesi, si raccomanda di iniziare la terapia con una dose di 1,25 mg di Ramipril, di monitorare la funzione renale e il potassio sierico e di aggiustare la dose successiva in base al valore della pressione arteriosa che si vuole raggiungere. Nel paziente iperteso, la dose deve essere individualizzata in accordo con il profilo del paziente e con il controllo della pressione arteriosa. Inoltre, Ramipril, che può essere usato in monoterapia o in combinazione con altre classi di farmaci antipertensivi, deve essere iniziato gradualmente con la dose raccomandata di 2,5 mg al giorno. I pazienti con una iperattivazione del SRAA possono presentare un calo eccessivo della pressione arteriosa dopo l’assunzione della prima dose, per cui si raccomanda di iniziare con una dose di 1,25 mg, sotto il controllo del medico. Tale dose può essere raddoppiata a intervalli di 2-4 settimane in modo da raggiungere progressivamente il valore richiesto di pressione arteriosa; non va comunque superata la dose massima di 10 mg al giorno. La dose viene di solito assunta in un’unica somministrazione giornaliera. Nel caso della prevenzione cardiovascolare, la dose iniziale raccomandata è di 2,5 mg una volta al giorno. Questo dosaggio deve essere gradualmente incrementato sulla base della tollerabilità del paziente al principio attivo. Si raccomanda di raddoppiare la dose dopo 1-2 settimane di trattamento e, dopo ulteriori 2-3 settimane, di incrementarla fino a raggiungere la dose target di mantenimento di 10 mg, sempre una volta al giorno. Per quanto riguarda il trattamento delle patologie renali, la dose iniziale raccomandata nei pazienti con diabete e microalbuminuria è di 1,25 mg una volta al giorno. Questo dosaggio va gradualmente aumentato sulla base della tollerabilità al principio attivo. Si raccomanda di raddoppiare la dose singola giornaliera a 2,5 mg dopo 2 settimane e a 5 mg dopo 2 ulteriori settimane. Nei pazienti con diabete e almeno un fattore di rischio cardiovascolare, la dose iniziale raccomandata è di 2,5 mg una volta al giorno, da incrementare gradualmente sulla base della tollerabilità. Nello specifico, si raccomanda di raddoppiare la dose singola giornaliera a 5 mg dopo 1-2 settimane e quindi a 10 mg − dose giornaliera target − dopo ulteriori 2-3 settimane. Nei pazienti con nefropatia non diabetica, definita da macroproteinuria ≥ 3 g/die, la dose iniziale raccomandata è 1,25 mg una volta al giorno, dosaggio che va gradualmente incrementato sulla base della tollerabilità. Si raccomanda di raddoppiare la dose singola giornaliera a 2,5 mg dopo 2 settimane e quindi a 5 mg dopo 2 ulteriori settimane. Per il trattamento dell’insufficienza cardiaca sintomatica, nei pazienti stabilizzati, con concomitante terapia diuretica, la dose iniziale raccomandata è di 1,25 mg al giorno. Ramipril deve essere titolato raddoppiando la dose ogni 1-2 settimane fino ad una dose massima giornaliera di 10 mg. In questa casistica, sono preferibili due somministrazioni al giorno. Nella prevenzione secondaria in pazienti con pregresso infarto miocardico acuto e con insufficienza cardiaca, dopo 48 ore dall’infarto del miocardio, quando clinicamente ed emodinamicamente stabili, la dose iniziale raccomandata è di 2,5 mg due volte al giorno per 3 giorni. Se questo dosaggio non è tollerato, deve essere somministrata una dose di 1,25 mg due volte al giorno per 2 giorni prima di aumentarla a 2,5 mg e a 5 mg due volte al giorno. Se la dose non può essere aumentata a 2,5 mg due volte al giorno, il trattamento deve essere interrotto. La dose giornaliera va successivamente aumentata raddoppiandola a intervalli da 1 a 3 giorni fino alla dose di mantenimento di 5 mg due volte al giorno. Quando possibile, la dose di mantenimento viene suddivisa in due somministrazioni al giorno. Al momento non esistono ancora dati sufficienti in pazienti con insufficienza cardiaca grave (New York Heart Association − NYHA − classification IV) immediatamente dopo infarto del miocardio. Se si decide di trattare questi pazienti si raccomanda di iniziare la terapia con una dose da 1,25 mg una volta al giorno e di incrementare la dose con particolare cautela. Nei pazienti con insufficienza renale la dose giornaliera deve essere basata sulla clearance della creatinina: se questa è ≥ 60 mL/min, non è necessario aggiustare la dose iniziale (2,5 mg/die) e la dose massima giornaliera è di 10 mg; se questa è compresa tra 30-60 mL/min non è necessario aggiustare la dose iniziale (2,5 mg/die) e la dose massima giornaliera è di 5 mg; se questa è compresa tra 10-30 mL/min, la dose iniziale è 1,25 mg/die e la dose massima giornaliera è di 5 mg. In pazienti ipertesi in emodialisi Ramipril è scarsamente dializzabile: la dose iniziale è quindi di 1,25 mg/die − dose massima giornaliera, 5 mg − da somministrare poche ore dopo la dialisi. Nei pazienti con insufficienza epatica, il trattamento con Ramipril deve essere iniziato solo sotto stretto controllo medico e la dose massima giornaliera è di 2,5 mg. Negli anziani, deve essere presa in considerazione una dose iniziale ridotta di 1,25 mg e la titolazione deve essere molto graduale a causa della maggiore probabilità di comparsa di effetti indesiderati in particolare in pazienti molto anziani o debilitati. La sicurezza e l’efficacia di Ramipril nei bambini non è stata ancora stabilita e non può quindi essere fatta alcuna raccomandazione specifica riguardante la posologia.
3.2. Meccanismo d’azione
Il SRAA è un importante sistema di regolazione della pressione sanguigna, dell’emodinamica e dell’equilibrio idrico ed elettrolitico nel corpo umano. Quando l’angiotensina I passa attraverso i polmoni, viene ulteriormente convertita in angiotensina II da ACE, presente nelle cellule endoteliali vascolari dei polmoni. L’angiotensina II ha diversi effetti che contribuiscono all’ottimizzazione della pressione sanguigna: agisce nel cervello e aumenta il rilascio di vasopressina che, riassorbendo i liquidi dai reni, migliora la pressione sanguigna; provoca la vasocostrizione arteriolare che a sua volta aumenta la pressione sanguigna incrementando la resistenza periferica totale; agisce sulla corteccia surrenale e promuove il rilascio di aldosterone. L’aldosterone agisce ulteriormente sulle cellule tubulari renali e determina il riassorbimento del sodio, che provoca il riassorbimento dell’acqua nei dotti collettori, e aumenta il deflusso di adrenalina dal sistema nervoso centrale, con conseguente aumento della pressione sanguigna. Ramipril inibisce il SRAA legandosi ad ACE e inibendolo, impedendo così la conversione dell’angiotensina I in angiotensina II (14). La conseguente diminuzione dell’attività simpatica, la diminuzione del riassorbimento di sodio e acqua dai reni e il rilassamento della muscolatura liscia delle arteriole hanno l’effetto finale di diminuire la pressione sanguigna. Quando i livelli plasmatici di angiotensina II diminuiscono, si verifica una minore attivazione dei recettori accoppiati a proteine G dell’angiotensina I (AT1R) e dell’angiotensina II (AT2R). AT1R media la vasocostrizione, l’infiammazione, la fibrosi e lo stress ossidativo attraverso una serie di vie di segnalazione. La conseguente vasocostrizione e la riduzione dell’infiammazione mediano gli effetti nefroprotettivi, antipertensivi e cardioprotettivi di Ramipril. AT2R agisce in opposizione agli effetti di AT1R portando alla vasodilatazione. ACE è anche responsabile della degradazione della bradichinina, un vasodilatatore. Il conseguente accumulo di bradichinina dovuto all’inibizione di ACE, oltre a indurre una maggiore vasodilatazione e una riduzione della pressione sanguigna, è ritenuto anche responsabile della caratteristica tosse secca, effetto collaterale dei farmaci ACE-inibitori, incluso Ramipril.
3.3. Farmacocinetica
Ramipril è un profarmaco inattivo che viene convertito in ramiprilato nel fegato, principale sito di attivazione, e nei reni. L’entità dell’assorbimento di Ramipril è almeno del 50-60%. Il cibo diminuisce la velocità di assorbimento dal tratto gastrointestinale senza influenzarne l’entità. Le biodisponibilità assoluta di Ramipril e del ramiprilato sono rispettivamente del 28% e del 44% quando la somministrazione orale è confrontata con quella endovenosa. La concentrazione sierica di ramiprilato rimane invariata quando le capsule vengono aperte e il contenuto sciolto in acqua, in succo di mela o sospeso in salsa di mela. Il legame proteico di Ramipril è di circa il 73% e quello del ramiprilato di circa il 56%, ed è indipendente dalla concentrazione nell’intervallo 0,1 μg/mL – 10 μg/mL. Il 25% del metabolismo epatico produce il metabolita attivo ramiprilato attraverso gli enzimi epatici esterasi. Il 100% del metabolismo renale converte Ramipril in ramiprilato. Gli altri metaboliti sono inattivi. Dopo la somministrazione orale, circa il 60% della dose viene eliminata nelle urine come Ramipril immutato (< 2%) e i suoi metaboliti. Circa il 40% della dose si ritrova nelle feci, rappresentando sia il farmaco non assorbito che il farmaco e i metaboliti eliminati attraverso l’escrezione biliare. L’escrezione urinaria di Ramipril può essere ridotta nei pazienti con funzionalità renale compromessa. Il rapido declino iniziale rappresenta la distribuzione nei tessuti e ha un’emivita di 2-4 ore. L’emivita della fase di eliminazione apparente è di 9-18 ore, che si ritiene rappresenti la clearance del farmaco libero. L’emivita della fase di eliminazione terminale è > 50 ore e si ritiene che rappresenti la clearance del farmaco legato ad ACE a causa della sua lenta dissociazione. L’emivita di ramiprilato dopo dosi giornaliere multiple (DDM) è dose-dipendente e varia da 13-17 ore con DDM da 5-10 mg a 27-36 ore con DDM da 2,5 mg. La clearance renale di Ramipril e del ramiprilato è stata riportata a 7,2 e 77,4 mL/min/1,73 m2, rispettivamente, mentre in pazienti anziani sani con funzionalità renale normale è stata riportata a 10,7 e 126,8 mL/min/1,73 m2, rispettivamente; inoltre la concentrazione plasmatica massima del ramiprilato è circa il 20% più alta in questa popolazione. Mentre la farmacocinetica di Ramipril sembra non essere influenzata da una ridotta funzionalità renale, la concentrazione plasmatica e l’emivita del ramiprilato sono aumentate. Nei pazienti con insufficienza epatica la concentrazione di Ramipril è inizialmente aumentata mentre il tempo massimo necessario al raggiungimento della concentrazione plasmatica massima del ramiprilato è prolungato a causa della ridotta capacità di metabolizzare il farmaco. Tuttavia, le concentrazioni allo stato stazionario di ramiprilato sono le stesse nell’insufficienza epatica e nei pazienti sani.
3.4. Sicurezza e tollerabilità
Il profilo di sicurezza di Ramipril include tosse secca persistente e reazioni dovute all’ipotensione. Reazioni avverse gravi comprendono angioedema, angioedema intestinale (con dolore addominale con o senza nausea o vomito), iperkaliemia, compromissione epatica o renale, pancreatiti, reazioni cutanee gravi, sindrome da inappropriata secrezione di ormone anti-diuretico e conseguente iponatriemia e, più raramente, neutropenia/agranulocitosi, trombocitopenia, anemia, e depressione del midollo osseo. Tra le reazioni avverse meno gravi si notano tachicardia, congestione nasale e rinite, congiuntivite, tremore e orticaria. I sintomi associati al sovradosaggio di ACE-inibitori possono includere vasodilatazione periferica eccessiva (con marcata ipotensione, shock), bradicardia, alterazione degli elettroliti, scompenso renale. Alcuni effetti indesiderati (ad esempio sintomi del calo pressorio quali capogiri) possono interferire con la capacità di concentrazione e di reazione del paziente e perciò rappresentano un rischio in situazioni in cui queste capacità siano particolarmente importanti. Questo può verificarsi in modo particolare all’inizio del trattamento o quando si sta sostituendo un’altra terapia. Dopo la prima dose o incremento di dose non è consigliabile guidare o usare macchinari per diverse ore.
Ramipril è controindicato, oltre che nei casi di ipersensibilità al principio attivo, a uno qualsiasi degli eccipienti elencati in RCP, o ad altri ACE-inibitori, anche nei casi di riscontro anamnestico di angioedema (ereditario, idiopatico o pregresso angioedema con ACE-inibitori o sartani), nei trattamenti extracorporei che portano il sangue a contatto con superfici caricate negativamente, nei casi di stenosi bilaterale significativa dell’arteria renale o stenosi unilaterale in pazienti con rene unico funzionante, e in gravidanza. Per le pazienti che stanno pianificando una gravidanza si raccomanda di ricorrere a trattamenti antipertensivi alternativi, con comprovato profilo di sicurezza per l’uso in gravidanza, a meno che non sia considerato essenziale il proseguimento della terapia con Ramipril. Quando viene accertata una gravidanza, il trattamento deve essere interrotto immediatamente e, se appropriato, deve essere iniziata una terapia alternativa. Poiché le informazioni sull’uso di Ramipril durante l’allattamento sono insufficienti, esso non è raccomandato ed è preferibile ricorrere a trattamenti alternativi con profilo di sicurezza meglio stabilito durante l’allattamento, specialmente quando si allatta un neonato o un neonato pretermine. Ramipril è inoltre controindicato nei pazienti con ipotensione o emodinamicamente instabili, concomitantemente all’uso di medicinali contenenti aliskiren, e nei pazienti affetti da diabete mellito o compromissione renale (velocità di filtrazione glomerulare GFR < 60 mL/min/1,73 m2). Esiste inoltre l’evidenza che l’uso combinato di ACE-inibitori, sartani o aliskiren aumenta il rischio di ipotensione e iperkaliemia e riduce la funzionalità renale (insufficienza renale acuta inclusa). Il duplice blocco del SRAA attraverso l’uso combinato di ACE-inibitori, sartani o aliskiren non è pertanto raccomandato. Se la terapia del duplice blocco è considerata assolutamente necessaria, ciò deve avvenire solo sotto la supervisione di uno specialista e con uno stretto e frequente monitoraggio della funzionalità renale, degli elettroliti e della pressione sanguigna. Gli ACE-inibitori e i sartani non devono essere usati contemporaneamente in pazienti con nefropatia diabetica. I pazienti con iperattivazione del SRAA sono a rischio di forte ipotensione e deterioramento della funzione renale dovuto all’inibizione di ACE, specialmente quando l’ACE-inibitore o un diuretico in associazione sono somministrati per la prima volta o al primo incremento della dose. Deve essere prevista un’attivazione rilevante del SRAA ed è necessaria una supervisione medica che includa il monitoraggio della pressione per esempio in pazienti con ipertensione grave, pazienti con insufficienza cardiaca congestizia scompensata, pazienti con ostacolo emodinamicamente rilevante all’afflusso o al deflusso ventricolare sinistro (ad esempio stenosi valvolare aortica o mitralica), pazienti con stenosi unilaterale dell’arteria renale con secondo rene funzionante, pazienti in cui vi è o si può sviluppare deplezione di fluidi o di sali (inclusi i pazienti in trattamento con i diuretici), pazienti con cirrosi epatica e/o ascite, durante interventi chirurgici importanti o durante anestesia con farmaci che causano ipotensione. In genere si raccomanda di correggere la disidratazione, l’ipovolemia o la deplezione di sali prima di iniziare il trattamento (tuttavia nei pazienti con insufficienza cardiaca tale azione correttiva deve essere attentamente valutata contro il rischio di un sovraccarico). In caso di insufficienza cardiaca transitoria o persistente post infarto miocardico, e nei pazienti a rischio di ischemia cardiaca o cerebrale in caso di ipotensione acuta, la fase iniziale del trattamento richiede un attento controllo medico. Se possibile, si raccomanda di interrompere il trattamento con Ramipril un giorno prima dell’intervento chirurgico.
3.5. Studi più rilevanti
- Gli studi HOPE (15) e HOPE-TOO (16): l’efficacia a lungo termine di Ramipril nella prevenzione cardiovascolare
L’efficacia terapeutica di Ramipril nella prevenzione cardiovascolare è supportata da diversi studi (17,18), tra cui lo studio principale HOPE (Heart Outcomes Prevention Evaluation) (15) e lo studio secondario HOPE-TOO (HOPE-The Ongoing Outcome) (16). Lo studio HOPE (15), randomizzato in doppio cieco, ha coinvolto, per una media di 5 anni, un totale di 9.297 pazienti ≥ 55 anni ad alto rischio cardiovascolare. Di questi pazienti, 2.480 erano donne, 5.128 avevano almeno 65 anni, 8.162 erano affetti da malattie cardiovascolari, 4.355 (quindi circa il 50%) soffrivano di ipertensione controllata, 3.577 avevano il diabete. Lo studio ha valutato gli effetti del trattamento con Ramipril 10 mg vs placebo nel prevenire l’endpoint primario composito di infarto del miocardio, ictus o morte per cause cardiovascolari. Lo studio ha valutato inoltre gli effetti su ciascun esito separatamente e, come esiti secondari includeva il decesso per tutte le cause, la necessità di rivascolarizzazione, l’ospedalizzazione per angina instabile o insufficienza cardiaca e le complicanze legate al diabete, il peggioramento dell’angina, l’insufficienza cardiaca e lo sviluppo del diabete. Ramipril ha ridotto significativamente i tassi, sia individuali che compositi, di ictus, infarto del miocardio o morte cardiovascolare, in confronto al placebo (p < 0,001). Degno di nota, il 14% dei pazienti assegnati a Ramipril raggiungevano l’endpoint primario, contro il 18% di quelli assegnati al placebo. È stato inoltre riscontrato un rischio significativamente ridotto di mortalità per cause cardiovascolari, rivascolarizzazione, complicazioni legate al diabete, infarto del cardiaco, scompenso cardiaco per tutte le cause, peggioramento dell’angina o nuova diagnosi di diabete nei pazienti trattati con Ramipril rispetto a quelli trattati con placebo. Inoltre, in un’analisi sul sottogruppo di pazienti anziani di età ≥ 75 anni (n = 998), il trattamento con Ramipril riduceva il rischio cardiovascolare nella stessa entità dello studio principale, mentre non vi erano differenze significative tra i due gruppi di età (55-75 anni vs ≥ 75 anni) nei due outcome, primario e secondario, ad eccezione dell’incidenza di rivascolarizzazione che era significativamente minore nei pazienti più anziani (17.1% vs 10.7%) (19). Per riassumere, l’effetto benefico del trattamento con Ramipril sull’esito composito è stato costantemente osservato tra i seguenti sottogruppi predefiniti: donne e uomini (20), pazienti con ipertensione al basale e quelli senza, pazienti con evidenza di malattia cardiovascolare e quelli senza tale evidenza, pazienti di età inferiore a 65 anni e quelli di età pari o superiore a 65 anni, pazienti con diabete e quelli senza diabete, e pazienti con microalbuminuria e quelli senza (si vedano gli approfondimenti di questi ultimi due confronti nei prossimi paragrafi) (Figura 3). In aggiunta, un sottostudio ha valutato gli effetti di una bassa dose di Ramipril (2,5 mg al giorno vs 10 mg al giorno vs placebo) su un gruppo di 244 pazienti. Circa il 14% dei pazienti trattati con una bassa dose di Ramipril hanno raggiunto l’endpoint composito, contro il 13% di quelli assegnati all’assunzione di 10 mg di Ramipril al giorno e il 17% di quelli assegnati al placebo. L’inclusione dei dati del gruppo a basso dosaggio non ha modificato i risultati (15). I risultati dello studio HOPE (15) sono stati confermati anche dallo studio SECURE (Study to Evaluate Carotid Ultrasound changes in patients or calcium channel blockade on the circadian variation of heart rate variability, treated with Ramipril and vitamin E) (21) che ha mostrato, in aggiunta, l’efficacia di Ramipril e vitamina E nel rallentamento della progressione dell’aterosclerosi (i.e. i cambiamenti dell’ecografia carotidea).
Per valutare se i benefici osservati nello studio HOPE (15) perdurassero, lo studio è stato prolungato di 2,6 anni, risultando nello studio di estensione HOPE-TOO (16). Dello studio principale, 4.528 pazienti hanno accettato di essere sottoposti a un ulteriore follow-up.
I pazienti erano equamente distribuiti tra gruppo di trattamento con Ramipril (72%) e gruppo placebo (68%). Durante questo follow-up, i pazienti assegnati a Ramipril hanno riportato un rischio relativo di infarto del miocardio ulteriormente ridotto del 19% (95% CI, da 0,65 a 1,01), un rischio relativo di rivascolarizzazione ridotto del 16% (95% CI, 0,70-0,99) e un ridotto rischio relativo di nuova diagnosi di diabete del 34% (95% CI, 0,46-0,95). Riduzioni simili dei rischi relativi degli eventi vascolari sono state osservate durante e dopo la fase attiva dello studio, indipendentemente dal rischio al basale o dai trattamenti accessori (aspirina, beta-bloccanti, ipoglicemizzanti), avvalorando i risultati dello studio principale HOPE (15) ed estendendoli nel lungo termine (Figura 4).
- Lo studio MICRO-HOPE (22): effetti nefroprotettivi di Ramipril
Lo studio MICRO-HOPE (Microalbuminuria, Cardiovascular and Renal Outcomes-HOPE) (22) ha invece misurato, in un totale di 3.577 pazienti ≥ 55 anni con diabete (sia di tipo 1 che di tipo 2, anche se l’esatta proporzione nel campione non è specificata) assegnati in modo casuale a Ramipril (10 mg/die) o placebo, e a vitamina E o placebo (confronto tra questi ultimi due n.s.), l’incidenza del rischio cardiovascolare e dello sviluppo di nefropatia. I pazienti avevano storia di un precedente evento cardiovascolare o almeno un altro fattore di rischio cardiovascolare, e non riportavano proteinuria clinica, insufficienza cardiaca o ridotta frazione di eiezione, e non assumevano ACE-inibitori. Lo studio, interrotto con 6 mesi di anticipo a causa di un consistente beneficio di Ramipril rispetto al placebo, ha mostrato come Ramipril abbia ridotto il rischio dell’endpoint primario composito del 25%, di infarto miocardico del 22%, di ictus del 33%, di morte cardiovascolare del 37%, di mortalità totale del 24%, di rivascolarizzazione del 17%. Importante, Ramipril ha ridotto del 24% il rischio di nefropatia conclamata sia nei partecipanti che presentavano sia in quelli che non presentavano microalbuminuria al basale. Inoltre, il trattamento con Ramipril ha portato a un rapporto albumina/creatinina più basso rispetto al placebo a 1 anno e alla fine dello studio (Figura 5). Ramipril si è quindi dimostrato efficace non solo nella riduzione degli eventi cardiovascolari ma anche della nefropatia conclamata nelle persone con diabete. Da notare, tuttavia, che Ramipril non ha avuto alcun effetto sullo sviluppo della microalbuminuria in pazienti normoalbuminurici al basale. Inoltre, a sostegno dei risultati degli studi principali, il beneficio cardiovascolare era maggiore di quello attribuibile alla mera riduzione della pressione arteriosa. Ramipril ha quindi sia effetti cardioprotettivi che nefroprotettivi nei pazienti con diabete. Questi risultati sono stati confermati anche da studi successivi, ponendo l’attenzione sul ruolo di Ramipril nella modulazione del SRAA, la cui azione non solo comporta la regolazione della pressione sanguigna e del metabolismo idrosalino, ma svolge anche un ruolo importante nello sviluppo della nefropatia diabetica (23).
- Ramipril riduce l’incidenza di sviluppo di diabete di nuova insorgenza in pazienti con malattia vascolare
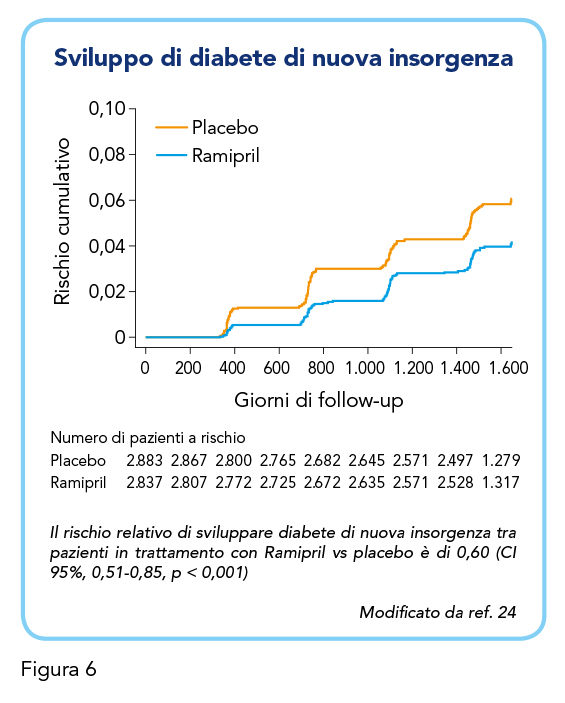
Considerando che gli studi precedentemente riportati coinvolgevano anche pazienti con diabete (22), entrando ancora più nel merito dell’argomento, una sottoanalisi del 2001 dello stesso gruppo di lavoro dello studio HOPE (15) ha valutato gli effetti di Ramipril sullo sviluppo di diabete di nuova insorgenza (24). Degli oltre 9.000 pazienti con malattia vascolare coinvolti nello studio HOPE (15), oltre un terzo presentava diabete e sono quindi stati esclusi da questa sottoanalisi. I restanti pazienti senza diabete erano distribuiti equamente tra gruppo con trattamento con Ramipril 10 mg e gruppo placebo. Solo il 3,6% dei pazienti inclusi nel gruppo Ramipril, contro il 5,4% di quelli inclusi nel gruppo placebo, hanno sviluppato diabete ex novo negli anni a venire (Figura 6). Tale diagnosi era documentata da livelli di emoglobina glicosilata HbA1c maggiori rispetto al limite superiore dell’intervallo normale e dalla prescrizione di un farmaco ipoglicemizzante o insulina: il confronto tra i due gruppi su entrambe queste misure era significativo (cumulativamente p < 0,003). Inoltre, il glucosio a digiuno aumentava maggiormente durante il trattamento con placebo che con Ramipril. Poiché Ramipril ha ridotto il rischio di eventi cardiovascolari e di nefropatia diabetica − da notare come questi risultati siano paralleli a quelli dello studio MICRO-HOPE (22) in pazienti che al contrario avevano diabete − gli autori di questo studio hanno anche valutato se la maggiore incidenza di questi eventi clinici nei pazienti con diabete fosse responsabile dell’aumentata probabilità di sviluppare diabete, ma questo non si è rivelato essere il caso. I risultati in merito agli effetti di Ramipril su pazienti con diabete sono stati confermati anche da studi più recenti (e.g. 25).
Conclusioni
Ramipril, un profarmaco approvato alla fine degli anni ’80, viene metabolizzato in ramiprilato, un potente inibitore competitivo di ACE nel fegato e, in misura minore, nei reni. Ramipril è indicato per il trattamento dell’ipertensione, in prevenzione cardiovascolare, per il trattamento delle patologie renali, per il trattamento dell’insufficienza cardiaca sintomatica e in prevenzione secondaria dopo infarto miocardico acuto. Ramipril è efficace nella prevenzione cardiovascolare in pazienti con età uguale o superiore ai 55 anni ad alto rischio cardiovascolare, in egual misura nei pazienti con ipertensione e nei pazienti più anziani. Questa efficacia, inoltre, è stata dimostrata perdurare nel lungo termine. Ramipril ha inoltre effetti cardioprotettivi e nefroprotettivi nei pazienti con diabete, riducendone l’incidenza del rischio di nefropatia conclamata. nei pazienti senza diabete, invece, Ramipril riduce l’incidenza di sviluppo di diabete di nuova insorgenza, dimostrando ancora una volta le sue proprietà preventive.
Bibliografia
- Ames MK, Atkins CE, Pitt B. The renin-angiotensin-aldosterone system and its suppression. J Vet Intern Med. 2019 Mar;33(2):363–82.
- Patel S, Rauf A, Khan H, Abu-Izneid T. Renin-angiotensin-aldosterone (RAAS): The ubiquitous system for homeostasis and pathologies. Biomed Pharmacother. 2017 Oct;94:317–25.
- Laurent S. Antihypertensive drugs. Pharmacol Res. 2017 Oct;124:116–25.
- Ram CVS. Angiotensin receptor blockers: current status and future prospects. Am J Med. 2008 Aug;121(8):656–63.
- Borghi, C. B., Rossi, F. R., & Trimarco, B. T. (2015). Ruolo Del Sistema Renina Angiotensina Aldosterone E Dei Farmaci Che Inibiscono Tale Sistema Nelle Malattie Cardiovascolari: Complessità E Criticità. Position Paper SIF – SIIA. Disponibile al sito: https://siia.it/wp-content/uploads/2015/07/03-PositionPaper-43-71.pdf”
- Piepho RW. Overview of the angiotensin-converting-enzyme inhibitors. American Journal of Health-System Pharmacy. 2000 Oct 1;57(suppl_1):S3–7.
- Dzau VJ. Mechanism of action of angiotensin-converting enzyme (ACE) inhibitors in hypertension and heart failure. Role of plasma versus tissue ACE. Drugs. 1990;39 Suppl 2:11–6.
- Herman LL, Padala SA, Ahmed I, Bashir K. Angiotensin Converting Enzyme Inhibitors (ACEI). In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 [cited 2022 Jul 6]. Available from: http://www.ncbi.nlm.nih.gov/books/NBK431051/
- Petrie MC, Padmanabhan N, McDonald JE, Hillier C, Connell JM, McMurray JJ. Angiotensin converting enzyme (ACE) and non-ACE dependent angiotensin II generation in resistance arteries from patients with heart failure and coronary heart disease. J Am Coll Cardiol. 2001 Mar 15;37(4):1056–61.
- Tropeano AI, Boutouyrie P, Pannier B, Joannides R, Balkestein E, Katsahian S, et al. Brachial pressure-independent reduction in carotid stiffness after long-term angiotensin-converting enzyme inhibition in diabetic hypertensives. Hypertension. 2006 Jul;48(1):80–6.
- Agabiti-Rosei E, Heagerty AM, Rizzoni D. Effects of antihypertensive treatment on small artery remodelling. J Hypertens. 2009 Jun;27(6):1107–14.
- Lewis EJ, Hunsicker LG, Bain RP, Rohde RD. The effect of angiotensin-converting-enzyme inhibition on diabetic nephropathy. The Collaborative Study Group. N Engl J Med. 1993 Nov 11;329(20):1456–
- Vasmant D, Bender N. The renin-angiotensin system and ramipril, a new converting enzyme inhibitor. J Cardiovasc Pharmacol. 1989;14 Suppl 4(SUPPL. 4). doi:10.1097/00005344-198900000-00011
- Renin and Angiotensin | Goodman & Gilman’s: The Pharmacological Basis of Therapeutics, 13e | AccessMedicine | McGraw Hill Medical. Accessed August 31, 2022. https://accessmedicine.mhmedical.com/content.aspx?sectionid=170106980&bookid=2189#194547191
- Yusuf, Sleight, Pogue, Bosch, Davies, Dagenais. Effects Of An Angiotensin-Converting-Enzyme Inhibitor, Ramipril, On Cardiovascular Events In High-Risk Patients. The New England Journal of Medicine . Published online 2000.
- Bosch J, Lonn E, Pogue J, Arnold JMO, Dagenais GR, Yusuf S. Long-Term Effects of Ramipril on Cardiovascular Events and on Diabetes. Circulation. 2005;112(9):1339-1346. doi:10.1161/CIRCULATIONAHA.105.548461
- Anderson VR, Perry CM, Robinson DM, Bertrand ME. Ramipril A Review of its Use in Preventing Cardiovascular Outcomes in High-Risk Patients. Am J Cardiovasc Drugs. 2006;6(6):417-432.
- Frampton lames E, Peters DH, Ball S, et al. DRUG EVALUATION Ramipril An Updated Review of Its Therapeutic Use in Essential Hypertension and Heart Failure. Vol 49.; 1995.
- Bosch J, Probstfield J. Beneficial effects of ramipril on cardiovascular events in high-risk patients older than 75 years of age: Secondary outcomes from the HOPE trial. J Am Coll Cardiol. 2003;41(6):154. doi:10.1016/s0735-1097(03)81763-1
- Lonn E, Roccaforte R, Yi Q, et al. Angiotensin Antagonism Effect of Long-Term Therapy With Ramipril in High-Risk Women.; 2002.
- Lonn EM, Yusuf S, Dzavik V, et al. Effects of Ramipril and Vitamin E on Atherosclerosis. Circulation. 2001;103(7):919-925. doi:10.1161/01.CIR.103.7.919
- Gerstein HC, Yusuf S, Mann JFE, et al. Effects of ramipril on cardiovascular and microvascular outcomes in people with diabetes mellitus: Results of the HOPE study and MICRO-HOPE substudy. Lancet. 2000;355(9200):253-259. doi:10.1016/S0140-6736(99)12323-7
- Aladár Megyei Oktató Kórház P, Osztály K. The role of ramipril in the therapy of diabetic nephropathy. Orv Hetil. 2014;155(7):263-269. doi:10.1556/OH.2014.29827
- Yusuf S, Gerstein H, Hoogwerf B, et al. Ramipril and the Development of Diabetes. J Am Med Assoc. Published online 2001. https://jamanetwork.com/
- Bhardwaj RK, Kazal HL, Kohli K, et al. Effects of antihypertensive agents on the quality of life in diabetic hypertensive patients: A prospective study. Perspect Clin Res. 2022;13(3):137-144. doi:10.4103/picr.PICR_15_20
Related papers
La pubblicazione recente di alcuni lavori scientifici basati sulle risultanze di alcuni osservatori epidemiologi mondiali, ha riportato alla ribalta il ruolo chiave delle malattie cardiovascolari come prima causa di morte e disabilità, non solo nel presente, ma anche nel futuro proiettato oggi al 2050 con un incremento più o meno equamente distribuito tra le malattie [more info]
1) Lipoproteine ed aterosclerosi Le lipoproteine sono particelle composte da un nucleo ricco in esteri del colesterolo e trigliceridi (TG) circondati da colesterolo libero, fosfolipidi e apolipoproteine. Le lipoproteine plasmatiche vengono suddivise in varie classi (VLDL, IDL, LDL, HDL e chilomicroni) in base alle dimensioni, alla composizione lipidica e alle apolipoproteine presenti (Tabella 1). I [more info]
Introduzione Le malattie cardiovascolari rappresentano la principale causa di morbilità e mortalità a livello globale, nonostante i progressi nella prevenzione e nel trattamento farmacologico. In questo contesto, l’adozione di strategie terapeutiche efficaci per la gestione dei fattori di rischio cardiovascolare è fondamentale. La combinazione farmacologica di farmaci con meccanismi d’azione complementari è diventata una pratica [more info]